壳聚糖酶高产菌株的冷源等离子体诱变及发酵条件的优化
2018-04-12熊妍妍薛宇航陈小娥冯淑莹方旭波袁高峰余辉
熊妍妍,薛宇航,陈小娥*,冯淑莹,方旭波,袁高峰,余辉
1(浙江海洋大学 食品与医药学院,浙江 舟山,316022)2(杭州万向职业技术学院,浙江 杭州,310023)
壳聚糖酶(chitosanase,EC3.2.1.132.)是一种以内切方式催化水解部分乙酰化壳聚糖中β-1,4氨基葡萄糖苷键的酶,它能将壳聚糖(chitosan)降解为壳寡糖(chitooligosaccharides)。壳寡糖由于其生物相容性好,易于被人体吸收等优势,其商业产品已渗透诸多领域,主要涉及功能性食品、药品、环保、化工等[1]。目前获得壳寡糖的方法有物理法、化学法和生物酶解法三大类。相比而言,物理法、化学法生产壳寡糖会受到分离成本高、污染严重等限制,而生物酶解法生产壳寡糖则有环境相容性好、成本低、重复性好、寡糖产量高等优点[2],成为了目前壳寡糖生产的理想方法。研究发现,壳聚糖酶不仅可以降解壳聚糖,在农业上也可作为生物防治剂,在生物技术中可用于原生质体分离、细胞化学定位和生产单细胞蛋白等[3]。因此,如何获得优良菌株成为了开发壳聚糖酶微生物发酵法的重要任务[4]。
从自然界筛选出的野生菌株产酶能力一般不高,通过诱变选育是提高产酶水平的有效途径之一[5]。冷源等离体子是一种新型的诱变方法,它在电离过程中会产生活性氧自由基使遗传物质发生改变,如碱基缺失,染色体异位等[6-9],诱变效率高。此外,冷源等离子体诱变还具有操作简便、节约时间、无毒害性、无严苛条件等优点,被食品加工、制药等行业广泛地应用[10]。
目前关于产壳聚糖酶菌株的诱变选育研究大多采用紫外诱变[11]、化学诱变[12],采用冷源等离子体诱变的报道较少。本研究以本实验室筛选保藏的菌种为原始菌株,对其进行冷源等离子体诱变,探究诱变的最佳条件,并从中筛选出1株产壳聚糖酶活力最高的菌株,对其发酵条件进行优化,以期为壳聚糖酶的工业化发酵生产奠定基础。
1 材料与方法
1.1 实验材料
1.1.1实验菌种
鹿皮曲霉(Aspergilluscervinus)ZJOU-AC1,浙江海洋大学食品与科学工程研究室筛选保藏。
1.1.2培养基
斜面培养基:马铃薯葡萄糖琼脂培养基(PDA),121 ℃灭菌20 min。
计数培养基:马铃薯葡萄糖琼脂培养基(PDA),121 ℃灭菌20 min。
初筛培养基:胶体壳聚糖 5 g/L,酵母膏 1 g/L,(NH4)2SO42 g/L,KH2PO42 g/L,MgSO40.5 g/L,琼脂 20 g/L,pH 5.5~6.0,121 ℃灭菌20min[13]。
复筛培养基:胶体壳聚糖 5 g/L,酵母膏 1 g/L,(NH4)2SO42 g/L,KH2PO42 g/L,MgSO40.5 g/L,pH 5.5~6.0,121 ℃灭菌20 min[13]。
种子培养基:胶体壳聚糖 2 g/L,葡萄糖 10 g/L,(NH4)2SO42 g/L,KH2PO42 g/L,MgSO40.5 g/L,自然pH,121 ℃灭菌20 min[14]。
发酵培养基:胶体壳聚糖15 g/L,麸皮 20 g/L,(NH4)2SO44 g/L,KH2PO42 g/L,MgSO40.5 g/L,Tween-80 0.6 g/L,121 ℃灭菌20 min[14]。
1.2 仪器与设备
Phenix BK130 /3低温等离子体处理仪,美国凤凰科技公司;UV-5900紫外可见分光光度计,上海元析仪器有限公司;SPX-250B-Z生化培养箱,上海博讯实业有限公司医疗设备厂;JB-CJ-1FXS 型超净工作台,苏州佳宝净化工程设备有限公司;HYC-A全温摇床,上海玺袁科学仪器有限公司;LDZX-75KBS立式压力蒸汽灭菌锅,上海申安医疗器械厂。
1.3 实验方法
1.3.1冷源等离子体诱变
(1)诱变前预处理:用100 mL无菌水洗下斜面上的孢子,倒入盛有玻璃珠的250 mL锥形瓶中,28 ℃振荡30 min,得到孢子悬液。用血球计数板计数并调整孢子浓度为1×106~5×106个/mL,浓度用CFU法确认[15]。用移液枪移取3 mL孢子悬液,均匀地涂布于无菌平皿中,准备进行低温等离子体诱变。
(2)诱变处理:将装有孢子悬液的平皿放在低温等离子体处理仪的两个电极之间,把电压瞬间调到40 kV,处理的时间分别为0~270 s(处理时间每隔15 s递增)[16]。
(3)诱变后培养:处理后取出平皿,倾斜,用移液枪移取平皿中的孢子悬液,反复轻柔地冲洗平皿上诱变后的孢子。用移液枪移取500 μL孢子悬液,均匀地涂布于初筛培养基上,28 ℃倒置培养5 d,用于单菌落的挑选和致死率的计算。
(4)培养后致死率和突变率的计算:诱变培养后,统计对照组和实验组的单菌落数,计算致死率。
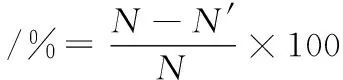
(1)
式中[17]:N为对照组单菌落数,CFU/mL;N’为实验组单菌落数,CFU/mL。
以原始菌株为对照,统计诱变菌株的透明圈大小。用游标卡尺测量透明圈直径与菌株直径,并计算HC值(透明圈直径mm/菌株直径mm)。以HC值为标准,将比值减小或增加10%以上的诱变菌株定义为突变菌株,按公式(1)计算:

(2)
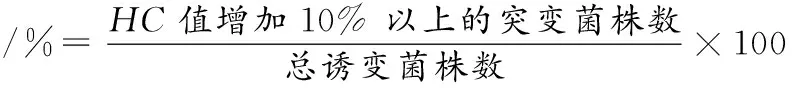
1.3.2突变菌株的筛选
(1)初筛和复筛:在最佳诱变时间段内,选择生长良好的正突变菌株,分别统计HC值并接种到发酵培养基中进行培养,测定壳聚糖酶活力,发酵条件为:发酵时间100 h,发酵温度28 ℃,初始pH值5.5,接种量3%,转速150 r/min[18]。
(2)突变菌株的酶活力及生长特性分析:将筛选出的突变菌株分别接种到发酵培养基,28 ℃,150 r/min发酵培养7 d。每隔24 h取1 mL发酵液测定壳聚糖酶活力,取7 d内的峰值;菌体的生物量测定采用通过比色法测定菌体核酸浓度,并用菌体干重和菌体核酸浓度的线性关系计算得到菌体浓度的方法[18],每隔24 h测定1次。
(3)遗传稳定性实验:将复筛后酶活力较高的菌株连续传代6代,每代都摇瓶发酵,分别测定各代菌株产的壳聚糖酶活力,验证菌株的遗传稳定性。
(4)突变菌株ZJOU-AC2在发酵培养基上的酶活曲线测定:将保存在斜面上的突变菌株ZJOU-AC2活化后转接到发酵培养基中,28 ℃,150 r/min振荡培养。每隔6 h测1次壳聚糖酶活力。以培养时间为横坐标,酶活力为纵坐标作生长曲线。
1.3.3突变菌株ZJOU-AC2发酵条件优化
将突变菌株ZJOU-AC2接种到种子培养基中,于150 r/min,28 ℃条件下振荡培养3 d。参照1.1.2中的发酵培养基,并设定初始培养条件为:发酵温度为28 ℃,初始pH值5.5,发酵时间为100 h,接种量为3%。对发酵培养的主要影响因素(发酵温度、初始pH值、发酵时间、接种量)进行单因素优化试验,测定各发酵液的壳聚糖酶活力。在250 mL的发酵培养基中,发酵温度设定为26,28,30,32,34 ℃;初始pH值设定为5.0,5.5,6.0,6.5,7.0;发酵时间分别设定为70,80,90,100,110 h;接种量分别设定为1%,2%,3%,4%,5%。在此基础上,确定各水平的最佳范围,设计正交试验方案。
1.3.4壳聚糖酶活力测定
取1 mL发酵液,4 000 r/min离心10 min,取上清液,稀释成适当倍数的壳聚糖酶液。取1 mL酶液,加入1 mL 1%的胶体壳聚糖,50 ℃下保温15 min,立即加入2 mL DNS溶液,沸水浴10 min,显色反应后放入冷水中冷却。再加入2 mL的蒸馏水,4 000 r/min离心10 min,取上清液在510 nm处测定吸光值。
1个酶活单位(U/mL):1 mL酶液每分钟产生1 μmoL还原糖所需要的酶量。
1.3.5数据统计与分析
每次实验设置3个平行组,结果取平均值。用绘图软件Origin Pro 8.5绘制折线图和柱状图,采用SPSS 22.0软件进行数据分析。
2 结果与分析
2.1 冷源等离子体诱变结果
2.1.1鹿皮曲霉诱变后致死率分析
冷源等离子体可以使气体产生高度电离的混合物,混合物的多种成分能同时对菌体起作用。据报道,在冷源等离子体中能够发生近500个反应并生成超过75种活性物质[10]。这些活性物质能迅速改变微生物细胞膜的结构与通透性,并引起基因的改变,最终导致微生物产生突变[19]。因此,适宜的条件是控制微生物迅速突变的前提。
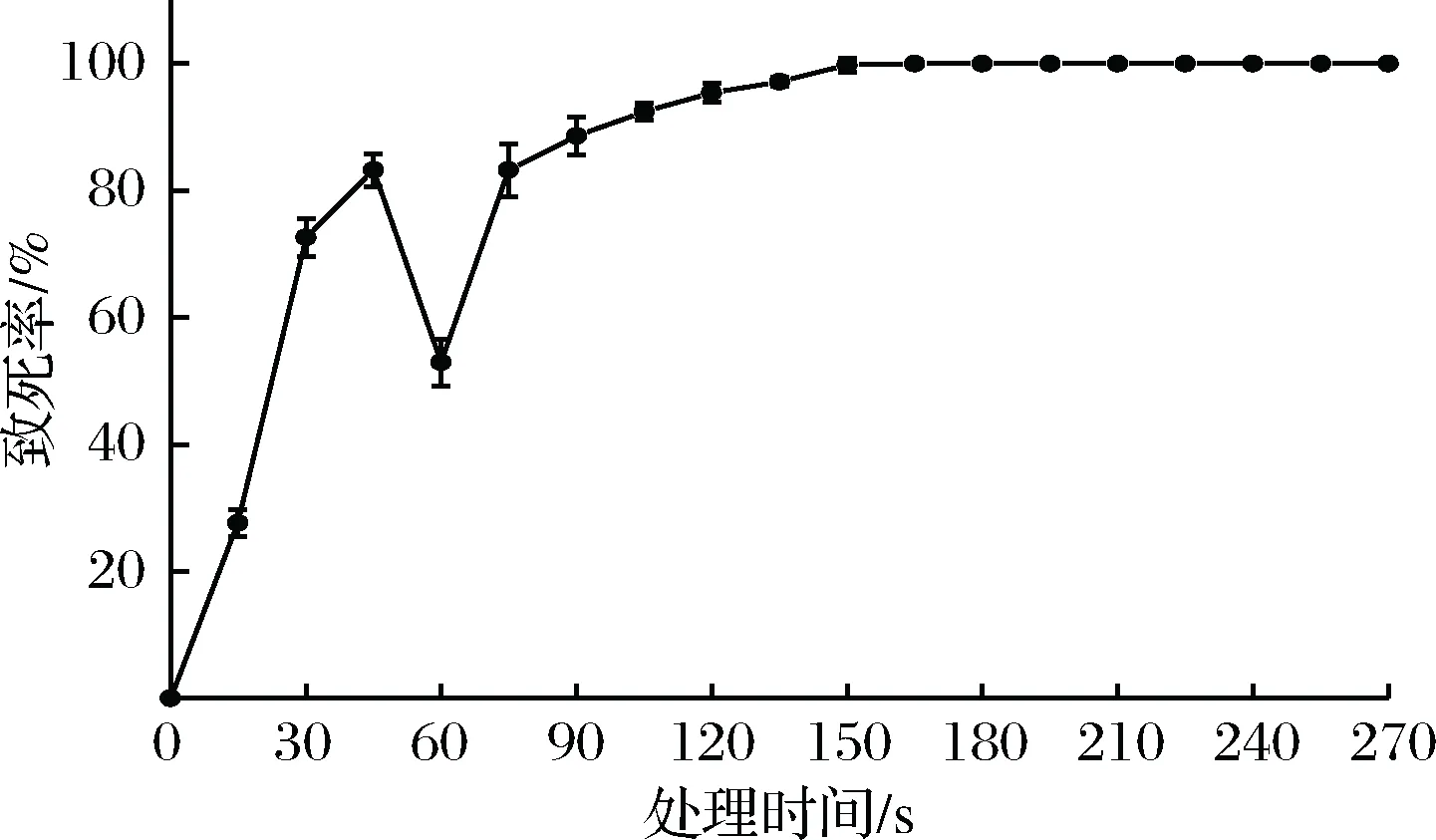
图1 不同处理时间下鹿皮曲霉的致死率曲线Fig.1 Variaton of the lethal rate of the Aspergillus cervinusZJOU-AC1 with treatment time
根据诱变理论,80%~90%的致死率有利于正突变菌株的产生[20]。如图1所示,0~150 s内冷源等离子体对鹿皮曲霉的致死率存在一定的剂量关系,致死率曲线呈现经典的马鞍型[21]。在0~45 s之间,鹿皮曲霉的致死率呈现不断上升的趋势,而到45 s时致死率则开始下降,到60 s时致死率下降到最低点,推断是因为细胞内的修复系统开始工作[22],修复了冷源等离子体诱变对细胞致死的损伤。随着诱变时间的增加,由于细胞内的修复能力不足以修复诱变带来的损伤,则致死率又开始上升。图1结果显示,当处理时间为90 s时,致死率为88.6%,处理105s以后致死率基本稳定在90%以上,处理165 s致死率接近100%。
2.1.2鹿皮曲霉诱变后突变率分析
诱变后平板上共长出183株诱变菌株,对诱变后的鹿皮曲霉进行HC值测定。根据HC值测定结果进行统计,结果表明共有68株突变菌株,其中32株为正突变菌株即HC值增加10%以上。经计算,鹿皮曲霉的突变率为37.16%,正突变率为17.49%。图2为不同诱变时间下正突变率的结果。结果显示,在90 s的时候,正突变率达到峰值4.37%,该结果与蔡聪[20,23]等人的研究相一致。为了获得高产壳聚糖酶和生存能力较强的菌株,本实验选择诱变时间为90 s的菌液平板进行后续实验。
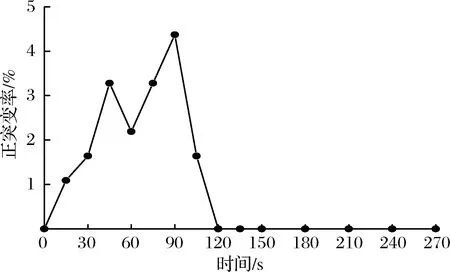
图2 诱变后的正突变率结果Fig.2 The result of positive mutation rates after mutation
2.2 突变菌株的筛选结果
2.2.1初筛和复筛结果
当诱变时间为90 s时,一共筛选出8株正突变菌株。结果由表1可知,突变菌株3#、4#、6#、7#的HC值较大且酶活力也较高。以出发菌株的酶活力作对照为100%,分别表现为菌株3#提高了52.1%,菌株4#提高了49.8%,菌株6#提高了40.4%,菌株7#提高了43.3%。因此,选取这4株突变菌株进行后续实验。
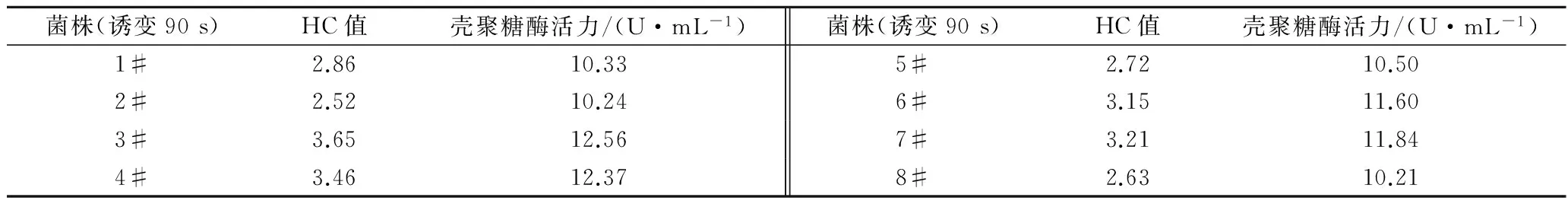
表1 冷源等离子体诱变初筛和复筛试验结果Table 1 The result of preliminary screening and secondary screening test after cold source plasma mutagenesising
2.2.2突变菌株的酶活力及生长特性分析
由图3和图4可知,经过发酵培养后,4株突变菌株的酶活力均高于ZJOU-AC1,这与突变率分析时所测定的结果一致。其中菌株3#和菌株4#的酶活力提高较为明显,菌株3#在培养4 d后的平均酶活力为12.56 U/mL,是ZJOU-AC1的1.52倍,菌株4#在培养4 d后的平均酶活力为12.37 U/mL,是ZJOU-AC1的1.5倍。从生长曲线分析,4株突变菌株的生长趋势基本一致,且生长速度均快于ZJOU-AC1。在第4天,生物量均达到最大值,此时生长最快的菌株3#的生物量是ZJOU-AC1的1.11倍,明显高于ZJOU-AC1。
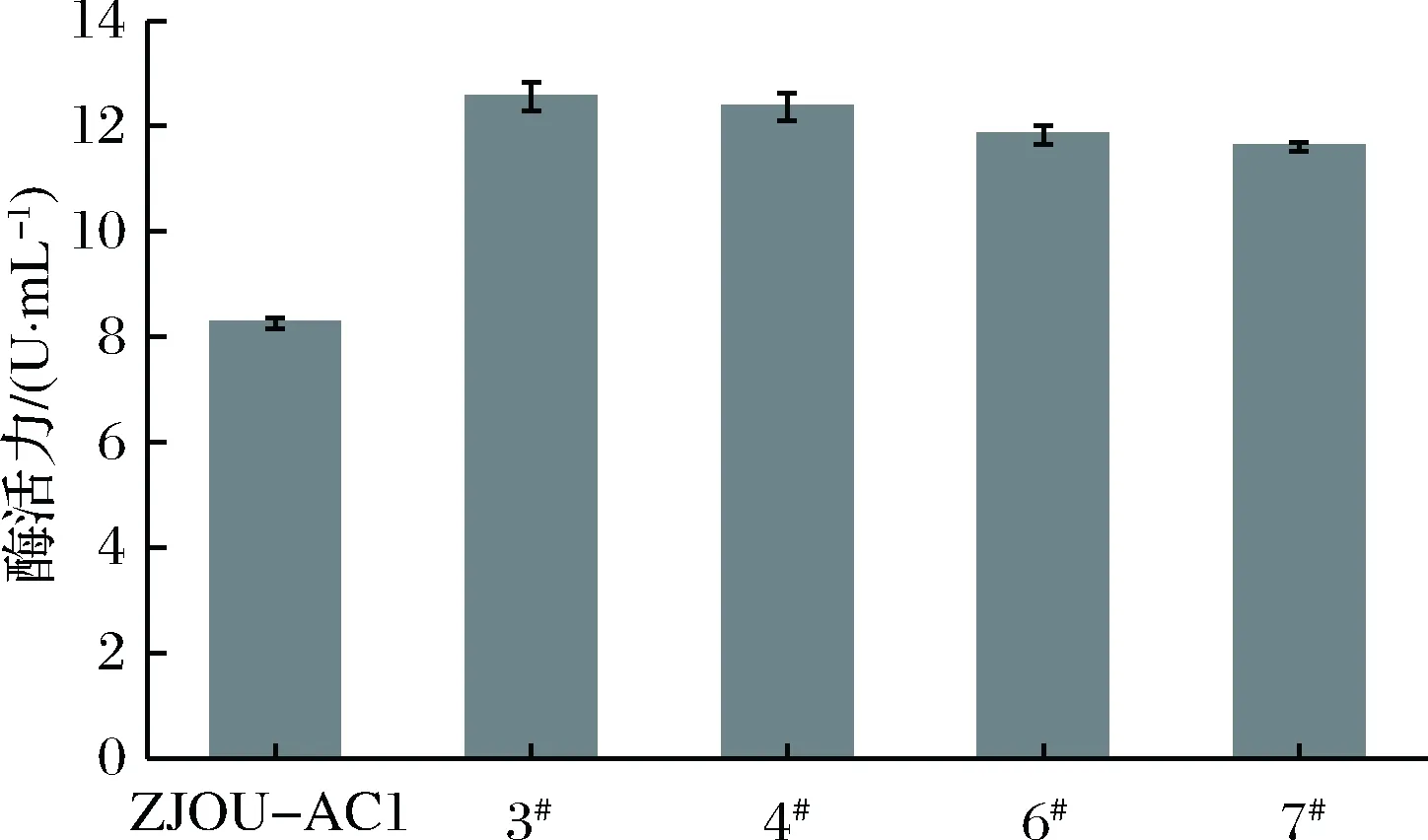
图3 突变菌株与ZJOU-AC1壳聚糖酶活力的比较Fig.3 Comparision of chitosanase activity betweenmutant strains and ZJOU-AC1
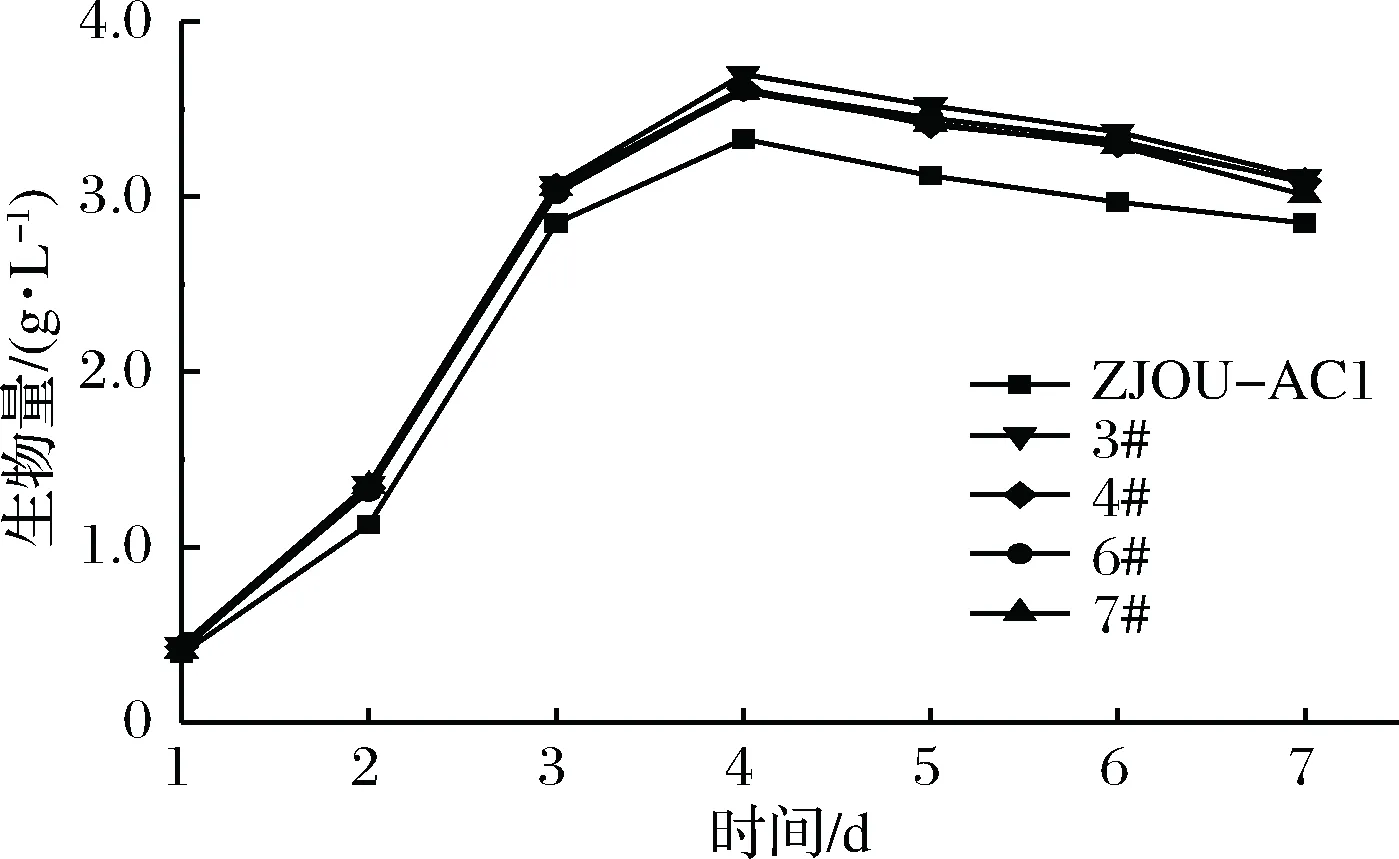
图4 突变菌株与ZJOU-AC1生长速度的比较Fig.4 Comparision of speed between mutant strainsand ZJOU-AC1
2.2.3突变菌株遗传稳定性实验
传代结果如表2所示,菌株3#、4#、6#、7#均具有良好的遗传稳定性,相较而言,菌株3#、6#的稳定性较差。其中,菌株4#在传代过程中最高酶活达到12.45 U/mL,在ZJOU-AC1的基础上提高了50.7%,菌株7#在传代中的最高酶活为11.58 U/mL,酶活性明显低于菌株4#。因此,选取菌株4#作为后续实验的实验菌株,并将其命名为AspergilluscervinusZJOU-AC2。
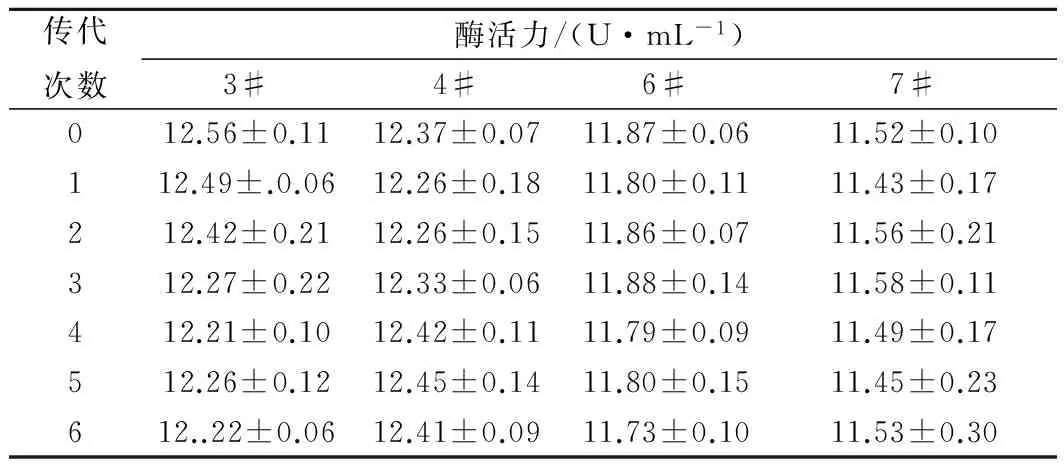
表2 突变菌株遗传稳定性实验结果Table 2 Experimental results of genetic stability ofmutant strains
2.2.4突变菌株ZJOU-AC2在发酵培养基上的产酶曲线测定
由图5可知,原始菌株ZJOU-AC1在0~96 h内壳聚糖酶活力随着时间的增加而增加,在96 h时壳聚糖酶活力达到最大值8.26 U/mL。突变菌株 ZJOU-AC2与ZJOU-AC1的产酶曲线趋势相同,在90 h时壳聚糖酶活力达到最大值12.37 U/mL。从图中的2条产酶曲线可以看出,ZJOU-AC2产壳聚糖酶活力峰值时间比ZJOU-AC1减少了6 h,且酶活力是ZJOU-AC1的1.49倍。说明冷源等离子体诱变后可以减少鹿皮曲霉的发酵时间,提高发酵效率,具有很好的实际应用性。
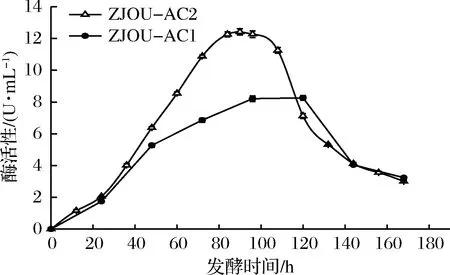
图5 发酵时间对壳聚糖酶活力的影响Fig.5 Effect of fermentation time on chitoanase activity
2.3 突变菌株ZJOU-AC2发酵条件单因素试验
2.3.1发酵温度对壳聚糖酶活力的影响
发酵温度对突变菌株ZJOU-AC2的影响结果如图6所示,随着发酵温度的提高,壳聚糖酶活力逐渐增大,在30 ℃时酶活力达到最大值12.36 U/mL,随后酶活力开始下降。由于菌体对温度较为敏感,温度过高或过低都会使其生命活动能力和酶活力下降,不利于微生物的生长代谢。
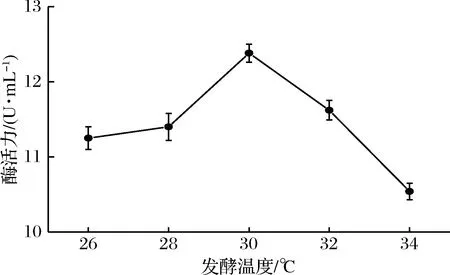
图6 发酵温度对壳聚糖酶活力的影响Fig.6 Effect of fermentation temperature on chitoanase activity
2.3.2初始pH值对壳聚糖酶活力的影响
由于发酵培养过程中菌体的生命活动,pH值一直在变化,不易控制,因此本实验只考虑初始pH值对壳聚糖酶活力的影响。结果由图7可知,壳聚糖酶活力在初始pH值5.5~6.5范围内较为理想。当发酵液的初始pH值为6.0时,酶活力最高,为12.43 U/mL。发酵过程中pH值的大小会影响菌体对壳聚糖的利用和壳聚糖酶的活力。
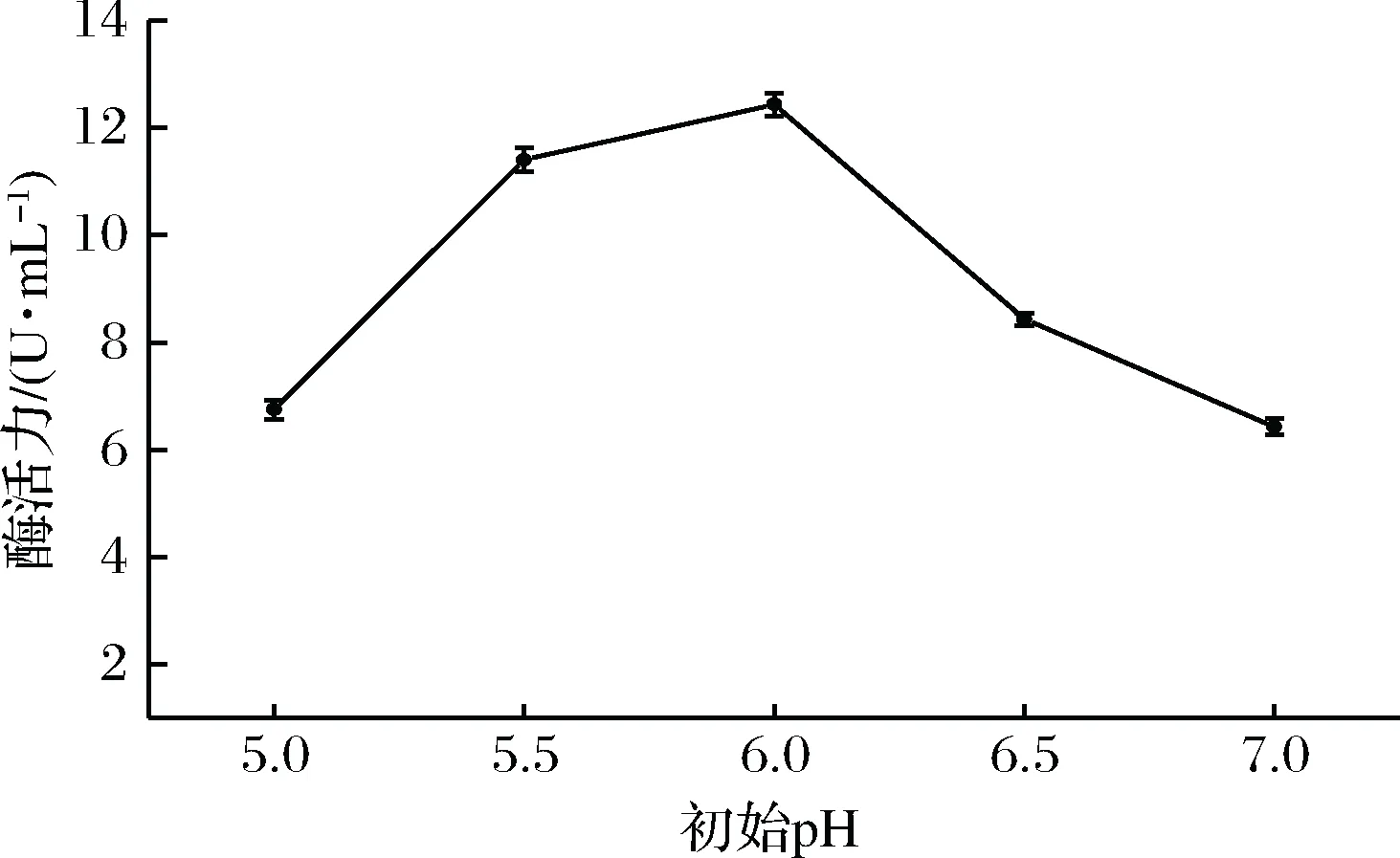
图7 初始pH值对产壳聚糖酶活力的影响Fig.7 Effect of initial pH on chitoanase activity
2.3.3发酵时间对壳聚糖酶活力的影响
图8中,发酵时间在80~100 h时,酶活力较好;在90 h时,壳聚糖酶活力达到峰值为12.45 U/mL。推测是因为在发酵初期,培养基内的营养物质充裕,菌体大量繁殖,产生大量的壳聚糖酶,后期培养基内的营养物质减少,同时菌体处于衰亡期,菌体数量开始减少,故壳聚糖酶的生产也相应减少。
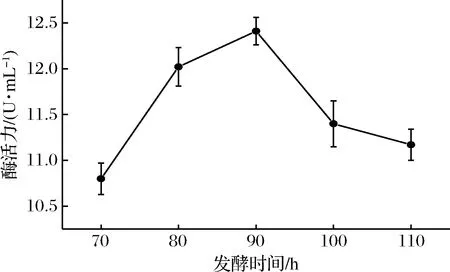
图8 发酵时间对产壳聚糖酶活力的影响Fig.8 Effect of fermentation time on chitoanase activity
2.3.4接种量对壳聚糖酶活力的影响
图9所示,接种量在2%~4%时,有利于壳聚糖酶的合成。接种量在1%~3%时,酶活力逐渐升高,在3%的接种量时酶活力最高,为11.41 U/mL。当接种量大于3%,酶活力开始下降。推测当接种量在1%~3%时,随着接种量的增加,菌体繁殖速度加快,产壳聚糖酶的能力也相应增加,当接种量大于3%后,菌体需要的能量大于培养基能提供的能量,由于营养物质匮乏导致壳聚糖酶活力下降。
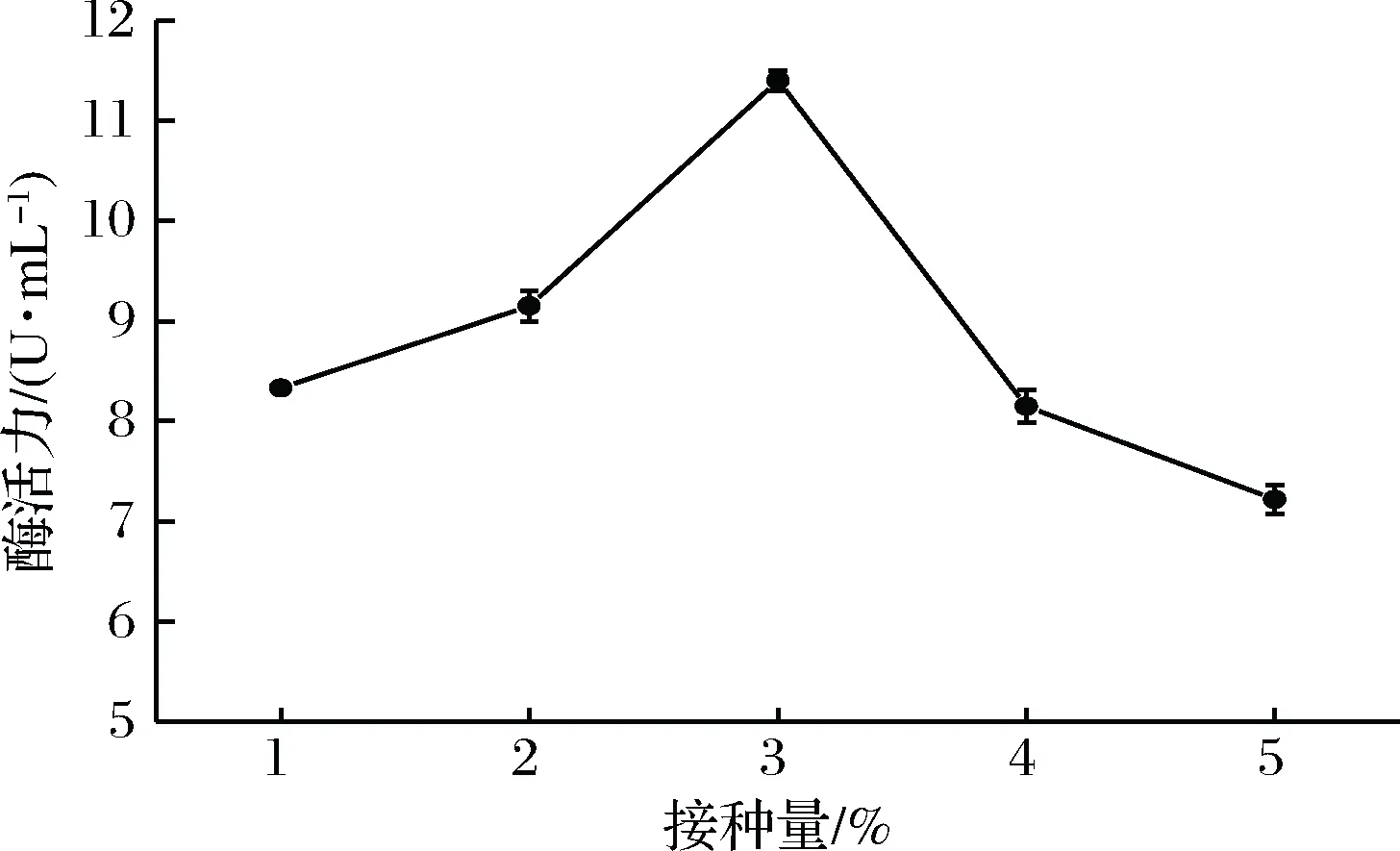
图9 接种量对产壳聚糖酶活力的影响Fig.9 Effect of inoculum on chitoanase activity
2.3.5正交试验结果
结合单因素试验的结果,以发酵温度、初始pH值、发酵时间、接种量为因素,设计四因素撒水平正交试验。结果如表3所示,极差R值大小顺序为:RB>RD>RA>RC,说明初始pH值对壳聚糖酶活力影响最大,其次是接种量、发酵温度、发酵时间。K值分析结果显示,4个因素的最优组合为A2B2C1D2,即发酵温度为30 ℃,初始pH值为6.0,发酵时间为80 h,接种量为3%。根据此组合进行发酵实验验证(设置3个平行组),得出最终酶活力为14.28±0.08 U/mL,高于正交试验中所有的组合结果,说明该组合确实为最佳发酵条件。
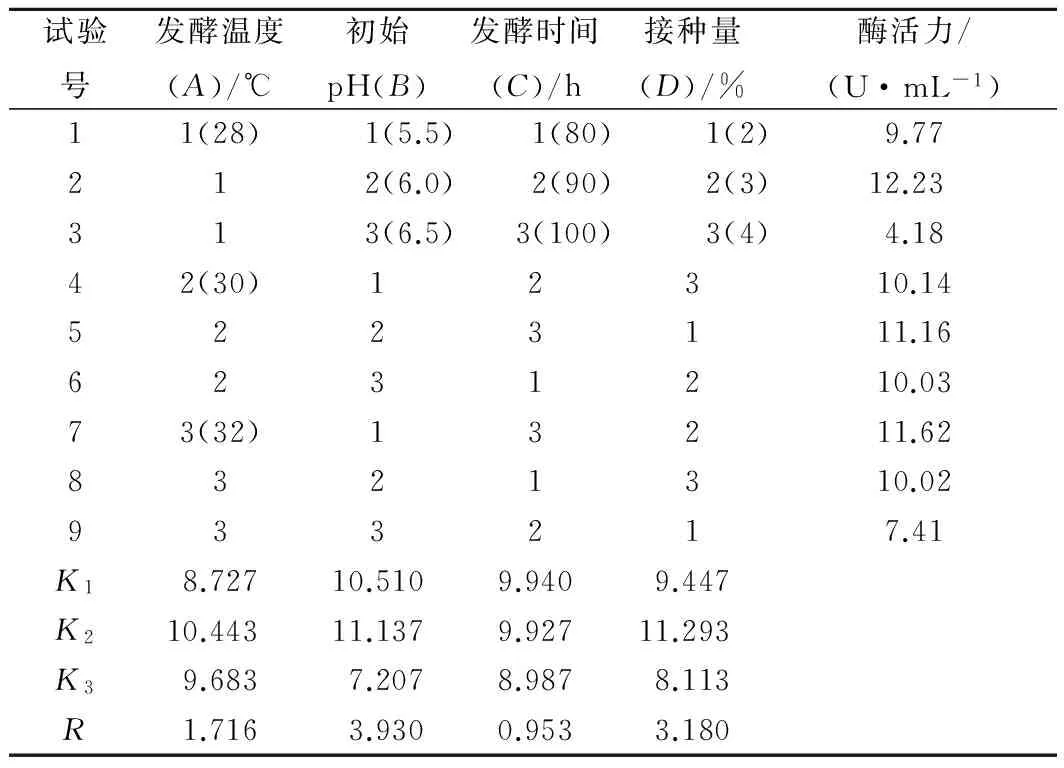
表3 L9(34)正交试验结果Table 3 The result of L9(34) orthogonal test
3 结论
(1)冷源等离子体诱变筛选高产壳聚糖酶突变菌株的参数是:电压为40 kV、辐照时间为90 s。筛选出一株酶活力提高50.7%的突变菌株,命名为鹿皮曲霉(Aspergilluscervinus)ZJOU-AC2。
(2)突变菌株鹿皮曲霉(Aspergilluscervinus)ZJOU-AC2正交试验结果表明:最佳培养条件为发酵温度30 ℃,初始pH 6.0,发酵时间为80 h,接种量为3%,比优化前提高了15.07%。
(3)本研究使用冷源等离子体诱变鹿皮曲霉筛选突变菌株,具有方法简便、诱变效率高的特点,表明此诱变方法具有很强的应用潜力。
[1]王艳君,卓少玲,陈盛. 产壳聚糖酶菌株的筛选、鉴定及酶学特性分析[J]. 微生物学通报,2012,39(12):1 734-1 745.
[2]NGUYENA D,HUANGC C,LIANGT W, et al. Production and purification of a fungal chitosanase and chitooligomers fromPenicilliumjanthinellumD4 and discovery of the enzyme activators[J]. Carbohydrate Polymers,2014,108(1):331-337.
[3]魏艳丽. 产壳聚糖酶细菌的筛选及其对绿豆和黄瓜立枯病的生物防治[D]. 开封:河南大学,2007.
[4]曾林,谭霄,张庆. 四川泡菜中产γ-氨基丁酸植物乳杆菌BC114发酵条件优化[J]. 食品与发酵工业,2017,43(3):116-121.
[5]洪丰,王志耕,梅林. 1株高产凝乳酶菌株的鉴定及N+注入诱变选育[J]. 食品与发酵工业,2013,39(3):120-124.
[6]MOREAU M,ORANGE N,FEUILLOLEY M G J. Non-thermal plasma technologies:New tools for bio-decontamination[J]. Biotechnology Advances,2008,26(6):610-617.
[7]PERNI S, SHAMA G,HOBMAN J L,et al. Probing bactericidal mechanisms induced by cold atmospheric plasmas withEscherichiacolimutants [J]. Applied Physics Letters,2007,90(7):1-3.
[8]LEDUC M,GUAY D,COULOMBE S,et al. Effects of non-thermal plasmas on DNA and mammalian cells[J]. Plasma Process and Polymers,2010,7(11):899-909.
[9]李兰松,杨利擎,刘旭光,等. 低温等离子体对镍吸附细菌B8的诱变[J]. 高校化学工程学报,2013,3(27):462-468.
[10]王佳媚,黄明明,乔维维. 冷源等离子体冷杀菌技术及其在食品中的应用研究[J]. 中国农业科技导报,2015,17(5):55-62.
[11]单秋实. 壳聚糖酶高产菌株的筛选及酶学性质的研究[D]. 吉林:吉林大学,2015.
[12]杨俐. 贵州绿僵菌产壳聚糖酶的纯化鉴定及高产菌株的诱变选育[D]. 成都:四川大学,2007.
[13]陈小娥,夏文水,余晓斌. 壳聚糖酶高产菌株的筛选及酶解产物的定性[J]. 食品与发酵工业,2004,30(2):57-61.
[14]章晔敏,邵一凡,熊妍妍,等. 响应面法优化鹿皮曲霉ZJOU-AC1产壳聚糖酶的发酵条件[J]. 中国酿造,2016,35(11):93-98.
[15]张丽萍,程辉彩,姚淑英,等. 高产植酸菌株的空气等离子体诱变选育[J]. 激光生物学报, 2005,14(3):189-192.
[16]董晓宇,滕虎,修志龙. 高产1,3-丙二醇的等离子体诱变菌株选育及发酵动力学分析[J]. 过程工程学报,2011,11(2):304-311.
[17]陈计,高鹏,陆兆新,等. β-1,3-1,4-葡聚糖酶高产菌诱变选育及基因克隆表达[J]. 食品科学,2015,36(1):179-184.
[18]陈小娥. 曲霉产壳聚糖酶酶学性质及作用机理研究[D].无锡:江南大学,2004.
[19]刘琼,郑璞. 常压室温等离子体诱变选育高产香兰素拟无枝酸菌(Amycolatopsissp.)[J]. 食品与发酵工业,2013,10(12):40-44.
[20]蔡聪,姜婷,郑兆娟,等. 等离子体诱变凝结芽孢杆菌提高木糖利用能力高产L-乳酸[J]. 食品科学,2014,35(1):125-129.
[21]DONG XY,XIU Z L,HOU Y M,et al. Enhanced production of 1,3-propanediol inKlebsiellapneumoniaeinduced by dielectric barrier discharge plasma in atmospheric air[J]. IEEE Transaction on Plasma Science,2009,37(6):920-926.
[22]CELINA J. Inducible SOS response system of DNA repair and mutagenesis inEscherichiacoli[J].International Journal of Biological Sciences,2008,4(6):338-344.
[23]FENG H ,YU Z,CHU P K. Ion implantation of organisms[J].Materials Science and Engineering,2006,54(3): 49-120.
