基于体外模拟消化的糖基化草鱼鱼鳞明胶抗氧化性研究
2018-04-12沙小梅胡姿姿涂宗财李鑫张露王辉郑婷婷
沙小梅 ,胡姿姿,涂宗财,*,李鑫,张露,王辉,郑婷婷
1(江西师范大学 功能有机小分子教育部重点实验室&生命科学学院,江西 南昌,330022)2(南昌大学 食品科学与技术国家重点实验室,江西 南昌,330047)
草鱼(Ctenopharyngodonidella),属鲤形目鲤科雅罗鱼亚科草鱼属,俗称鲩、油鲩、草鲩、白鲩、草鱼、草根(东北)、混子、黑青鱼等[1]。2015年,我国草鱼养殖年产量达到567.62万t,为四大家鱼产量之首[2]。除鲜销外,大部分草鱼被加工成鱼制品,由此产生的大量废弃物常被直接丢弃,造成环境污染和资源浪费。
鱼鳞是鱼制品加工过程中的主要废弃物之一,富含胶原蛋白,是一种良好的明胶原料[3-7]。
鱼明胶(鱼鳞明胶、鱼皮明胶等)是最具潜力的哺乳动物明胶替代物,许多类型的鱼明胶,尤其是暖水鱼鱼明胶,有着良好的凝胶强度。然而,与哺乳动物明胶相比,鱼明胶常常显示出低胶融温度。此外,包括鱼明胶在内的所有明胶物质,有着相对较低的表面活性,尤其是乳化性和乳化稳定性明显低于其他表面活性物质,例如球蛋白和阿拉伯胶[8-9]。因此,针对鱼明胶的次优功能特性,科研工作者探寻了许多技术用于鱼明胶改性,包括谷氨酰胺转氨酶[10]、糖基化反应[11]、紫外线照射[12]等。
糖基化反应是一种改善食品蛋白质功能性质的有效方式,它甚至能赋予蛋白质新的功能特性[13]。糖基化反应已被应用于明胶改性,研究表明,糖基化反应会改变明胶膜的机械性能[14-15],改善明胶的表面活性[11]。此外,亦有报道显示,蛋白链中赖氨酸和精氨酸残基的修饰可能会阻碍明胶物理网络结构的形成,进而降低其凝胶强度[16]。然而,鲜少有人报道糖基化修饰后的明胶降解成多肽后的生物活性。人体摄入的明胶会在体内经胃肠道消化形成肽,被人体吸收并产生生物学效应,因此,研究糖基化反应对明胶消化后生物活性的影响具有十分重要的意义。本文以草鱼鱼鳞明胶和葡萄糖为原料,以干热条件促使其发生糖基化反应,通过模拟体外消化实验,研究糖基化反应对明胶消化后多肽抗氧化活性(1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl, DPPH)自由基清除率,·OH 清除率以及 Fe2+螯合能力)的影响,丰富和完善明胶糖基化修饰体系,为糖基化修饰对明胶消化后肽的生物活性影响提供数据支撑。
1 材料与方法
1.1 材料与试剂
草鱼鱼鳞,于3月从南昌市天虹商场购买新鲜草鱼后收集其鱼鳞,清洗干净后于-20 ℃保存,备用。
蛋白分子质量marker,北京索莱宝科技有限公司;胃蛋白酶(酶活力为1∶3000),江苏锐阳生物科技有限公司;胰液素,美国Sigma公司;其他试剂都属于分析纯或更高的等级。
1.2 仪器与设备
Bio-Rad Mini-PROTEAN Tetra蛋白电泳仪,美国Bio-Rad公司;BioTek Synergy H1 全功能酶标仪,美国BioTek仪器有限公司;柯尼卡美能达CR-13色度仪,日本柯尼卡美能达控股公司。
1.3 方法
1.3.1鱼鳞明胶的制备
将鱼鳞置于组织捣碎机中捣碎5 min,以去除鱼鳞表面的银白色物质。接下来对鱼鳞进行脱钙处理,脱钙工艺如下:HCl浓度0.5 mol/L、料液比1∶25(g∶mL)、脱钙时间1 h。脱钙后,进一步清洗鱼鳞以去除残存的酸液,直至溶液pH值偏中性。在WANGTUEAI[5]的基础上进行适当的修改,鱼鳞明胶的制备工艺如下:湿鱼鳞和去离子水的比例为1∶5(g∶mL)、加热温度80 ℃、制备时间2 h。过滤去除鱼鳞残渣,将滤液浓缩冻干,备用。
1.3.2鱼鳞明胶-葡萄糖体系的制备
参考那治国等[17]的实验方法,并作一定修改。用磷酸盐缓冲液(50 mmol/L,pH值 7.4)配制60 mg/mL的鱼鳞明胶溶液,按明胶与糖质量比1∶1的比例加入葡萄糖,充分搅拌溶解混匀形成鱼鳞明胶-葡萄糖混合溶液,进一步将其分装成5份,冻干备用。
1.3.3鱼鳞明胶-葡萄糖体系的糖基化反应
参考那治国等[17]的实验方法,并作一定修改。将冻干的鱼鳞明胶-葡萄糖混合物置于50 ℃培养箱中进行糖基化反应,借助饱和碘化钾溶液控制相对湿度为65%,反应时间分别设置为0、3、6、9和12 h,反应结束后立即置于冰浴中终止反应。
1.3.4色泽的测定
将糖基化反应后的鱼鳞明胶分别用色度计进行检测,并记录下L*、a*、b*值。色度计采用标准白板校正。
1.3.5游离氨基含量的测定
按照MARTINEZ-ALVARENGA等[18]的方法,采用OPA法测定反应产物中自由氨基的含量。OPA试剂现配现用,准确称取80.0 mg的OPA溶解于1.0 mL甲醇中,再加入200 g/L的十二烷基硫酸钠(SDS)5 mL,0.1 mol/L的硼砂50.0 mL,β-巯基乙醇200 μL,最后用蒸馏水定容到100 mL。测定时,取4.0 mL OPA试剂于试管中,加入200 μL样品,混合均匀,放入35 ℃水浴中反应2 min后在340 nm下测吸光值A340,另取4.0 mL OPA试剂于试管中,加入200 μL水作为空白对照。用相同的方法,以赖氨酸代替样品作出标准曲线,根据标准曲线计算样品中游离氨基的含量。
1.3.6SDS-PAGE
参照BALTI等[19]的方法,经过微小修改,即浓缩胶和分离胶的浓度分别为5%和7.5%。配制鱼鳞明胶浓度为5 mg/mL的样品溶液,在95 ℃加热5 min,再经离心机以5 000 r/min离心10 min,取10 μL溶液上样。
1.3.7模拟胃肠道消化
综合HIMAYA等[20]和YOU等[21]报道的方法,再进行适当的修改用于测定鱼鳞明胶的体外消化性,即在37 ℃用胃蛋白酶酶解模拟胃部消化,再用胰液素酶解模拟肠道消化。采用1 mol/L的HCl将鱼鳞明胶浓度为20 g/L的混合物溶液pH值调至2.0,按照酶与鱼鳞明胶质量比为1∶100加入胃蛋白酶,在振荡下酶解2 h。然后,用0.9 mol/L的NaHCO3溶液将pH值调至5.3,再用1.0 mol/L的NaOH进一步将pH值调至7.5,按照酶与鱼鳞明胶质量比为1∶100加入胰液素,在振荡下酶解4 h,中止酶解反应,即将试管置于沸水浴10 min。基于 KAYASHITA等报道的方法[22],并进行适当的修改,本文鱼鳞明胶的体外模拟消化性能以体系中游离氨基数表示。
1.3.8胃肠道消化过程中鱼鳞明胶抗氧化特性的测定
1.3.8.1DPPH自由基清除活性
参考ZHENG等[23]的方法进行DPPH·清除活性的测定。配制0.1 mmol/L的DPPH·溶液(以95%的乙醇溶解DPPH)。取酶解产物样品溶液2.0 mL,加入DPPH·溶液2.0 mL,混合均匀后,在常温下避光反应30 min,高速离心机10 000 r/min,离心10 min,在517 nm波长处测吸光度(A1),空白组为2.0 mL的体积分数95%乙醇溶液代替DPPH·溶液加入2.0 mL去离子水,在517 nm波长处测定其吸光度(A2),对照组为2.0 mL去离子水代替样品与2.0 mL DPPH·溶液混合,在517 nm波长处测定其吸光度(A3),并以等体积去离子水和95%乙醇混合液空白调零。按公式(1)计算DPPH自由基清除率:
(1)
1.3.8.2·OH清除率的测定
参照ZUO等[24]的方法并略有改动,在反应体系中加入1 mL 9 mmol/L FeSO4,1 mL 9 mmol/L水杨酸-乙醇和50 μL水解液,最后加入1 mL 8.8 mmol/L H2O2启动反应,37 ℃反应30 min,以蒸馏水为参比,在510 nm下测量吸光度Aj;取50 μL蒸馏水代替水解液,做空白对照,测得吸光度为A0,以蒸馏水代替双氧水反应体系为本底测定吸收值Ai,采用下列公式计算·OH清除率:
(2)
1.3.8.3Fe2+螯合能力的测定
参考PHANAT等[25]的方法并略有改动,取0.5 mL的酶解液,加入1 mL 20 μmol/L FeCl2,混合均匀,然后加入1 mL 0.5 mmol/L菲洛嗪溶液,振荡均匀,室温下静置10 min,在562 nm波长处测定吸光度(A样品),以等体积去离子水代替样品溶液作为参照测定吸光度(A参照)。金属离子螯合率按公式(3)计算:

(3)
1.3.9数据的统计学分析
所有实验数据都是来源于3个平行样测得的结果取平均值,数据通过SPSS 17.0进行分析,选取Duncan's test用于显著性分析(p<0.05)。
2 结果与分析
2.1 鱼鳞明胶-葡萄糖体系的色泽变化
糖基化反应对鱼鳞明胶颜色的影响如表1所示。其中,L表示黑白,+表示偏白,-表示偏暗;a表示红绿,+表示偏红,-表示偏绿;b表示黄蓝,+表示偏黄,-表示偏蓝;C=(a2+b2)1/2,用于表征外观颜色的饱和度、纯度和强度;E=(L2+a2+b2)1/2,用于表示2种颜色的差异程度。

表1 糖基化反应对鱼鳞明胶颜色的影响Table 1 Effect of glycation reaction on color valuesof fish gelatin
注:a,b,c,d,e表示数据间差异显著性。
由表1可知,随着糖基化反应时间的延长,反应终产物逐渐增多,这些终产物主要以类黑素为主[26],b*值越大(p<0.05),即黄色程度越深,美拉德褐变程度越高,C值也持续增加,说明鱼鳞明胶经糖基化反应后黄褐色产物的生成并未达到饱和。本文还通过对鱼鳞明胶糖基化产物的外观颜色进行拍摄(图片未展示),结果一致。糖基化反应时间越长,鱼鳞明胶-葡萄糖体系的颜色越深。糖基化反应开始前,鱼鳞明胶-葡萄糖体系呈白色;当反应时间为12 h,鱼鳞明胶-葡萄糖体系已成为金黄色。
2.2 SDS-PAGE
鱼鳞明胶-葡萄糖体系在不同反应时间的分子质量分布如图1所示。经过糖基化(0、3、6、9、12 h)反应后的鱼鳞明胶样品有着相似的蛋白质条带,即包含特征性的α链(α1和α2),β链(由2条α链共价交联形成)和HMWP(高分子质量聚合物)。随着糖基化反应时间的延长,鱼鳞明胶的电泳条带逐渐上移,可能是因为葡萄糖分子的引入使得鱼鳞明胶的分子质量有所增加。当糖基化反应时间为12 h,鱼鳞明胶的电泳条带上移最为明显,说明此时鱼鳞明胶分子质量最大,糖基化反应程度最高。
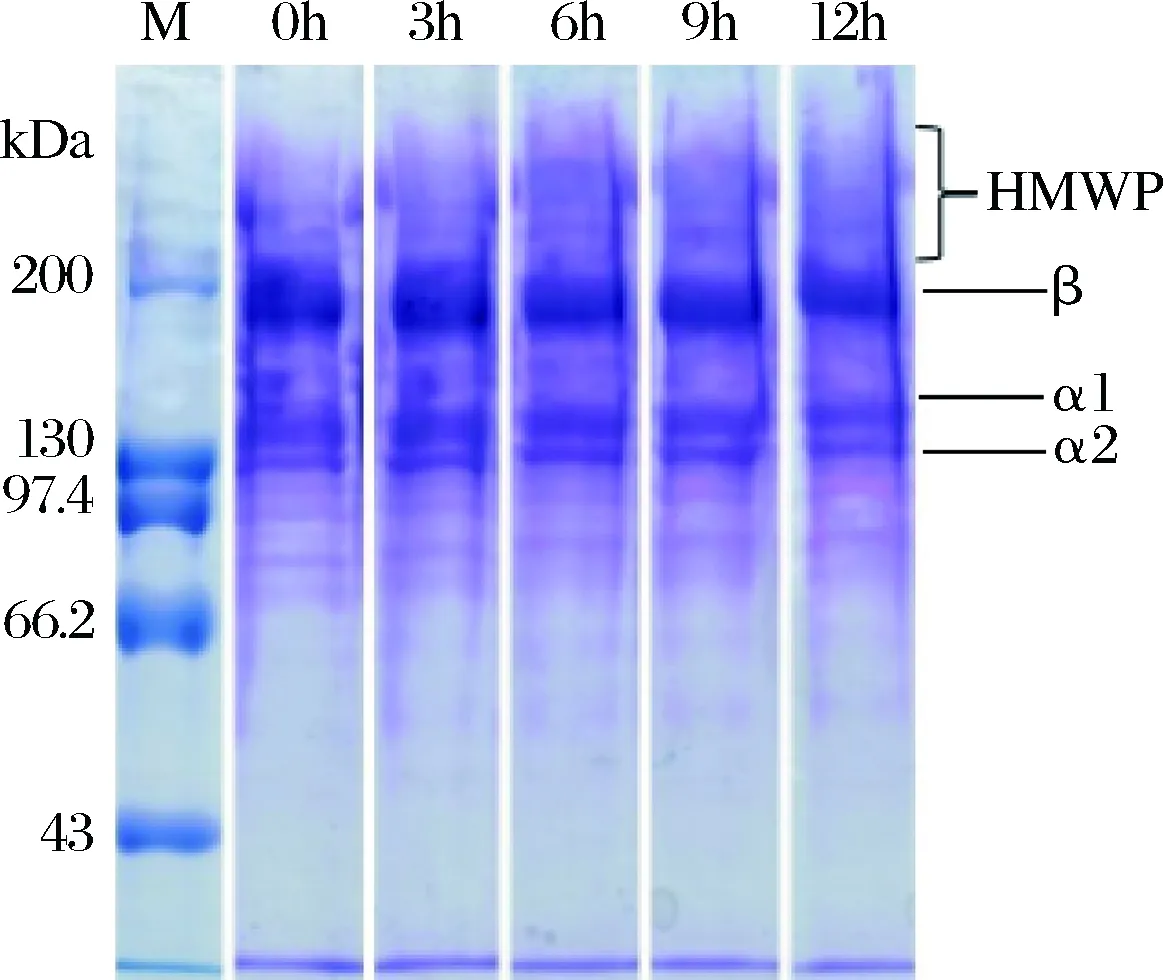
图1 糖基化反应后鱼鳞明胶的SDS-PAGE图Fig.1 SDS-PAGE profile of fish gelatin treated byglycation reaction
2.3 游离氨基含量的变化
在美拉德反应初期阶段,蛋白质中自由氨基基团(如赖氨酸和精氨酸的—NH2基团)与糖的羰基基团发生共价交联反应,使蛋白质的自由氨基含量下降[27]。自由氨基含量的减少量在一定程度上反应了糖基化反应的程度[28]。
鱼鳞明胶-葡萄糖体系在不同反应时间下的游离氨基变化情况如图2所示。游离氨基含量随着糖基化反应时间的增加而逐渐降低(p<0.05),说明糖基化反应程度逐步加大。这与李菁等[29]的研究结论一致,即随着糖基化反应时间的延长,L-赖氨酸的游离氨基含量逐渐降低。
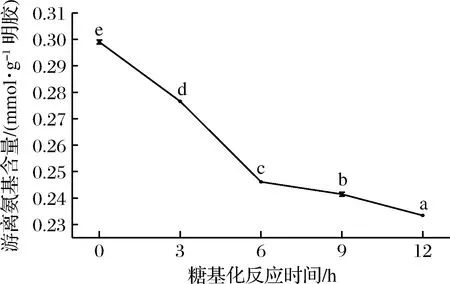
图2 糖基化反应时间对鱼鳞明胶游离氨基含量的影响Fig.2 The free amino group content of fish gelatintreated by glycation reaction
2.4 体外模拟的鱼鳞明胶胃肠道消化性
糖基化反应对鱼鳞明胶体外消化性的影响结果以游离氨基数目表征,游离氨基数目增多则表示鱼鳞明胶消化性增强[22]。
图3-A为糖基化反应对鱼鳞明胶胃部消化性能的影响,糖基化反应诱导鱼鳞明胶的天然结构发生一定改变,且过度的糖基化反应使得高级产物生成量增加,进而降低鱼鳞明胶-葡萄糖体系的溶解性,同时糖基化反应掩盖了部分消化位点,因此,在模拟人体胃部消化过程中,糖基化反应能够显著地降低鱼鳞明胶-葡萄糖美拉德反应产物的消化性(p<0.05)。糖基化对鱼鳞明胶模拟人体整个胃肠道消化性的影响如图3-B所示。在模拟人体整个胃肠道消化过程中,鱼鳞明胶-葡萄糖美拉德反应产物的消化性均比未糖基化的鱼鳞明胶低。可能是因为胰蛋白酶能特异性水解赖氨酸和精氨酸残基的羧基端肽键,然而糖基化反应使得鱼鳞明胶的赖氨酸和精氨酸残基被修饰而无法被胰蛋白酶识别,因此降低其在胃肠道的消化性。

A-胃消化后游离氨基含量;B-整个胃肠道消化后游离氨基含量图3 糖基化反应后鱼鳞明胶的体外模拟消化Fig.3 In vitro digestibility of fish gelatin treated byglycation reaction
2.5 胃肠道消化过程中的抗氧化特性
2.5.1DPPH·清除活性
由图4可知,在糖基化反应9 h之前,鱼鳞明胶-葡萄糖美拉德反应产物在胃部模拟消化和人体整个胃肠道模拟消化过程中,对DPPH·的清除能力均呈现先增强后下降的趋势(p<0.05)。在糖基化反应9 h时,DPPH·的清除能力达到最大,即在糖基化反应的前9 h内,具有抗氧化活性的物质大量合成,9 h后逐渐下降(p>0.05)。随着糖基化反应时间的延长,糖基化产物中的疏水性基团暴露,消化液的疏水性增强,使其易于与脂溶性的DPPH·反应[30],从而DPPH·清除率得以提高,在糖基化反应9 h时达到最大。糖基化反应9 h后,DPPH·清除率降低可能是因为糖基化反应产物的结构变得紧凑[31],一些疏水基团被包埋,减少了与脂溶性的DPPH·的反应。总体表明,糖基化修饰的鱼鳞明胶模拟消化后得到的多肽呈现出较好的DPPH·清除能力。

A-胃消化后DPPH·清除能力;B-整个胃肠道消化后DPPH·清除能力图4 鱼鳞明胶经体外模拟消化后的DPPH·清除能力Fig.4 DPPH radical clearance rate of fish gelatin treatedin vitro digestibility
2.5.2·OH清除率的测定
由图5可知,在鱼鳞明胶糖基化反应后模拟胃部消化过程中,糖基化反应9 h前,清除·OH的能力逐渐上升(p<0.05),糖基化反应9 h之后,清除·OH的能力开始下降(p<0.05)。可能是因为随着糖基化反应时间的延长,作为氢供体的糖基化反应产物不断增多[32],使得·OH清除能力增大。糖基化反应产物的·OH清除率降低可能是因为在糖基化反应后期阶段生成的终产物中可作为氢供体的反应产物含量降低。在模拟人体整个胃肠道消化过程中,糖基化反应3 h前,清除·OH的能力下降幅度较快(p<0.05),糖基化反应3~6 h这一时间段内,清除·OH的能力逐渐上升(p<0.05),在糖基化反应6~9 h内,清除·OH的能力上升缓慢(p>0.05),在糖基化反应9 h之后,清除·OH的能力又开始下降(p<0.05),可能是因为糖基化反应使得鱼鳞明胶的赖氨酸和精氨酸残基被修饰而无法被胰蛋白酶识别,使得氢供体含量减少,·OH清除能力降低。总的来说,糖基化反应能提高鱼鳞明胶在胃部的·OH的清除能力,但在模拟人体整个胃肠道消化过程中,糖基化反应会降低鱼鳞明胶·OH的清除能力。
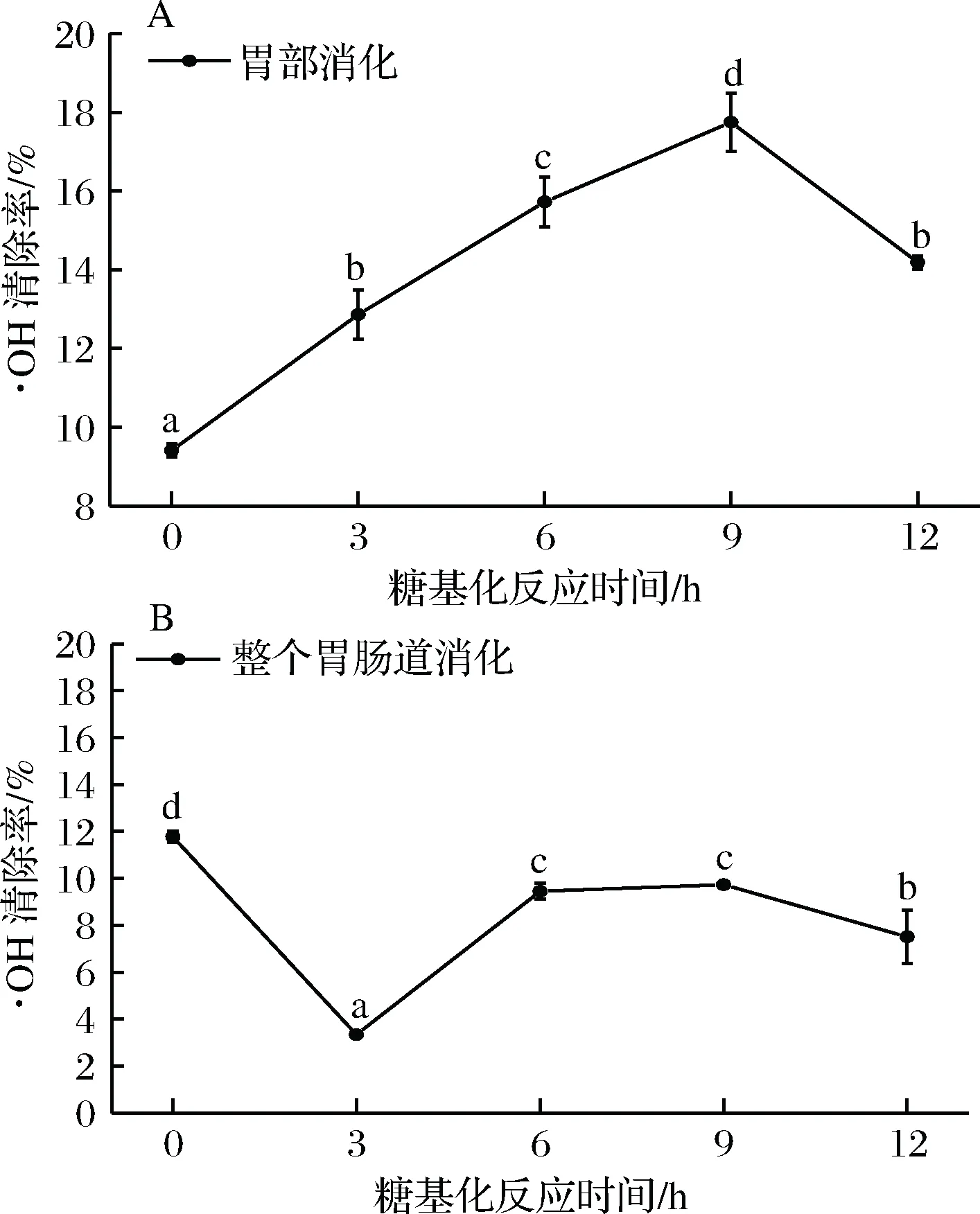
A-胃消化后·OH清除能力;B-整个胃肠道消化后·OH清除能力图5 鱼鳞明胶的体外模拟消化对·OH的清除能力Fig.5 ·OH clearance rate of fish gelatin treate in vitro digestibility
2.5.3Fe2+螯合能力的测定
由图6可知,在模拟胃部消化过程中,鱼鳞明胶糖基化反应3 h前,螯合Fe2+的能力变化不显著(p>0.05),在糖基化反应3 h至9 h这一时间段内,螯合Fe2+的能力下降幅度增大(p<0.05),糖基化反应9 h时,螯合Fe2+的能力最小,糖基化反应9 h之后迅速上升(p<0.05),但糖基化9 h后的Fe2+螯合能力仍低于未糖基化的鱼鳞明胶。这一结果说明在胃部,糖基化反应能降低Fe2+螯合能力。可能是因为随着糖基化反应时间的延长,鱼鳞明胶-葡萄糖美拉德反应产物的消化率降低,导致消化水解生成的水溶性物质减少所致[33]。在模拟人体整个胃肠道消化过程中,螯合Fe2+的能力不随糖基化反应时间的推移而发生明显变化(p>0.05),但与胃部消化相比,胰蛋白酶酶解后Fe2+螯合能力得到显著提高(p<0.05)。胰蛋白酶酶解有助于提高酶解产物的Fe2+螯合能力,其螯合率达到76%左右(p<0.05)。在糖基化反应6、9、12 h时,胃蛋白酶酶解过程中酶解产物对Fe2+的螯合能力下降,但是经胰蛋白酶酶解又迅速回升。胰蛋白酶酶解产物螯合能力的提高可能是因为胰蛋白酶将鱼鳞明胶酶解成活性肽或者肽段,同时亲核性的离子结合基团完全暴露[21]。

A-胃消化后Fe2+螯合能力;B-整个胃肠道消化后Fe2+螯合能力图6 鱼鳞明胶的体外模拟消化后螯合Fe2+的能力Fig.6 Fe2+-chelating capacity offish gelatin treatedin vitro digestibility
3 结论
本文通过体外模拟消化实验,明确糖基化反应对鱼鳞明胶在胃肠道抗氧化活性的影响。随着糖基化反应时间的延长,鱼鳞明胶-葡萄糖体系的颜色由白色逐渐变成金黄色,且游离氨基含量也逐渐减少,在糖基化反应12 h时,鱼鳞明胶分子量增大,表明糖基化反应程度逐渐增加。在胃部模拟消化过程中,随着糖基化反应时间的延长,DPPH·、·OH的清除能力先增强后降低,而Fe2+螯合能力先降低后增加。在胃肠道消化过程中,DPPH·清除能力不断增大至稳定,糖基化产物的·OH清除能力均小于未糖基化的鱼鳞明胶,而Fe2+螯合能力未发生发生明显变化。总体而言,糖基化反应会降低鱼鳞明胶在胃肠道的消化特性,并影响其消化产物的抗氧化性。
作为一种常用的蛋白质改性方法,糖基化反应会改变鱼鳞明胶在胃肠道消化过程中的抗氧化活性,但影响效果因抗氧化性评价方式不同而有所不同。然而,糖基化反应后鱼明胶抗氧化活性与其结构(包括糖基化位点情况)的关系还有待深入研究,以揭示鱼明胶抗氧化活性变化的内在原因。
[1]WANG Ling-zhao, YANG Bao, WANG Rui, et al. Extraction of pepsin-soluble collagen from grass carp (Ctenopharyngodonidella) skin using an artificial neural network[J]. Food Chemistry, 2008,111(3):683-686.
[2]农业部渔业局编制. 中国渔业统计年鉴. 2016[M]. 北京:中国农业出版社, 2016.
[3]MATMAROH K, BENJAKUL S, PRODPRAN T, et al. Characteristics of acid soluble collagen and pepsin soluble collagen from scale of spotted golden goatfish (Parupeneusheptacanthus)[J]. Food Chemistry, 2011,129(3):1 179-1 186.
[4]ZHANG Feng-xiang, XU Shi-ying, WANG Zhang. Pre-treatment optimization and properties of gelatin from freshwater fish scales[J]. Foodand Bioproducts Processing, 2011,89(3):185-193.
[5]WANGTUEAI S, NOOMHORM A. Processing optimization and characterization of gelatin from lizardfish (Sauridaspp.) scales[J]. LWT-Food Scienceand Technology, 2009,42(4):825-834.
[6]TU Zong-cai, HUANG T, WANG H, et al. Physico-chemical properties of gelatin from bighead carp (Hypophthalmichthysnobilis) scales by ultrasound-assisted extraction[J]. Journal of Food Scienceand Technology-Mysore, 2015,52(4):2 166-2 174.
[7]SHA Xiao-mei, TU Zong-cai, LIU Wei, et al. Effect of ammonium sulfate fractional precipitation on gel strength and characteristics of gelatin from bighead carp (Hypophthalmichthysnobilis) scale[J]. Food Hydrocolloids, 2014,36:173-180.
[8]KARIM A A, BHAT R. Gelatin alternatives for the food industry: recent developments, challenges and prospects[J]. Trendsin Food Science& Technology, 2008,19(12):644-656.
[9]KARIM A A, BHAT R. Fish gelatin: properties, challenges, and prospects as an alternative to mammalian gelatins[J]. Food Hydrocolloids, 2009,23(3):563-576.
[10]MOHTAR N F, PERERA C O, QUEK S, et al. Optimization of gelatine gel preparation from New Zealand hoki (Macruronusnovaezelandiae) skins and the effect of transglutaminase enzyme on the gel properties[J]. Food Hydrocolloids, 2013,31(2):204-209.
[11]LIN L H, CHEN Keng-Ming, LIU H J, et al. Preparation and surface activities of modified gelatin-glucose conjugates[J]. Colloidsand Surfaces A: Physicochemicaland Engineering Aspects, 2012,408:97-103.
[12]BHAT R, KARIM A A. Ultraviolet irradiation improves gel strength of fish gelatin[J]. Food Chemistry, 2009,113(4):1 160-1 164.
[13]LIU Jian-hua, RU Qiao-mei, DING Yu-ting. Glycation a promising method for food protein modification: Physicochemical properties and structure, a review[J]. Food Research International, 2012,49(1):170-183.
[14]SAMIRA S, THUANCHEW TAN T C, AZHAR M E. Effect of ribose-induced Maillard reaction on physical and mechanical properties of bovine gelatin films prepared by oven drying.[J]. International Food Research Journal, 2014, 21(1): 269-276.
[15]ETXABIDE A, URANGA J, GUERRERO P, et al. Improvement of barrier properties of fish gelatin films promoted by gelatin glycation with lactose at high temperatures[J]. LWT-Food Scienceand Technology, 2015,63(1):315-321.
[16]SPANNEBERG R, SCHYMANSKI D, STECHMANN H, et al. Glyoxal modification of gelatin leads to change in properties of solutions and resulting films[J]. Soft Matter, 2012,8(7):2 222-2 229.
[17]那治国,马永强,韩春然,等. 米糠谷蛋白干法糖基化改性的研究[J]. 食品科学,2013, 34(2):52-57.
[18]MARTINEZ-ALVARENGA M S, MARTINEZ-RODRIGUEZ E Y, GARCIA-AMEZQUITA L E, et al. Effect of Maillard reaction conditions on the degree of glycation and functional properties of whey protein isolate-Maltodextrin conjugates[J]. Food Hydrocolloids, 2014,38:110-118.
[19]BALTI R, JRIDI M, SILA A, et al. Extraction and functional properties of gelatin from the skin of cuttlefish (Sepia officinalis) using smooth hound crude acid protease-aided process[J]. Food Hydrocolloids, 2011,25(5):943-950.
[20]HIMAYA S W A, NGO D, RYU B, et al. An active peptide purified from gastrointestinal enzyme hydrolysate of Pacific cod skin gelatin attenuates angiotensin-1 converting enzyme (ACE) activity and cellular oxidative stress[J]. Food Chemistry, 2012,132(4):1 872-1 882.
[21]YOU Li-jun, ZHAO Mou-ming, REGENSTEIN J M, et al. Changes in the antioxidant activity of loach (Misgurnus anguillicaudatus) protein hydrolysates during a simulated gastrointestinal digestion[J]. Food Chemistry, 2010,120(3):810-816.
[22]KAYASHITA J, SHIMAOKA I, NAKAJOH M, et al. Consumption of buckwheat protein lowers plasma cholesterol and raises fecal neutral sterols in cholesterol-Fed rats because of its low digestibility.[J]. The Journal of nutrition, 1997,127(7):1 395-1 400.
[23]ZHENG Lin, REN Jiao-yan, SU Guo-wan, et al. Comparison of in vitro digestion characteristics and antioxidant activity of hot-and cold-pressed peanut meals[J]. Food Chemistry, 2013,141(4):4 246-4 252.
[24]ZUO Li-li, WANG Zhen-yu, FAN Zi-luan, et al. Evaluation of antioxidant and antiproliferative properties of three actinidia (Actinidiakolomikta,Actinidiaarguta,Actinidiachinensis) extractsinvitro[J]. International Journalof Molecular Sciences, 2012,13(5):5 506-5 518.
[25]KITTIPHATTANABAWON P, BENJAKUL S, VISESSANGUAN W, et al. Effect of extraction temperature on functional properties and antioxidative activities of gelatin from shark skin[J]. Foodand Bioprocess Technology, 2012,5(7):2 646-2 654.
[26]毕伟伟. 微波对酪蛋白的糖基化反应及产物功能性质的研究[D]. 哈尔滨:东北农业大学, 2015.
[27]JING H, KITTS D D. Chemical and biochemical properties of casein-sugar Maillard reaction products[J].Food and Chemical Toxicology,2002, 40(7): 1 007-1 015.
[28]TSUBOKURA Y, FUKUZAKI S, NOMA S, et al. Glycation of ovalbumin in solid-state by conductive and microwave heating[J]. Food Scienceand Technology Research, 2009,15(4):377-380.
[29]李菁, 刘骞, 孔保华, 等.L-赖氨酸与3种还原糖美拉德反应产物的理化特性及抗氧化活性[J]. 食品科学, 2013,34(3):80-85.
[30]ZHU Li-juan, CHEN Jie, TANG Xue-yan, et al. Reducing, radical scavenging, and chelation properties ofinvitrodigests of alcalase-treated zein hydrolysates[J]. Journal of Agricultural & Food Chemistry, 2008, 56(8):2 714-2 721.
[31]黄小琴. 基于质谱技术的蛋白质组学方法对食品蛋白质糖基化的研究[D]. 南昌: 南昌大学, 2013.
[32]杨健, 李芳菲, 武淑影,等. 大豆蛋白美拉德反应产物的抗氧化特性及其机理[J]. 中国食品学报, 2017, 17(2):44-51.
[33]涂宗财, 李瑞平, 王辉,等. 微波预处理对草鱼鱼肉蛋白消化及其产物抗氧化活性的影响[J]. 食品科学, 2015, 36(7):56-60.
