长链非编码RNA linc-01135对静态牵张力作用下人炎症牙周膜干细胞成骨分化的影响
2018-04-12邹宛桦秦文徐悦蓉秦再秀刘佳金作林
邹宛桦 秦文 徐悦蓉 秦再秀 刘佳 金作林
牙周膜干细胞(periodontal ligament stem cells,PDLSCs)是牙周组织再生领域最重要的种子细胞之一[1-2],其对力有高度敏感性,适宜的机械刺激可促进其增殖、成骨等生物学功能[3]。本课题组前期研究发现[4],牙周病的炎症微环境会影响PDLSCs对力学刺激的应答反应:12%的静态牵张力(SMS)是促进健康来源PDLSCs(H-PDLSCs)成骨分化的最佳力值,但炎症来源的PDLSCs(P-PDLSCs)对该力值的耐受性下降,表现为促成骨作用的显著降低,其相关机制尚未见报道。
长链非编码RNA(long non-coding RNA,lncRNA)是一类转录本长度大于200 nt的非编码RNA,其通过对基因表达的调控影响机体生长、发育等重要生命活动以及炎症、肿瘤等疾病的发展和转归[5-6]。linc-01135是一条定位于Chr1:58785151-58899712,长度为994 nt的基因间lncRNA。我们前期的lncRNA基因芯片检测结果显示,linc-01135在P-PDLSCs中的表达较H-PDLSCs明显下调。本研究将进一步验证linc-01135在HPDLSCs和P-PDLSCs中的表达情况,并探讨其对12%SMS作用下P-PDLSCs成骨分化能力的影响。
1 材料与方法
1.1 主要试剂和仪器
α-MEM培养基、1 000 U/ml青霉素、1 000 U/ml链霉素(Gibco,美国);胰蛋白酶、β-甘油磷酸钠、地塞米松、抗坏血酸(Sigma,美国);胎牛血清(四季青,浙江天杭生物科技公司);慢病毒(上海吉凯基因);茜素红、Trizol Regent(Life Technologies,美国);PrimeScriptTMRT-PCR kit逆转录试剂盒、Syber Green荧光定量PCR试剂盒(Takara,日本);Bioflex 6孔板、FX-4000T Tension Plus System(Flexcell,美国);Real-Time PCR仪(Biosytems 7500,美国)。
1.2 方法
1.2.1 H-PDLSCs和 P-PDLSCs的分离、培养及鉴定
1.2.1.1 H-PDLSCs和 P-PDLSCs的分离、培养 收集因正畸治疗需要拔除的健康牙齿及牙周炎的牙齿,PBS冲洗至牙根洁净,刮取根中1/3的牙周膜组织,加入3 mg/ml I型胶原酶,37℃消化1 h。等体积含10% 胎牛血清(FBS)的 α-MEM终止消化,800 r/min,离心5 min,弃上清液。加入α-MEM培养基(含10%FBS、100 U/ml青霉素,100 U/ml链霉素)后接种于6孔板,置于恒温37℃、5%CO2孵箱中培养。待细胞汇合达80%时采用低密度培养法筛选纯化细胞。
1.2.1.2 H-PDLSCs和 P-PDLSCs间充质干细胞表面标记物检测 取第3代细胞,以5×105个/200μl密度转移至1.5 ml EP管中,PBS冲洗2次,分别加入2μl鼠抗人CD29、CD105、CD45、CD34抗体,4℃避光孵育1 h,PBS冲洗3次,流式细胞仪检测细胞表面标志物的表达情况。
1.2.2 静态牵张力加载系统的构建 取第3代细胞,以3×105个/孔密度接种于Bioflex 6孔板,同步化处理后置于FX-4000T牵张力加载系统上SMS加载(力值 12%,频率0.1 Hz,12 h)。
1.2.3 慢病毒转染 取第3代P-PDLSCs,接种密度为4×104个/ml。根据慢病毒转染说明书进行转染,转染后72 h荧光显微镜下观察转染情况,待转染后细胞汇合达80%进行12%SMS加载。
1.2.4 RT-PCR 收样后用 Trizol一步法抽提总RNA,RNA质检合格后采用PrimeScriptTMRT-PCR kit试剂盒逆转录合成cDNA,以actin为内参检测相关基因表达水平。
1.2.5 成骨分化能力检测 将需成骨诱导的样品培养基更换为成骨诱导液(含10%FBS的α-MEM,地塞米松10 mol/L,维生素 C 50μg/ml,β-磷酸甘油 10 mmol/L),培养21 d后进行茜素红染色,60%异丙醇室温固定5 min,ddH2O水化处理细胞2 min,染色1 min,ddH2O冲洗2次,大体及镜下观察矿化结节形成情况并进行定量分析。
1.3 统计学分析
用SPSS 16.0统计软件对数据进行统计分析,2组间比较用两独立样本t检验,各组间比较采用Oneway ANOVA检验,结果以±s表示,检验水准α=0.05。
2 结 果
2.1 H-PDLSCs和P-PDLSCs表面标记物鉴定
流式细胞仪检测结果显示,H-PDLSCs和 PPDLSCs均强阳性表达间充质干细胞表面标记物CD29,CD105,阴性表达造血系统来源细胞表面标记物CD45,CD34,表明所分离培养的细胞为间充质来源干细胞(图 1)。
2.2 12%SMS对 H-PDLSCs和 P-PDLSCs成骨分化能力的影响
RT-PCR结果显示,H-PDLSCs在12%SMS加载后成骨基因RUNX2、ALP的表达上升,差异具有统计学意义(P<0.01),P-PDLSCs中成骨基因的表达上升不明显(图2A)。茜素红染色所示趋势与PCR结果一致(图 2B、2C)。
2.3 linc-01135在 H-PDLSCs和P-PDLSCs中表达情况的影响及其与成骨基因RUNX2表达量相关性
RT-PCR检测结果显示P-PDLSCs中 linc-01135的表达量较 H-PDSLCs下降约 2.32倍(0.431±0.078,P<0.05)(图 3A)。成骨诱导 1、3、7、14 d中linc-01135表达量与成骨基因RUNX2表达量呈相关关系(图3B)。
2.4 P-PDLSCs慢病毒转染效率检测
荧光视野下观察P-PDLSCs已成功转染慢病毒(图4A、4B)。RT-PCR结果显示P-PDLSCs转染linc-01135慢病毒后,表达量上调约3.87倍(3.869 46±0.258 12,P<0.001),转染 linc-01135-RNAi慢病毒后,表达量降低约2.74倍(0.364 51±0.084 78,P<0.01),表明转染有效(图 4C)。
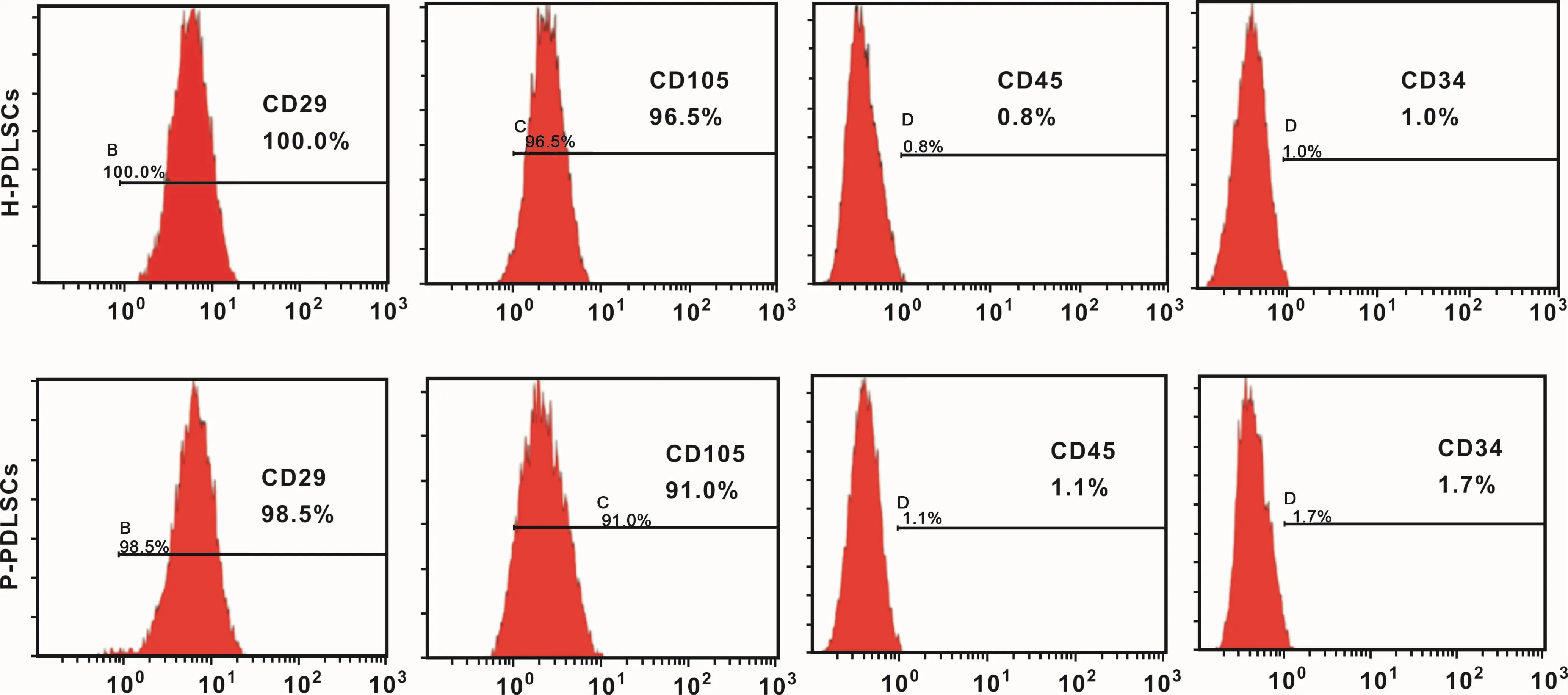
图1 流式细胞仪检测H-PDLSCs和P-PDLSCs表面标记物表达情况Fig 1 Mesenchymal stem cell phenotype examination by flow cytometric analysis
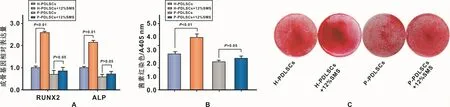
图2 12%SMS对H-PDLSCs和P-PDLSCs成骨分化能力的影响Fig 2 The evaluation of osteogenesis differentiation capability of H-PDLSCs and P-PDLSCs after 12%SMS loading
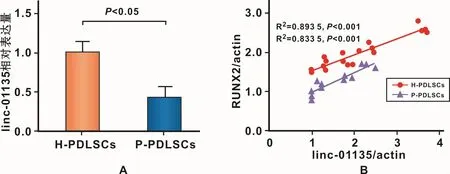
图3 linc-01135在H-PDLSCs和P-PDLSCs中表达情况与成骨基因RUNX2相关性分析Fig 3 The expression level of linc-01135 and the correlation with RUNX2 in H-PDLSCs and P-PDLSCs
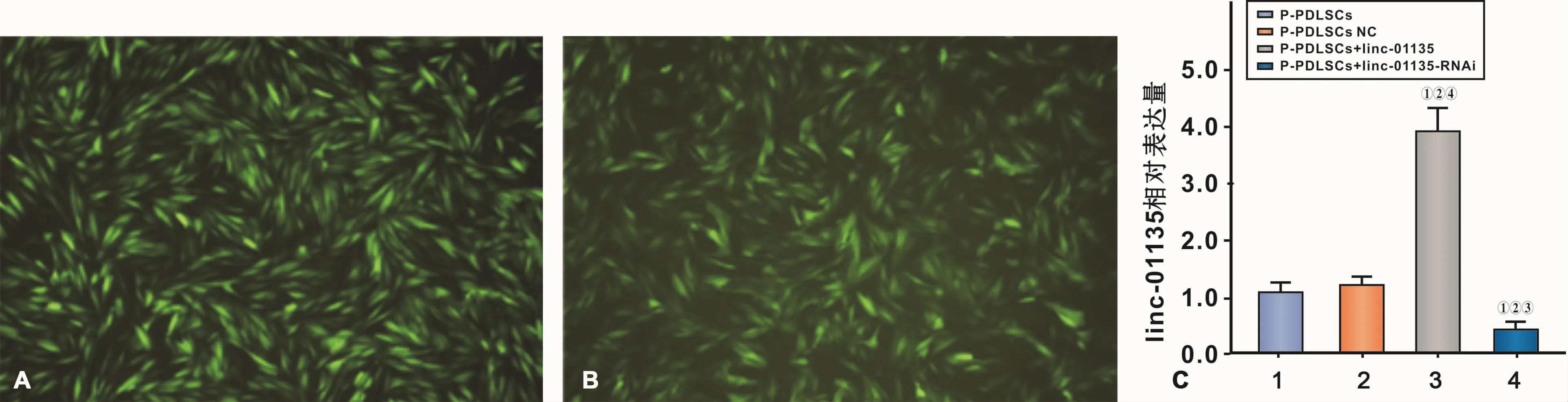
图4 转染效率检测Fig 4 Transfection efficiency examination
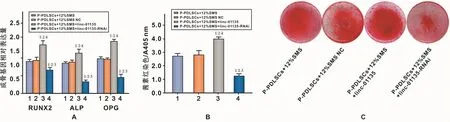
图5 上调及下调linc-01135表达对P-PDLSCs在12%SMS作用下成骨分化能力的影响Fig 5 The evaluation of osteogenesis differentiation capability of P-PDLSCs after 12%SMS loading with up-regulation and down-regulation of linc-01135
2.5 上调及下调 linc-01135表达对 P-PDLSCs在12%SMS作用下成骨分化能力的影响
RT-PCR结果显示,上调linc-01135的表达后进行12%SMS加载,RUNX2、ALP、OPG的表达较对照组明显上升;下调linc-01135的表达后进行12%SMS加载,RUNX2、ALP、OPG的表达较对照组下降,差异均有统计学差异(P<0.001)(图5A)。茜素红染色所示趋势与PCR结果一致(图5B、5C)。
3 讨 论
牙周膜干细胞是牙周组织中的间充质干细胞,其对牙周组织的功能维持和修复再生有重要作用[1]。在炎症微环境中,大量炎性因子的产生会降低PDLSCs的增殖和迁移能力,并影响其对机械刺激的应答反应[7-8]。目前,表观遗传学是干细胞生物学功能研究领域的热点[9-10]。作为表观遗传的重要调控分子,lncRNA对干细胞分化的调控作用正逐渐受到关注,但目前仅有少数的lncRNA在PDLSCs成骨分化过程中的作用机制被阐明[11-12],而 lncRNA在 PDLSCs对机械应力介导的成骨分化中的调控作用迄今尚无相关报道。
在临床正畸治疗中我们发现,牙周炎患者对正常正畸力的反应较缓慢,而轻力能更快的实现其牙齿移动。课题组前期研究已证实12%SMS是促进 HPDLSCs成骨分化的最佳力值,但该力值对P-PDLSCs的促成骨作用较弱,在部分样本中出现抑制作用。本研究结果中,P-PDLSC在12%SMS加载后成骨基因的表达较前期研究高可能与本研究所选取样本年龄以及细胞代数均较前期研究小有关,成骨基因的基线表达水平较高,在对机械刺激的应答上也较衰老样本积极,该变化趋势与Zhang等[13]的报道一致。但在本研究中12%SMS对P-PDLSCs的促成骨效应与H-PDLSCs相比显著降低,也说明了炎症微环境减弱了PDLSCs对力学刺激的应答反应,在正常力值的刺激下PPDLSCs无法表现出与H-PDLSCs相似的牙周改建效果。为研究其中的调控机制,我们通过构建lncRNA基因芯片并对在H-PDLSCs和 P-PDLSCs中差异表达的lncRNA进行筛选后发现,linc-01135在P-PDLSCs中的表达较H-PDLSCs明显下调,同时在成骨诱导后其表达量与成骨基因表达呈相关关系,其很有可能参与了对P-PDLSCs的成骨分化调控。本研究通过慢病毒上调及下调linc-01135的表达,观察到linc-01135对P-PDLSCs在12%SMS作用下的成骨分化有积极的调控作用,有效上调其表达后P-PDLSCs在12%SMS加载后的成骨分化能力明显提高,可能为改善炎症条件下牙周组织对正畸力介导的组织改建提供新的思路。
随着对lncRNA调控机制研究的逐步深入,目前已证实基因间lncRNA可作为竞争性内源RNA,与核心转录因子和microRNA一起构成调控网络[14]。通过对linc-01135进行ceRNA分析发现,其存在与miR-17-5p、miR-106b-5p等参与成骨基因调控的microRNA的结合位点,其可能通过招募染色质修饰复合物来影响其邻近区域相关成骨基因启动子来实现表观遗传干预作用,也有可能发挥“microRNA sponge”功能调控目标microRNA在靶mRNA上的分布[15],但其具体调控机制仍有待进一步研究。
lncRNA的发现对阐明炎症和疾病发展与转归中的科学现象提供了新的思路,探索lncRNA对 PPDLSCs在机械应力刺激应答中的调控机制,可为改善牙周炎患者的组织修复能力及正畸牙齿移动效率提供潜在的干预靶点。
[1]张琳琳,安莹,金岩,等.牙源性干细胞的研究进展[J].实用口腔医学杂志,2015,31(3):425-431.
[2]Seo BM,Miura M,Gronthos S,etal.Investigation ofmultipotent postnatal stem cells from human periodontal ligament[J].Lancet,2004,364(9429):149-155.
[3]Zhang C,Li J,Zhang L,etal.Effects ofmechanical vibration on proliferation and osteogenic differentiation of human periodontal ligament stem cells[J].Arch Oral Biol,2012,57(10):1395-1407.
[4]Liu J,LiQ,Liu S,etal.Periodontal ligamentstem cells in the periodontitismicroenvironment are sensitive to static mechanical strain[J].Stem Cells Int,2017,2017:1380851.
[5]Quinn JJ,Chang HY.Unique features of long non-coding RNA biogenesis and function[J].Nat Rev Genet,2016,17(1):47-62.
[6]Zou Y,LiC,Shu F,etal.lncRNA expression signatures in periodontitis revealed bymicroarray:The potential role of lncRNAs in periodontitis pathogenesis[J].J Cell Biochem,2015,116(4):640-647.
[7]Liu M,Dai J,Lin Y,et al.Effect of the cyclic stretch on the expression of osteogenesis genes in human periodontal ligament cells[J].Gene,2012,491(2):187-193.
[8]Peverali FA,Basdra EK,Papavassiliou AG.Stretch-mediated activation of selective MAPK subtypes and potentiation of AP-1 binding in human osteoblastic cells[J].Mol Med,2001,7(1):68-78.
[9]Bird A.Perceptions of epigenetics[J].Nature,2007,447(7143):396-398.
[10]Sonkoly E,Pivarcsi A.microRNAs in inflammation[J].Int Rev Immunol,2009,28(6):535-561.
[11]Zhu L,Xu PC.Downregulated LncRNA-ANCR promotes osteoblast differentiation by targeting EZH2 and regulating Runx2 expression[J].Biochem Biophys Res Commun,2013,432(4):612-617.
[12]Wang L,Wu F,Song Y,etal.Long noncoding RNA related to periodontitis interacts with miR-182 to upregulate osteogenic differentiation in periodontal mesenchymal stem cells of periodontitis patients[J].Cell Death Dis,2016,7(8):e2327.
[13]Zhang J,An Y,Gao LN,et al.The effect of aging on the pluripotential capacity and regenerative potential of human periodontal ligament stem cells[J].Biomaterials,2012,33(29):6974-6986.
[14]Khalil AM,Guttman M,Huarte M,et al.Many human large intergenic noncoding RNAs associate with chromatinmodifying complexes and affect gene expression[J].Proc Natl Acad Sci USA,2009,106(28):11667-11672.
[15]施伟,赵健,宋晓峰,等.LincRNA的研究进展[J].现代生物医学进展,2016,16(9):1762-1765.
