抑制Akt/PKB信号通路促进缺氧诱导的人牙周膜成纤维细胞凋亡
2018-04-12刘惠莉
刘惠莉
牙周炎是一类高发性的口腔炎症疾病,严重危害人类口腔健康,并与全身健康和诸多疾病有着密切的关系,在全球有着极高的发病率[1]。
近年来研究发现牙周炎主要是厌氧菌的混合感染,缺氧环境更有利于厌氧型致病菌的生长和繁殖,因此缺氧环境会加重牙周炎病变过程,影响牙周组织的防御和修复,并直接诱导牙周组织细胞的凋亡[2]。牙周膜成纤维细胞(hPDLFs)是牙周组织内的主要组成成分,其生物活性与牙周炎的发生密切相关[3]。
缺氧诱导的hPDLFs凋亡与牙周炎密切相关[4]。缺氧诱导因子-1(HIF-1)由α和 β两个亚基组成,HIF-1α蛋白在细胞核中表达,常氧条件下迅速降解。在缺氧的条件下,HIF-1α含量则显著提高,与含缺氧反应元件的下游基因结合,激活缺氧应答基因调控系统的缺氧应答反应[5]。
本文主要研究在缺氧条件下,抑制Akt/PKB信号通路对hPDLFs凋亡的影响,为进一步阐明牙周炎的发病机制提供理论基础。
1 材料与方法
1.1 主要实验材料与仪器
hPDLFs(BioWhittaker公司,美国);DMEM培养基(Gibco公司,美国);厌氧产气袋AnaeroPack(三菱公司,日本);FITC-Annexin V、Propidium Iodide(BD Biosciences Pharmingen公司,美国);Lipofectamine 2000转染试剂盒、si-Akt、si-control(Introvigen公司,美国);Fast SYBR Green mastermix kit(Applied Biosystems公司,美国);HIF-α单抗、pAktser473单抗、t-Akt单抗、βactin抗体及酶标二抗(CST公司,美国);流式细胞仪(BD公司,FACSCalibur,美国);PCR仪 (ABI公司,9700,美国)。其他常用试剂购自上海生工公司。
1.2 细胞培养
从液氮中快速取出hPDLFs,复苏后,用含有4 ml DMEM培养基的25 cm2的培养瓶在37℃、5%CO2培养箱中培养,24 h后更换培养基继续培养。
1.3 细胞缺氧处理
将hPDLFs接种入培养瓶,放入厌氧产气袋AnaeroPack,产生CO2,减少氧气含量至1%左右,扎口密封,放入细胞二氧化碳培养箱培养48 h。
1.4 细胞转染
取hPDLFs以7.5×104/孔的密度接种于6孔板中,5%CO2、37℃的培养箱中进行培养4 h。采用Lipofectamine 2000转染试剂盒转染,分别将si-Akt和si-control转染至细胞中,转染48 h后,收集细胞用于后续实验。
1.5 流式细胞仪检测细胞凋亡
取稳定转染和缺氧48 h处理的hPDLFs,培养48 h后收集并消化细胞,接种在6孔板中,PBS洗涤3次,使用500μl binding buffer重悬细胞,调整细胞浓度为1×105/孔,各孔加入5μl Annexin V-FITC和5μl PI混匀,室温避光放置10 min,流式细胞仪检测细胞的凋亡率。
1.6 qRT-PCR
取稳定转染和缺氧48 h处理的hPDLFs常规培养,用TRIzol试剂提取细胞中的总RNA。以提取的RNA为模板,反转录成cDNA。加入荧光染料SYBR Green,在ABI 7900 qRT-PCR系统,以U6 snRNA为相对定量的内参进行HIF-1α蛋白mRNA的扩增。
1.7 Western blot检测蛋白表达
取稳定转染和缺氧48 h处理的hPDLFs,培养48 h后消化收集,加入RIPA裂解液提取总蛋白,进行12%的SDS-PAGE电泳,将分离的蛋白转膜,5%脱脂奶粉室温封闭1 h后,将单抗HIF-α、p-Akt、t-Akt、Bcl-2、Bax在4℃条件下孵育过夜,加入二抗(辣根过氧化物酶标记),室温孵育1 h,ECL显影检测蛋白表达。
1.8 MTT法检测细胞增殖
取稳定转染和缺氧48 h处理的hPDLFs进行消化收集,以1×105/孔的密度接种于96孔板中,37℃、5%CO2条件下分别培养12、24、48、72 h后,加入10 μl MTT溶液,孵育4 h后,弃掉培养液,每孔加入150μl DMSO荡摇匀后,酶标仪检测490 nm的吸光值。
1.9 统计分析
2 结 果
2.1 缺氧抑制hPDLFs的增殖
在12、24、48、72 h时,缺氧组的细胞增殖率明显低于常氧组(P<0.05)(图 1)。

图1 缺氧抑制hPDLFs增殖Fig 1 Proliferation inhibition of hPDLFs by hypoxia
2.2 缺氧促进hPDLFs凋亡
与常氧组相比,缺氧组的hPDLFs的凋亡率明显提高(图2A、2B)。缺氧组的Bax蛋白表达量明显提高,Bcl-2蛋白表达量明显降低,Bax/Bcl-2的比值明显提高(图2C)。说明缺氧显著促进hPDLFs凋亡。
2.3 缺氧促进HIF-1α蛋白的表达
缺氧组的HIF-1α表达量明显高于常氧组(图3A),而HIF-1α的mRNA表达没有明显的变化(图3B)。结果说明缺氧显著促进HIF-1α的蛋白表达。
2.4 缺氧抑制Akt/PKB信号通路
与常氧组相比,pAktser473的表达量明显降低,而总Akt的表达量没有明显变化(P<0.05),说明缺氧明显抑制了Akt/PKB信号通路(图4)。
2.5 抑制 Akt/PKB信号通路促进缺氧条件下HIF-1α的蛋白表达
在缺氧条件下,si-Akt明显降低了pAktser473的表达,而总Akt的表达量没有明显变化,si-Akt抑制了Akt/PKB信号通路(图 5);在缺氧条件下,si-Akt组的HIF-1α蛋白表达明显高于si-control组,说明si-Akt显著抑制Akt/PKB信号通路,且明显提高了缺氧条件下HIF-1α蛋白的表达(图5)。
2.6 抑制Akt/PKB信号通路增强缺氧对的hPDLFs增殖的抑制
将si-Akt和 si-control转染 hPDLFs以研究 Akt/PKB信号通路抑制对hPDLFs增殖的影响。结果显示,在缺氧条件下,si-Akt组的hPDLFs增殖抑制率明显高于si-control组,且在24、48、72 h时有统计学差异(图6)。说明抑制Akt/PKB信号通路促进缺氧对hPDLFs增殖的抑制。
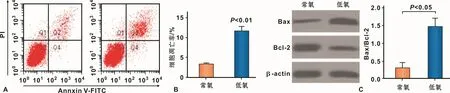
图2 缺氧诱导hPDLFs的凋亡Fig 2 Apoptosis of hPDLFs induced by hypoxia
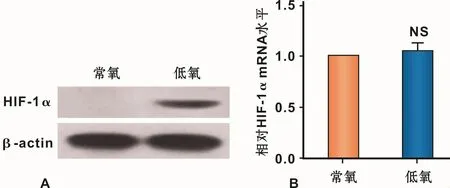
图3 缺氧提高hPDLFs HIF-1α蛋白的表达Fig 3 HIF-1αexpression in hPDLFs
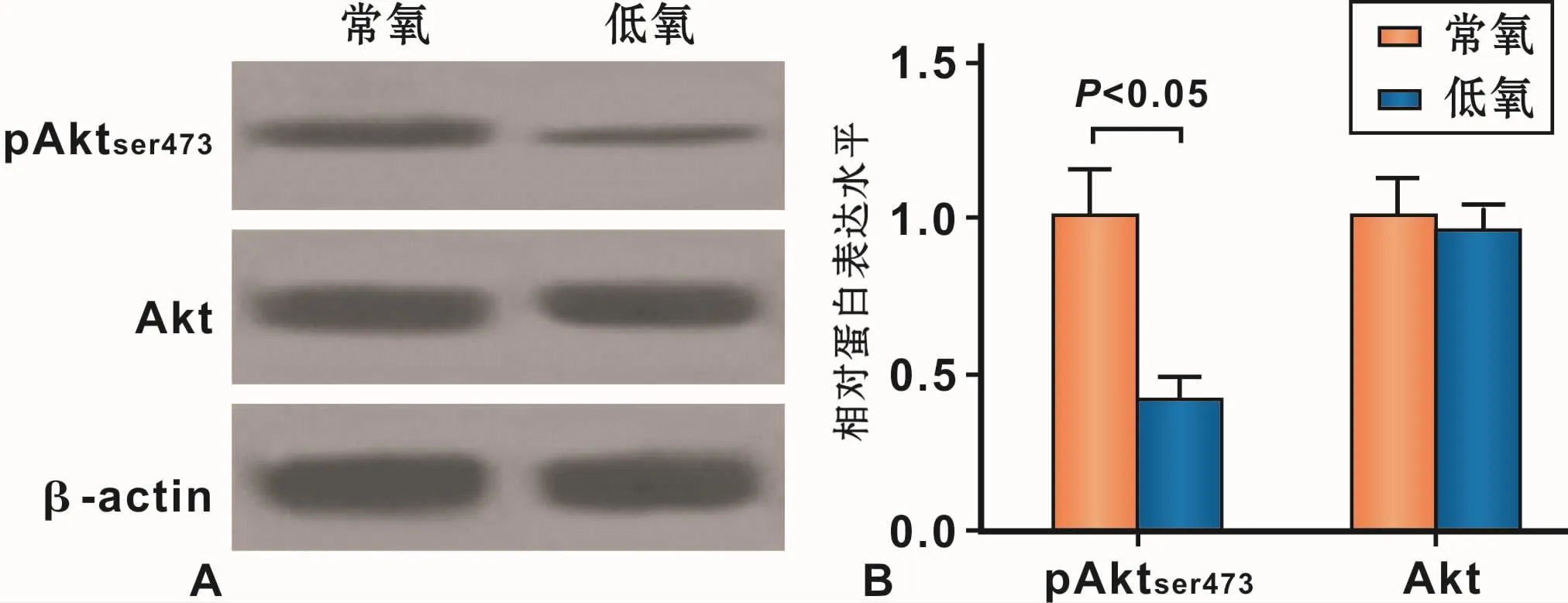
图4 缺氧抑制Akt/PKB信号通路Fig 4 Inhibition of Akt/PKB signaling pathway by hypoxia
2.7 抑制 Akt/PKB信号通路促进缺氧诱导的 hPDLFs的凋亡
在缺氧条件下,与 si-control对照组相比,si-Akt组的 hPDLFs凋亡率 明显提高(P<0.05)(图 7A)。Westernblot结果表明,与si-control组相比,si-Akt组的Bcl-2蛋白表达量明显减少,Bax蛋白表达量明显增加,Bax/Bcl-2的比值明显提高(图 7B)。说明抑制Akt/PKB信号通路显著促进缺氧诱导hPDLFs的凋亡。
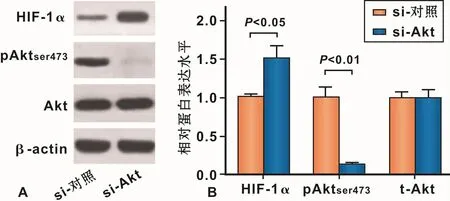
图5 抑制Akt/PKB信号通路促进缺氧诱导的HIF-1α蛋白表达Fig 5 Promotion of HIF-1αexpression by the inhibition of Akt/PKB signaling pathway hypoxic-induced reduction of HIF-1αlevel
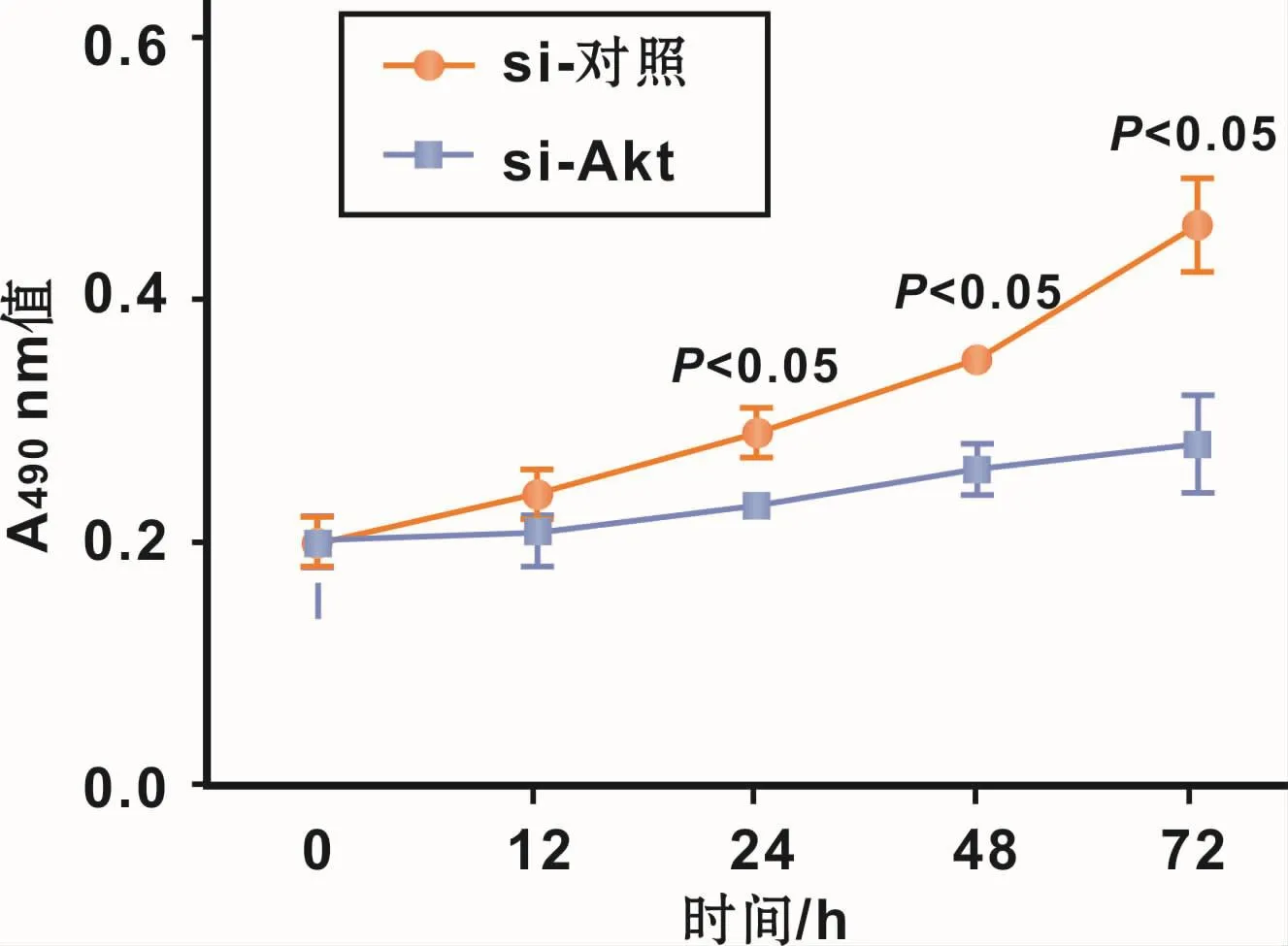
图6 抑制Akt/PKB信号通路增强缺氧诱导的hPDLFs增殖抑制Fig 6 Increase of the inhibition of hypoxia induced proliferation of hPDLFs by inhibition of Akt/PKB signaling pathway
3 讨 论
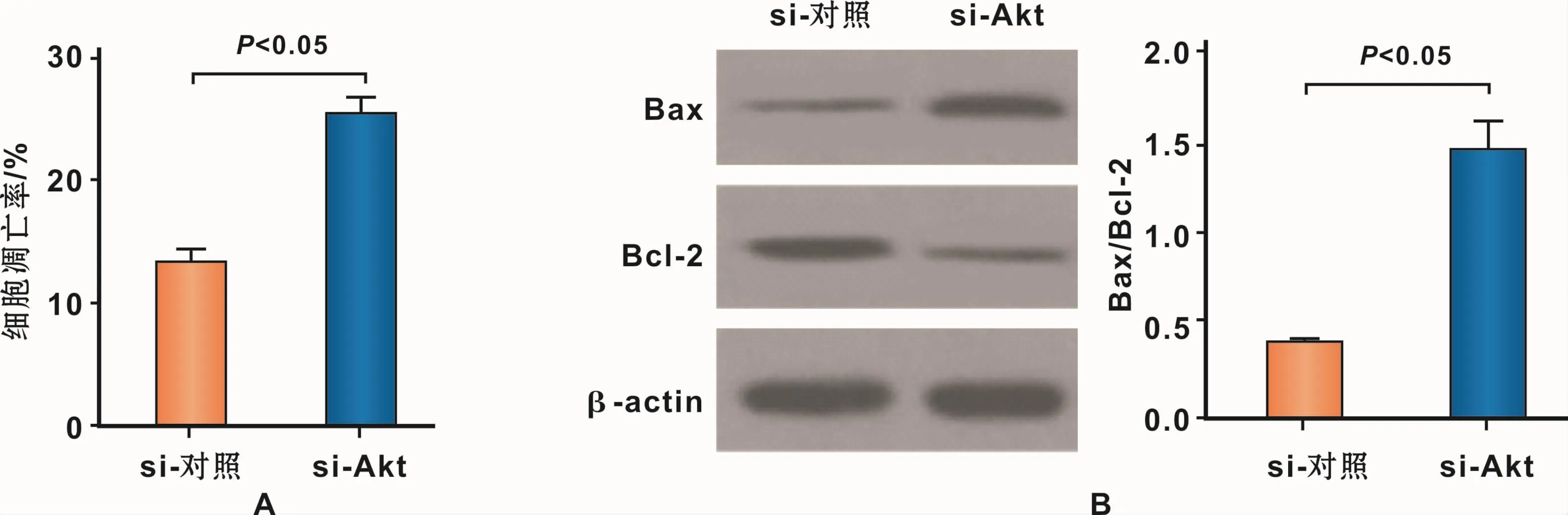
图7 抑制Akt/PKB信号通路促进缺氧诱导的hPDLFs的凋亡Fig 7 Increase of hypoxia-induced apoptosis of hPDLFs by the inhibition of Akt/PKB signaling pathway
细胞凋亡是在正常生理或病理状态下机体细胞发生的一种自发的、程序化的死亡过程,是细胞缺氧诱导细胞损伤的主要形式。细胞在缺氧条件下,细胞核中HIF-1α蛋白显著增加,引发一系列细胞缺氧反应[6]。本研究发现hPDLFs在缺氧条件下的凋亡率明显高于常氧条件下的凋亡率,说明缺氧促进了hPDLFs的凋亡,且缺氧条件下的HIF-1α蛋白表达量明显增加,HIF-1α mRNA没有明显的变化,常氧条件下几乎无HIF-1α的表达。研究表明缺氧对HIF-1αmRNA水平没有影响,但可以显著影响蛋白水平变化,可能是对转录后水平的调控。在缺氧的条件下,细胞核中HIF-1α蛋白显著增加,同时HIF-1β亚基从胞浆转移入细胞核中,与细胞核中的HIF-1α形成异二聚体。HIF-1异二聚体与含缺氧反应元件的下游基因结合,激活缺氧应答基因调控系统的缺氧应答反应,引发一系列细胞缺氧反应[7]。
Akt/PKB参与了多个细胞过程。SARS冠状病毒膜蛋白通过激活caspase-8和caspase-9并抑制PDK1与Akt/PKB信号通路的相互作用诱导细胞凋亡[8]。环氧化酶抑制剂SC236通过下调Akt的表达和上调Cyt-C的表达诱导胃癌细胞的凋亡[9]。Baran等[10]发现Akt/PKB信号通路可以作为介导小鼠胚胎细胞抗凋亡信号的主要靶标。在本研究中,实验结果证明缺氧显著促进hPDLFs的凋亡,抑制细胞增殖,抑制Akt/PKB信号通路,并且抑制Akt/PKB信号通路显著促进缺氧诱导的hPDLFs的凋亡,增强缺氧诱导的hPDLFs增殖抑制,提高HIF-1α蛋白的表达,为牙周炎发病机制的进一步研究提供了理论依据。
[1]Macedo Paizan ML,Vilela-Martin JF.Is there an association between periodontitis and hypertension?[J].Curr Cardiol Rev,2014,10(4):355-361.
[2]Song ZC,Zhou W,Shu R,etal.Hypoxia induces apoptosis and autophagic cell death in human periodontal ligament cells through HIF-1αpathway[J].Cell Prolif,2012,45(3):239-248.
[3]Zhang HY,Liu R,Xing YJ,etal.Effects ofhypoxia on the proliferation,mineralization and ultrastructure of human periodontal ligament fibroblastsin vitro[J].Exp Ther Med,2013,6(6):1553-1559.
[4]宋爱梅,侯超,陈家芳,等.缺氧对人牙周膜成纤维细胞基质金属蛋白酶和组织金属蛋白酶抑制物mRNA表达的影响[J].中华口腔医学杂志,2012,47(10):599-604.
[5]蔺琳,凌天牖.口腔黏膜下纤维化组织中缺氧诱导因子-1α的表达[J].实用口腔医学杂志,2015,31(2):230-232.
[6]Duval E,Bouyoucef M,Leclercq S,et al.Hypoxia inducible factor 1 alpha down-regulates type i collagen through Sp3 transcription factor in human chondrocytes[J].IUBMB Life,2016,68(9):756-763.
[7]Wu J,Ke X,Ma N,et al.Formononetin,an active compound of Astragalusmembranaceus(Fisch)Bunge,inhibits hypoxia-induced retinal neovascularization via the HIF-1α/VEGF signaling pathway[J].Drug Des Devel Ther,2016,10:3071-3081.
[8]Tsoi H,Li L,Chen ZS,etal.The SARS-coronavirusmembrane protein induces apoptosis via interfering with PDK1-PKB/Akt signalling[J].Biochem J,2014,464(3):439-447.
[9]Fan XM,Jiang XH,Gu Q,etal.Inhibition of Akt/PKB by a COX-2 inhibitor induces apoptosis in gastric cancer cells[J].Digestion,2006,73(2-3):75-83.
[10]Baran V,Fabian D,Rehak P.Akt/PKB plays role of apoptosis relay on entry into firstmitosis ofmouse embryo[J].Zygote,2013,21(4):406-416.
