胃癌患者根治性远端胃大部切除术后胃瘫综合征的相关因素及治疗方案
2018-04-12侯栋升姚立彬朱孝成
张 强, 侯栋升, 姚立彬, 李 超, 王 辉, 孟 松, 洪 健, 邵 永, 朱孝成
(徐州医科大学附属医院 胃肠外科, 江苏 徐州, 221000)
术后胃瘫综合征(PGS)是一种以无机械性梗阻的胃排空障碍为主要特征的术后并发症,多见于上腹部手术后,以胃及胰腺手术后多见。临床常表现为术后数日开始进食,或由流质饮食改为半流质饮食后出现上腹胀满、膨隆及恶心、呕吐等症状[1]。目前该病具体发病机制尚未阐明,对于此种并发症多采取保守性治疗,但效果欠佳。本研究对胃癌行远端胃大部根治术后出现胃瘫的相关因素及治疗方案进行回顾性分析,探讨胃瘫防治策略,现报告如下。
1 资料与方法
1.1 一般资料
选取2015年1月—2017年6月在本院普外科行根治性远端胃大部切除术的胃癌患者760例,男507例,女353例,年龄21~92岁,平均年龄(60.2±12.4)岁,其中41例术后发生PGS, 发生率为5.4%, 所有PGS患者均符合Bar-Natan[2]。诊断标准: ① 术后急性发病,表现为严重腹胀、恶心、呕吐,腹部叩诊有振水音; ② 胃引流量每日超过600 mL, 持续10 d以上; ③ 胃镜和(或)钡餐提示胃流出道无机械性梗阻; ④ 除外糖尿病等基础疾病; ⑤ 术后未应用影响平滑肌收缩的药物。本研究纳入病例均符合上述诊断标准。
1.2 治疗及结果
明确诊断后,予以积极的保守综合治疗: ① 留置胃管持续胃肠减压并每日计量,每日3%生理盐水250 mL洗胃, 2次/d; ② 维持水电解质、酸碱平衡,每3 d复查血常规了解患者内环境变化; ③ 胃动力药物,如胃复安10 mg肌内注射2次/d、多潘立酮10 mg口服3次/d等; ④ 注射用乳糖酸红霉素50万单位,0.9%生理盐水100 mL稀释静脉滴注2次/d; ⑤ 营养支持采用肠内营养(EN),诊断明确后内镜置入空肠营养管,行肠内营养。EN营养不足者行PN+EN; ⑥ 治疗2周后复查胃镜,排除机械梗阻、吻合口水肿等不利因素。
1.3 统计学分析
采用SPSS 19.0统计软件进行数据计分析,单因素分析计量资料比较采用t检验,计数资料采用r检验,单因素分析得出的显著性变量输入非条件Logistic回归模型进行危险因素多元分析。P<0.05为差异有统计学意义。
2 结 果
2.1 PGS组与无PGS组患者的单因素分析结果
PGS患者和无PGS患者在手术方式(腹腔镜/开腹)、消化道重建方式(毕Ⅱ/毕Ⅰ或Roux-en-Y)、幽门梗阻、腹腔感染、术后高血糖、术后低蛋白、术后贫血、术后营养方式、手术时间、出血量方面比较,差异有统计学意义(P<0.05), 见表1。其中腹腔感染包括腹腔出血、积液、积脓,吻合口瘘。术后低蛋白定义为术后1 d白蛋白<35 mmol/L; 术后高血糖定义为术后1 d血糖>8 mmol/L; 术后贫血定义为男性Hb<120 g/L, 女性<115 g/L; 早期营养方式分为全肠外营养(TPN)和肠外营养(PN)联合肠内营养(EN)。
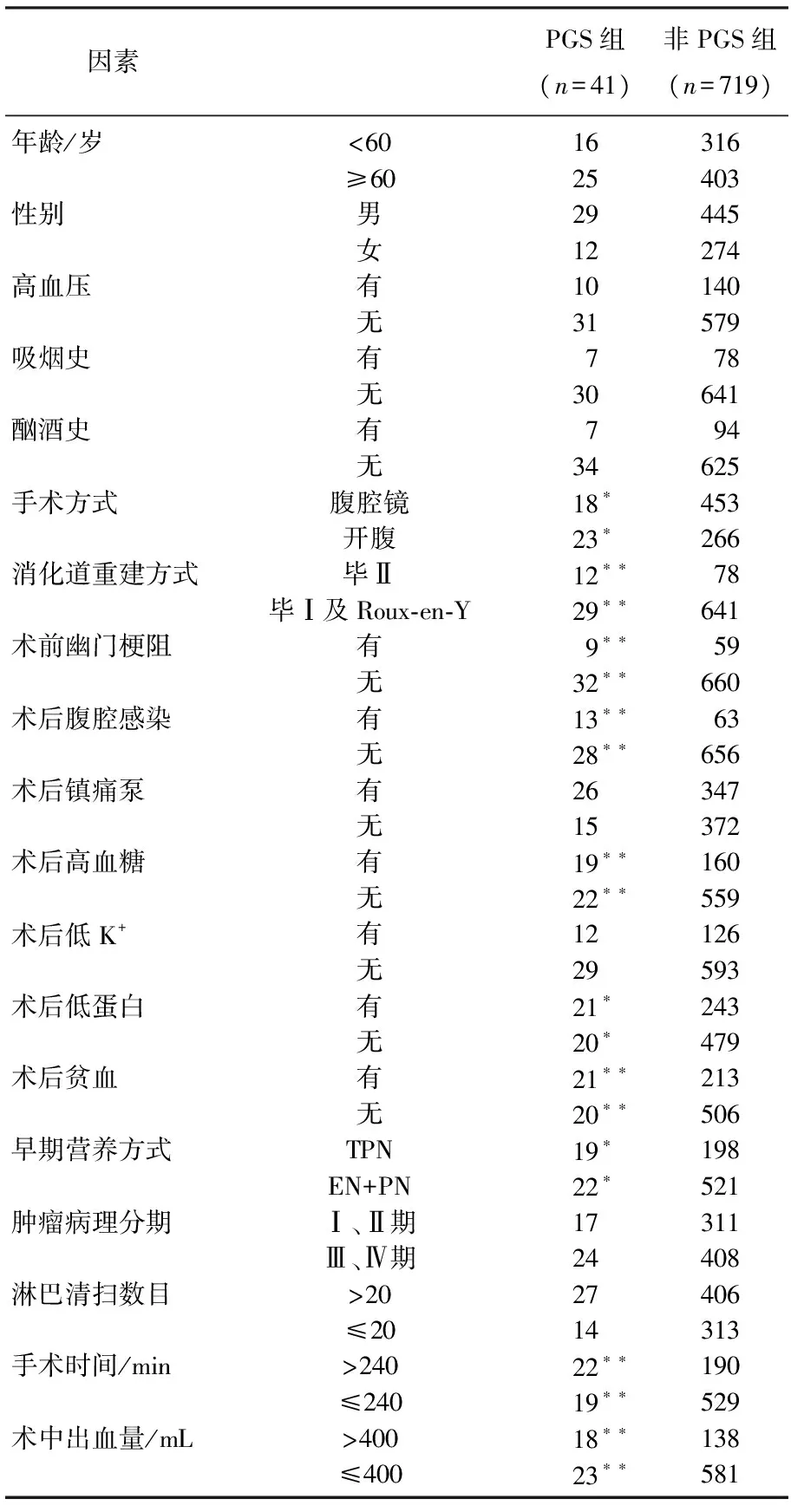
表1 胃癌术后PGS危险因素的单因素分析
与非PGS组比较, *P<0.05; **P<0.01。
2.2 PGS的多因素非条件Logistic回归分析
将是否发生胃瘫综合征作为应变量,可能影响胃瘫综合征发生的19个因素作为自变量,作多因素非条件Logistic回归分析(P入<0.05, P出>0.1)。经分析后得出毕Ⅱ式吻合、腹腔感染、术后高血糖、术后低蛋白、术后贫血、手术时间大于4 h、出血大于400 mL为PGS的危险因素(OR>1,P<0.05), 而行腔镜胃癌手术是胃瘫的保护因素(OR<1,P<0.05), 见表2。
2.3 PGS组单药治疗与联合用药治疗恢复时间分析
PGS行联合药物(大于等于两种不同机制促胃动力药物)治疗组(n=28)与单药治疗组(n=13)患者恢复时间比较,联合药物治疗组恢复时间为(30.5±19.3) d, 快于单药治疗组的(36.2±37.3) d, 差异有统计学意义(P<0.05)。
2.4 PGS组与非PGS组患者的住院时间及住院花费分析
PGS组住院时间、住院花费为(42.1±28.7) d、(98 171.0±34 214.0)元人民币,显著高于非PGS组(20.4±9.2) d、(69 893.3±40 638.4)元人民币(P<0.01)。
3 讨 论
术后胃瘫综合征(PGS)在普外科胃肠手术中的发生率为0.4%~5%[2], 本研究中发生率为5.4%。虽然外科技术及理念推陈出新,但对于PGS目前尚无明确的治疗方案可供作指南使用。对于术后胃瘫的发病机制的研究也未明确阐述病因机制,多中心研究显示以下因素为PGS的可能诱因: ① 手术损伤: 胃癌根治术切除大部胃体后,胃连续性破坏蠕动传播受阻,并且吻合口也会阻碍胃蠕动的传播,术后吻合口水肿更能放大这一不利因素。Zarate等[4]发现自发性胃瘫患者在肌间及肌内Cajal细胞明显减少,提示胃大部切除术后胃瘫综合征的发生还与胃壁术后神经节细胞缺失有关。② 消化道重建方式。③ 术后低白蛋白及高血糖。④ 镇痛麻醉措施: 麻醉药物可抑制交感神经,导致血管扩张、血压下降,严重者发生脑缺血、缺氧,而当停止使用镇痛药物后,上述交感神经的抑制作用解除,肠道血供得以恢复,导致缺血再灌注损伤,破坏胃肠道的黏膜屏障,导致局部胃壁渗出、水肿,使胃蠕动受限,增加了胃排空障碍的发生率[5]。⑤ 精神因素: 术后高度焦虑、紧张状态,致使体内激素水平失衡,包括激肽酶、5-羟色胺、儿茶酚胺及糖皮质激素等水平的改变,减弱胃平滑肌蠕动功能,导致食糜及胃肠液潴留,增加术后胃瘫风险[6]。⑥ 术后不恰当饮食顺序: 加重胃负担,延长胃肠功能恢复时间,甚或对吻合口造成破坏,增加术后并发症发生率。
作者分析了临床中可能导致胃瘫的19项因素,通过对比PGS患者和非PGS患者临床资料,结果显示,毕Ⅱ式消化道重建可增加PGS发生风险(P<0.05), 与Peparini等[7]的研究一致。BillrothⅡ式吻合较BillrothⅠ式吻合破坏原有消化道解剖结构及生理功能,且BillrothⅡ式吻合采用端侧吻合法,相较于BillrothⅠ式端端吻合,其加重了胃蠕动的不协调性,更容易出现胃动力障碍。在BillrothⅡ式的基础上增加Braun吻合或行Roux-en-y 吻合能够降低术后胃瘫的发生率[8]。术前合并幽门梗阻的患者,多合并低蛋白血症和贫血状态,这种病理状态下接受手术治疗将加剧患者营养不良,增加PGS风险。腹腔感染事件在胃癌患者术后并不少见,腹腔积液、积脓、瘘导致神经损伤、胃肠壁水肿将增加PGS发生概率[9]。术后禁食状态或早期流质饮食体内蛋白摄入不足,这种负氮平衡不利于患者术后机体组织及免疫功能恢复,还会加重肠壁及吻合口水肿。术后由于应激状态产生胰岛素抵抗而多见高血糖事件,高血糖可导致内脏的自主神经变性,使胃张力减退,运动功能减退[7, 10]。血糖还是胃动素的影响因素,血糖升高>8 mmol/L时对胃动力具有明显抑制作用,且表现出高度正相关性[11]。
对于胃癌患者术后早期供给EN或PN, 目前尚存争议。作者总结分析结果显示,早期行TPN病人较EN+PN方式增加了PGS发生风险(P<0.05), 国外研究[12-13]表明, PN途径静脉输注葡萄糖、氨基酸、脂肪乳剂可明显抑制胃肠动力,其机制为此几类物质可抑制迷走神经兴奋性及刺激胆囊收缩素分泌有关。手术时间过长(>4 h)、术中出血量增加(>400 mL)也是PGS发生的危险因素,考虑可能与增加了患者创伤有关。最有意义的发现在于腹腔镜胃癌手术成为PGS的的保护性因素。腹腔镜手术的优势在于创伤小、术后胃肠功能恢复快[14-15]。腹腔镜胃癌手术适应证随着操作技术及临床经验的积累逐渐放宽[16], 作者对于术前无腹腔镜手术禁忌,进展期胃癌可达到D2根治都推荐行腹腔镜下根治术。
术后胃瘫的治疗措施总结如下: ① 确诊后立即行持续胃肠减压, 3%温生理盐水洗胃2次/d。② 静脉补液、白蛋白,维持水电解、酸碱平衡和蛋白水平。③ 营养支持采用肠内营养(EN)途径,采用胃镜辅助下空肠营养管置入,肠内营养途径较符合正常人生理性营养方式,在维护肠道免疫屏障功能和免疫功能、简化血糖管理方面较PN途径具备明显优势,肠内营养较肠外营养价格低廉,不易发生肠道菌群移位,且肠内营养还具有促进肠蠕动功能的恢复作用[17]。④ 胃动力药,多潘立酮通过阻断外周多巴胺-2受体及激活胃泌素受体而发挥促进胃动力的作用。胃复安是中枢多巴胺-2受体拮抗剂,促进食管和胃窦收缩,降低幽门和十二指肠张力,加速小肠运动,从而促进胃排空[18]。但胃复安可通过血脑屏障,长期营养应注意可能引起的锥体外系副作用。红霉素是大环内酯类抗生素,应用后对胃以及近端小肠有强烈的促动力作用,促进胃肠协调运动。
[1] 全竹富. 手术后胃排空障碍[J]. 肠外与肠内营养, 2006, 13(1): 58-28. .
[2] Bar-Natan M, Lanson G M, Stephens G, et al. Delayed gastric emptying after gastric surgery[J]. Am J Surg, 1996, 172(1): 24-29.
[3] Michael C, Lawrence A S. POEMs for gastroparesis[J]. GASTROINTESTINAL ENDOSCOPY, 2017, 85(1): 129-131.
[4] Zarate N, Mearin F, Wang X Y, et al. Severe idiopathic gastroparesis due to neuronal and interstitial cells of Cajal degeneration: Pathological findings and management[J]. Gut, 2003, 52(7): 966-970.
[5] Woolf C J, Chong M S. Preemptive analgesia-treating postoperative pain by preventing the establishment of central sensitization[J]. Anesth Analg, 1993, 77(2): 362-369.
[6] Waseem S, Moshiree B, Draganov P V. Gastroparesis: current diagnostic challenges and management considerations[J]. World J Gastroenterology, 2009, 15: 25-37.
[7] Peparini N, Chirletti P. Does antecolic reconstruction decrease delayed gastric emptying after pancreatoduodenectomy[J]. World J Gastroenterol, 2012, 18(45): 6527-6531.
[8] 孙强, 蔡建珊, 马保金. 远端胃大部切除术消化道重建方式对术后胃瘫的影响[J]. 中国临床医生杂志. 2016, 44(6): 59-61.
[9] Tanaka M. Gastroparesis after a pylorus-preserving pancreatoduodenectomy[J]. Surg Today, 2005, 35(5): 345-350.
[10]Lshiguchi T, Tada H, Nakayawa K, et al. Hyperglycemia impairs antropyloric coordination and delays gastric emptying an conscious rats[J]. Autonneurosci, 2002, 95(3): 112-120.
[11]Shafi M A, Pasricha P J. Post-surgical and obstructive gastroparesis[J]. Curr Ggastroenterol Rep, 2007, 9: 280-285.
[12]MACGREGOR I L, WILEY Z B. LAVIGEN M E. Slowed rate of gastric emptying of solid food in man by having caloric parenteral nutrition[J]. Am J Surg, 1979, 138: 652-659.
[13]CASAUBON PIL, DAHLESTROMK A, VARGAS J. Intravenous fat emulsion (intralipid) delays gastric emptying, but does not cause gastroesophageal reflux in healthy volunteers[J]. JPEN, 1989, 13: 24-32.
[14]Kim W, Song K Y, Lee K I, et al. The impact of eomorbidity on surgical outcomes in laparescopy-assisted distal gastreetomy: a retrospective analysis of multicenter results[J]. Ann Surg, 2008, 248(5): 793-799.
[15]Kim H, Hyung W, Cho G, et al. Comparison of laparoscopic versus open gastrectomy for gastric cancer: a Phase Ul trial (KLASS trial): interim reports on morbidity and mortality[J]. Clin Oncol, 2008, 26(15 suppl): 4641-4649.
[16]Section of Laparoscopic&Endoscopic Surgery, Branch of Surgery, Chinese Medical Association. Robotic and laparoscopic Surgery Committee of Chinese Research Hospital Association Guideline for laparoscopic gastrectomy for gastric cancer(2016 edition)[J]. Chin J Dig Surg, 2016, 15(9): 851-857.
[17]LANG D H. Effect of enteral nutrition in the treatment of gastroparesis[J]. Journal of clinical Army Medicine, 2000, 6: 15-16.
[18]宋瑞, 陈学谦, 姜占武. 手术后胃瘫综合症诊疗进展[J]. 中国现代普通外科进展, 2009, 12(6): 511-513.
