巨噬细胞来源的外泌体不同提取方法的比较
2018-04-12王飘飘王会会彭代银张善堂陈卫东
王飘飘,王会会,彭代银,3,张善堂,陈卫东,3
(1. 安徽中医药大学药学院,安徽 合肥 230011;2. 安徽省立医院药剂科,安徽 合肥 230001;3.安徽省中药研究与开发重点实验室,安徽 合肥 230031)
外泌体(exosomes,EXOs)是由大多数细胞分泌的纳米级(30-150 nm)囊泡,如上皮细胞、间充质干细胞、肿瘤细胞等均可分泌EXOs[1]。可以根据粒径大小、囊泡携带的内容物及其在体内的去向来区别EXOs和其他囊泡[2]。因为其他的囊泡,比如微囊泡的形成方式是细胞表面出芽,而EXOs通常被认为起源于细胞内的多泡小体,然后多泡小体和细胞质膜融合而释放EXOs[3]。已经发现包括凋亡小体、微囊泡(microvesicles,MVs)和EXOs在内的细胞外囊泡,并已成为正常生理和病理状况下细胞间通讯的重要参与者[4]。而EXOs携带的蛋白质、核酸则是细胞间信号传导和信息交流的载体[5]。巨噬细胞(macrophage,MΦ)是抗原呈递细胞家族中一种重要的免疫细胞,可递呈抗原到自身表面的MHC分子,抗原-MHC复合物通过和T细胞受体(T cell reporter,TCR)相互作用,引起T细胞的活化。越来越多的研究发现,来源MΦ的EXOs表面同样表达MHCs及相应的复合物,活化T细胞而获得免疫反应[6]。
EXOs因其独特的生理作用而引起研究者的广泛关注。然而,囊泡亚群并没有完全明确的定义,并且有些囊泡在大小和密度上可能重叠,这使得一般的方法难以将其提取分离出来[7]。而且,EXOs所携带的物质及其机制仍然存在很大的争议[3],想得到完全纯的囊泡几乎不可能。另外,EXOs的提取和纯化需要大量的物力和财力,特别是研究EXOs蛋白质组学的实验。最近出现了使用方便、价格昂贵的商品化试剂盒,如产自Systems Biosciences的ExoQuickTM和产自Life Technologies 的Toal Exosome IsolationTM,尽管目前这些试剂盒被广泛使用,但是研究者发现该试剂盒提取得到的EXOs的产量和质量却不及其他方法。
ExoQuick和Toal Exosome Isolation的主要成分是一些聚合物(如聚乙二醇或者乙烯类聚合物)。简单的溶解聚乙二醇(PEG)来提取分离病毒和其他生物大分子已有50多年历史[8]。因为EXOs和病毒有着类似的生物学和物理学性质,假设用PEG沉淀的方法先将EXOs沉淀出来,再结合超高速离心除去杂质蛋白,从而找到可以替代超高速离心和试剂盒的一种便宜可行的EXOs分离方法。基于Albertsson等[8]使用的PEG浓缩病毒的方法来提取分离EXOs,为了验证该方法的准确性,将PEG沉淀结合超高速离心收集的EXOs和其他方法得到的EXOs进行对比。通过检测EXOs的形态、粒径及蛋白表达情况,改进方法的可行性。
1 材料
1.1细胞小鼠巨噬细胞RAW264.7由复旦大学药理实验室提供。
1.2试剂RPMI 1640培养基、青霉素-链霉素购自Hyclone;胎牛血清(fetal bovine serum, FBS)购自Gibco;BCA蛋白试剂盒购自碧云天公司;超敏感发光试剂盒购于Thermo公司;兔单克隆抗体Alix、TSG101、辣根过氧化物酶标记的羊抗兔IgG,均购自英国Abcam公司;PEG6000、氯化钠均购自Sigma公司。
1.3仪器Tecnai G2 SpirtBiotwin生物性透射电镜(美国赛默飞世尔公司);L-90K超高速低温离心机(美国贝克曼库尔特公司);纳米粒度仪NanoSight ZEN3690(英国马尔文公司)。
2 方法
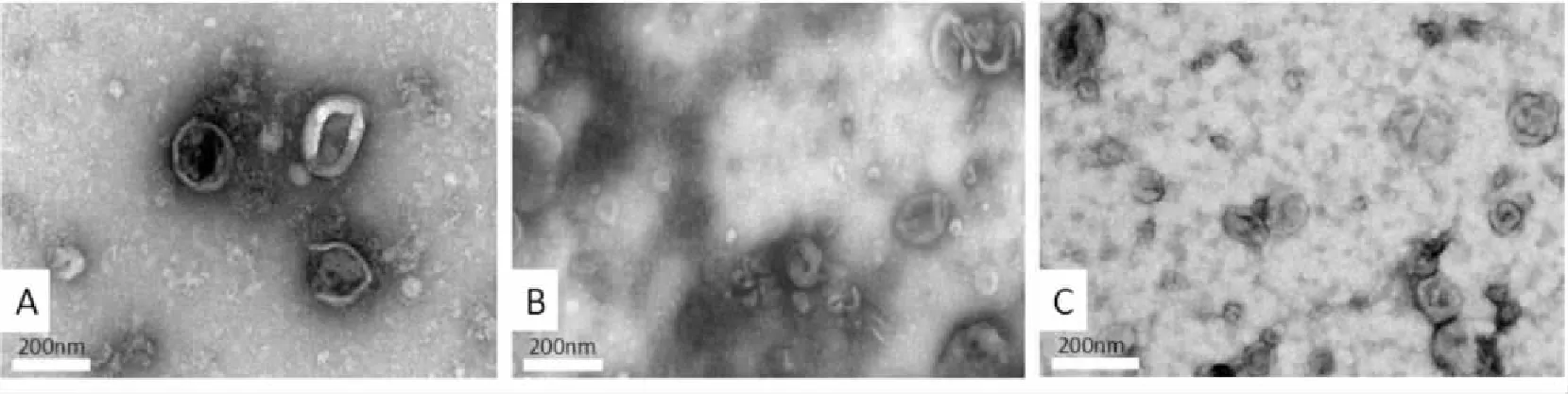
Fig 1 The transmission electron microscopy of exosomes isolated from culture medium by ultra-high speed centrifugation (A), EXO Quick kit (B), polyethylene glycol 6000 precipitation(C)
2.1巨噬细胞的培养用含有10% FBS(无EXOs)、1%青霉素-链霉素的RPMI 1640完全培养基培养RAW264.7细胞,待细胞融合到85%左右时,收集细胞上清,将细胞正常传代。
2.2细胞EXOs的提取
2.2.1超高速离心法将收集到的细胞上清液约200 mL,分装在离心管中,4℃ 2 000×g离心10 min,10 000×g离心30 min除去细胞碎片,上清转移至新的离心管中,于120 000×g离心70 min(4℃),收集试管底部液体,加入PBS重悬,然后再4℃、120 000×g离心70 min,得到的沉淀就是EXOs(D-EXOs)。将沉淀用PBS重悬,-80℃保存用于后续实验。
2.2.2ExoQuick试剂盒用购自美国System Biosciences(SBI)公司的EXOs提取试剂盒,具体步骤按照试剂盒说明书。将收集到的细胞上清液4℃、2 000×g离心10 min,10 000×g离心30 min除去细胞碎片,然后将上清与试剂盒按照体积比5 ∶1混合,4℃静置过夜,15 000×g离心30 min(4℃),将得到的沉淀(S-EXOs)用PBS重悬,-80℃保存。
2.2.3PEG6000改进的PEG6000沉淀结合超高速离心法富集EXOs的具体步骤如下:将16 g PEG6000、5.18 g NaCl溶于100 mL超纯水,配制成16%的储备液。过0.45 μm滤膜后备用。将收集到的细胞上清液约200 mL,4℃、2 000×g离心10 min,10 000×g离心30 min除去细胞碎片,上清转移至新的离心管中,收集的上清液与等体积的PEG6000储备液混合,上下颠倒混匀,于4℃冰箱静置过夜(12 h以上);10 000×g离心60 min(4℃);弃去上清,沉淀用PBS重悬,120 000×g离心90 min(4℃),收集的沉淀即为EXOs(P-EXOs),用PBS重悬后,于-80℃冰箱保存用于后续实验。
2.3生物型透射电子显微镜(TEM)观察EXOs的形态分别取超高速离心法、PEG6000沉淀法和试剂盒法提取的EXOs 20 μL,将EXOs滴加至铜网上,1 min后用滤纸吸干,再加1滴1%醋酸氧铀1 min后,用滤纸吸干,置于白炽灯下烤干,于电子透射显微镜下观察,并拍照。
2.4动态光散射(dynamiclightscattering,DLS)测定EXOs的粒径取0.5 mL EXOs母液,4.5 mL超纯水稀释,过0.22 μm的滤膜后,用纳米粒度仪对其粒径进行检测。
2.5纳米粒子示踪技术(nanoparticletraceranalysis,NTA)测定EXOs的粒径分布和浓度该技术可以实时直接通过光学显微镜收集观测纳米颗粒的散射光信号,然后对其在溶液中的布朗运动进行拍摄,最后对每个布朗运动的粒子进行追踪及分析,快速准确地计算出纳米颗粒的流体力学半径及浓度[9]。取EXOs母液,用水按照1 ∶7 500比例稀释到10 mL,设置仪器参数进样,计算出细胞上清液中EXOs的浓度。
2.6Westernblot分析EXOs的特异性蛋白将分离纯化的EXOs加上样缓冲液,100℃煮沸5 min,冷却至室温,12% SDS-PAGE进行蛋白分离,将蛋白转移至PVDF膜上,5%脱脂奶粉37℃封闭1.5 h,分别加入兔抗鼠TSG101单克隆抗体(1 ∶1 000)、兔抗鼠Alix单克隆抗体(1 ∶1 000),4 ℃孵育过夜,TBST洗膜10 min×3次,加入辣根过氧化物酶标记的山羊抗兔IgG,室温反应2 h,TBST洗膜10 min×3次,ECL超敏发光试剂盒检测。
3 结果
3.13种方法得到的EXOs的形态透射电镜下观察3种方法得到的EXOs,Fig 1结果表明,3种方法提取分离得到的EXOs的粒径大小均在100 nm左右,符合文献报道的30~150 nm。染色后可以看到EXOs包膜完整,呈典型的杯状结构。
3.2EXOs的粒径分布Fig 2 中1号曲线是差速离心法得到的EXOs,其平均粒径为82.01 nm(PDI=0.592),2号曲线是ExoQuick试剂盒法得到的EXOs,粒径的平均值为130.9 nm(PDI=0.847),3号曲线是PEG6000沉淀结合超高速离心法得到的EXOs,粒径均值为78.4 nm(PDI=0.224)。从粒径分析,PEG6000沉淀结合超高速离心得到的EXOs的平均粒径最小,Exo Quick试剂盒法得到的EXOs的粒径最大,但是差速离心法得到的EXOs粒径集中分散在82 nm附近,另外两种方法得到的EXOs粒径范围较大,但均在文献报道的范围内。结果提示,采用PEG沉淀结合超高速离心法得到的EXOs含有较少的其他大囊泡和杂质蛋白。
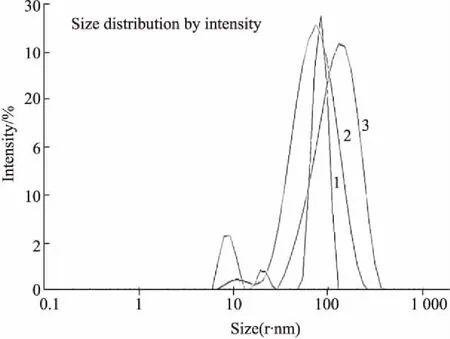
Fig 2 The particle size distribution of exosomes isolated byultra-high speed centrifugation (A), EXO Quick kit (B), polyethylene glycol 6000 precipitation (C)
3.3外泌体的浓度和粒径分布将3种方法提取的EXOs经PBS稀释7 500倍,测得差速离心法得到的EXOs的浓度大约为5.6×1014·L-1,试剂盒提取得到的EXOs的浓度大约为8.2×1015·L-1,PEG沉淀结合超高速离心的EXOs浓度约为8.6×1015·L-1(Fig 3)。
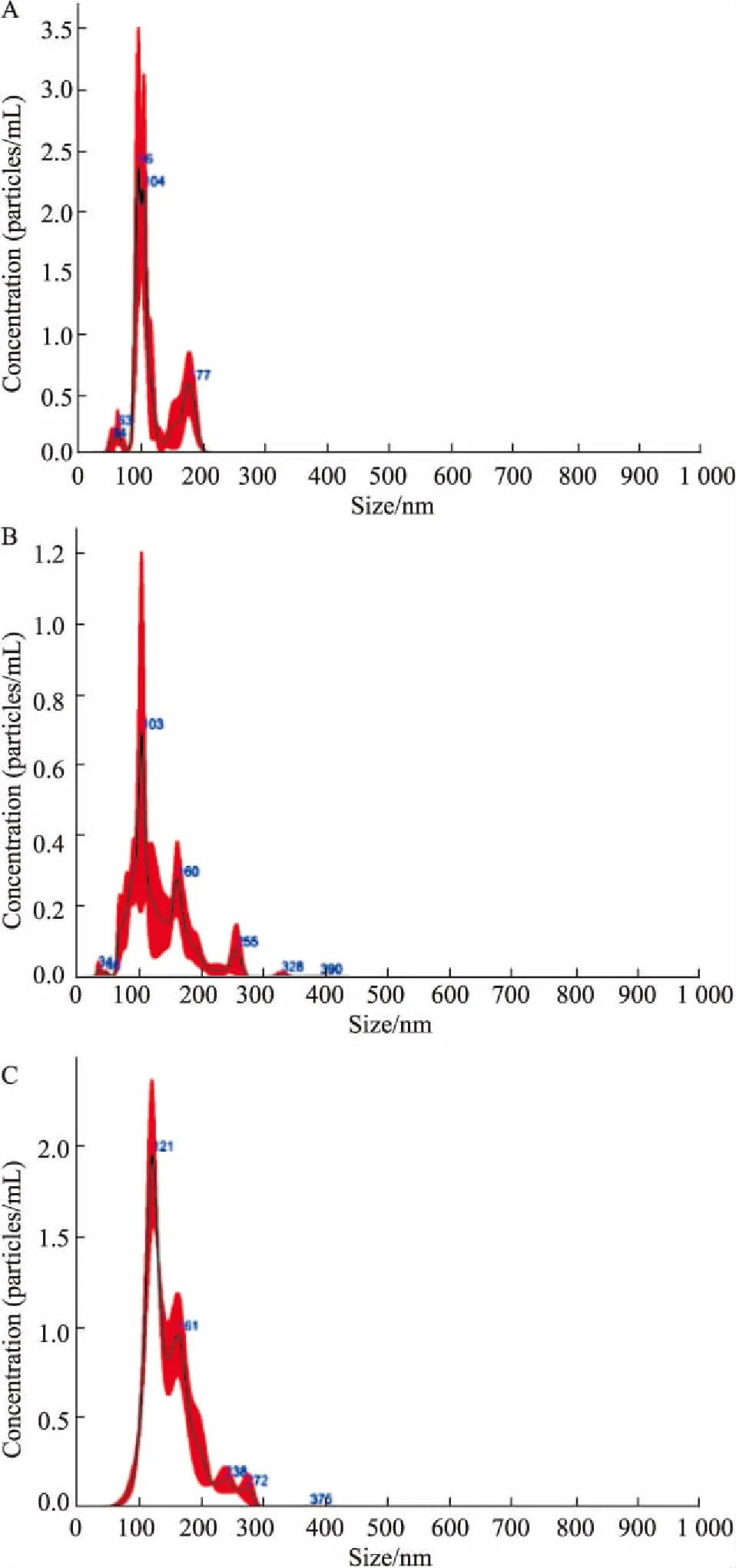
Fig 3 Concentration of exosomes isolated by Ultra-high speed centrifugation (A), EXO Quick kit (B), polyethylene glycol 6000 precipitation(C)
3.4蛋白检测结果蛋白印迹结果进一步验证了3种方法均提取得到了EXOs(Fig 4),Alix和TSG101在MΦ及其EXOs中均有表达,但是在EXOs中的表达丰度高于MΦ。
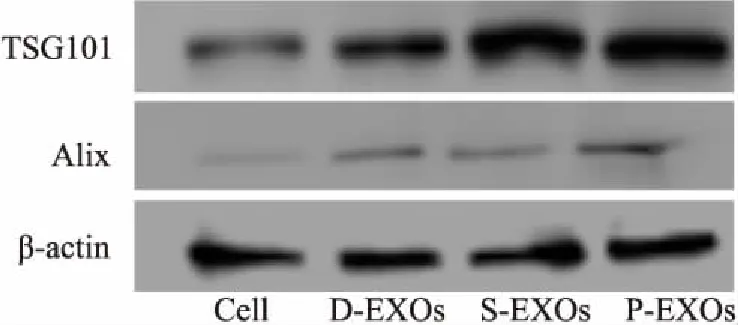
Fig 4 Expression of exosome surface marker of Alix and TSG101 isolated by ultra-high speed centrifugation, EXO Quick kit, polyethylene glycol 6000 precipitation
4 讨论
EXOs是内源性的囊泡,可用于诊断和治疗肿瘤等相关疾病[10]。MΦ是抗原呈递家族细胞之一,其在肿瘤和炎症的发生、发展中扮演着重要的角色。M1型巨噬细胞产生的EXOs可以通过创建淋巴结的炎性环境,来增强抗肿瘤疫苗的活性[11],在缺氧环境下,巨噬细胞来源的EXOs诱发内皮炎症因子的表达[12]。在心脏损伤过程中,巨噬细胞来源的EXOs携带mir-155,抑制纤维细胞的增殖,促进其炎症的产生[13]。正常巨噬细胞来源的EXOs携带较高水平的IL-6和IL-8,进入胎盘后,影响胎盘对炎症刺激的免疫调节能力[14]。越来越多研究发现,巨噬细胞来源EXOs在肿瘤和炎症反应中的重要作用,为进一步探讨巨噬细胞EXOs的其他生理功能,建立一种高效分离细胞EXOs的方法变得尤为重要。
现在EXOs分离提取常用的方法有经典的超高速离心法、试剂盒法、免疫磁珠法、亲和层析法、PEG沉淀法等。超高速离心法需要较长时间,试剂盒价格昂贵,各方法都有其优缺点,而EXOs质量和产量是后续实验的关键。Rider等[15]2016年发表的文章中对比了5%~10%及12%的7种PEG6000浓度提取细胞上清EXOs的总蛋白及RNA的数量和质量,结果发现,8%的PEG6000得到的EXOs的纯度和传统的差速离心法相近,后续共聚焦实验也发现PEG6000沉淀得到的EXOs的生物学功能不会受到影响,但是单纯的PEG6000沉淀下来的会有很多杂质蛋白,PEG也会部分黏附在EXOs表面,得到的EXOs不纯且粒径较大。
8% PEG6000沉淀结合超高速离心富集细胞上清中的EXOs,为了得到纯度更高的EXOs,将得到的沉淀用PBS重悬,超高速离心100 000×g离心90 min,通过TEM、DLS及NTA对提取物的形态和大小分布情况进行检测。TEM结果显示,PEG6000结合超高速离心法和差速离心法得到的EXOs在溶液中分散性较好,没有大量的聚集,而试剂盒法得到的EXOs则有明显的聚集,但是3种方法均得到了杯状或不规则形状的纳米级囊泡,直径符合文献报道的30~150 nm之间。DLS的结果显示,PEG6000沉淀结合超高速离心的EXOs的粒径较小,但是DLS没有NTA较高的分辨率,也无法计算粒子的浓度,所以我们用NTA对EXOs进行进一步的表征。NTA结果显示,3种方法得到的EXOs的粒径在100 nm左右,含有部分尺寸较大的囊泡,较大尺寸的囊泡可能由于EXOs的聚集所致,这与文献报道的结果也是相符的。PEG6000沉淀结合超高速离心法和试剂盒得到的EXOs的浓度相当,差速离心法的浓度略小一些。结合EXOs的表面稳定表达的抗原呈递蛋白,检测了提取物中Alix和Tsg101表达情况,结果显示,提取物均阳性表达这2种蛋白,结果可以再次证明PEG6000沉淀结合超高速离心提取细胞来源的EXOs的可靠性。
综上,改进的8% PEG6000沉淀结合超高速离心的方法可以准确、快速、高效地提取分离出细胞上清中的EXOs,为后续研究探讨MΦ来源的EXOs在肿瘤和炎症方面的生物学功能及相关机制奠定了基础,为MΦ来源的EXOs在临床医学等方面的应用提供了理论依据。
参考文献:
[1]Pascucci L, Cocce V, Bonomi A, et al. Paclitaxel is incorporated by mesenchymal stromal cells and released in exosomes that inhibit in vitro tumor growth: a new approach for drug delivery[J].JControlRelease, 2014,192: 262-70.
[2]Colombo M, Raposo G, Thery C. Biogenesis, secretion, and intercellular interactions of exosomes and other extracellular vesicles[J].AnnuRevCellDevBiol, 2014,30: 255-89.
[3]Lo Cicero A, Stahl P D, Raposo G. Extracellular vesicles shuffling intercellular messages: for good or for bad[J].CurrOpinCellBiol, 2015,35: 69-77.
[4]李 超,戴 敏. 不同细胞来源的EXOs在动脉粥样硬化中的研究进展[J]. 中国药理学通报,2017,33(1):27-32.
[4]Li C, Dai M. Research progress of different cell derived extracellular bodies in atherosclerosis [J].ChinPharmacolBull, 2017,33(1):27-32.
[5]Xu D, Tahara H. The role of exosomes and micro-RNAs in senescence and aging[J].AdvDrugDelivRev, 2013,65(3): 368-75.
[6]张欢妍,汪雪峰,马永宾,等. 胞外囊泡作为药物传递天然纳米载体的研究进展[J]. 中国药理学通报,2017,33(6): 757-60.
[6]Zhang H Y, Wang X F, Ma Y B, et al. Progress of extracellular vesicles as a drug delivery of natural nano carriers [J].ChinPharmacolBull, 2017,33(6): 757-60.
[8]Albertsson P, Frick G. Partition of virus particles in a liquid two-phase system[J].BiochimBiophysicaActa, 1960,37(2): 230-7.
[9]Sokolova V, Ludwig A K, Hornung S, et al. Characterisation of exosomes derived from human cells by nanoparticle tracking analysis and scanning electron microscopy[J].ColloidsSurfBBiointerfaces, 2011,87(1): 146-50.
[10] Jansen F, Nickenig G, Werner N. Extracellular Vesicles in cardiovascular disease: potential applications in diagnosis, prognosis, and epidemiology[J].CircRes, 2017,120(10): 1649-57.
[11] Cheng L, Wang Y, Huang L. Exosomes from M1-polarized macrophages potentiate the cancer vaccine by creating a pro-inflammatory microenvironment in the lymph node[J].MolTher, 2017,25(7):1665-7.
[12] Osada-Oka M, Shiota M, Izumi Y, et al. Macrophage-derived exosomes induce inflammatory factors in endothelial cells under hypertensive conditions[J].HypertensRes, 2017,40(4): 353-60.
[13] Wang C, Zhang C, Liu L, et al. Macrophage-derived mir-155-containing exosomes suppress fibroblast proliferation and promote fibroblast inflammation during cardiac injury[J].MolTher, 2017,25(1): 192-204.
[14] Holder B, Jones T, Sancho Shimizu V, et al. Macrophage exosomes induce placental inflammatory cytokines: a novel mode of maternal-placental messaging[J].Traffic, 2016,17(2): 168-78.
[15] Rider M A, Hurwitz S N, Meckes D G Jr. ExtraPEG: a polyethylene glycol-based method for enrichment of extracellular vesicles[J].SciRep, 2016,6: 23978.
