克老素抑制地塞米松诱导的MC3T3-E1成骨细胞凋亡
2018-04-12李宝善马厚勋
黄 倩,李宝善,梁 霄,刘 丹,马厚勋
(1.重庆医科大学附属第一医院老年病科,重庆 400016;2. 重庆市急救医疗中心老年病科,重庆 400014)
地塞米松(dexamethasone, DEX)等糖皮质激素作为临床上极为常用的抗炎药、免疫抑制药,广泛用于诸如类风湿性关节炎、炎症性肠病、慢性阻塞性肺疾病等疾病的治疗。大剂量或者长期低剂量的使用糖皮质激素可能导致多种骨相关性不良反应,包括骨质疏松和骨坏死,该效应具有剂量与时间依赖性。尽管糖皮质激素诱导性骨质疏松已经成为临床上最常见的继发性骨质疏松,然而就其治疗干预性研究仍需做深入探讨[1-2]。已有研究表明,糖皮质激素诱导性骨质疏松及其并发骨折的原因在于糖皮质激素使成骨细胞数量减少,其具体机制是抑制成骨细胞形成,促使其凋亡[3]。
克老素(Klotho, KL)基因及其表达与人类包括骨质疏松在内的数种衰老表型关系极为紧密[5]。本课题组前期就携带KL基因的腺相关病毒感染骨质疏松模型大鼠进行体内实验研究,发现大鼠骨质疏松病情及其骨微结构的破坏可通过上调KL表达得以缓解[4];同时,通过上调大鼠原代成骨细胞的KL基因表达水平的体外实验研究,发现KL可以增强成骨细胞活性[6]。而有关人类KL基因研究结果还证实,在老年人群中,血浆KL浓度较低人群更易致骨量丢失,这与骨矿物质密度降低致使骨折风险增加密切相关[7]。尽管已有研究证实KL基因表达调节在原发性骨质疏松的发生、发展中发挥了极其重要作用,但有关KL基因表达在以糖皮质激素诱导性骨质疏松为代表的继发性骨质疏松发生、发展中的分子生物学机制研究报道甚少。为此,本研究通过转染携带KL基因的重组腺病毒(recombination adenovirus containing KL gene, Ad-KL)于MC3T3-E1成骨细胞,并构建DEX诱导性骨质疏松的细胞模型,探究KL表达上调对MC3T3-E1成骨细胞凋亡的影响,为糖皮质激素诱导性骨质疏松的预防及治疗提供新的依据及基础。
1 材料与方法
1.1 材料
1.1.1细胞与试剂MC3T3-E1细胞购自上海和元生物。DEX(5 g·L-1)购自重庆太极集团西南药业,相对分子质量516.41,批次:170109;带绿色荧光蛋白(green fluorescent protein, GFP)基因的重组腺病毒(recombination adenovirus containing GFP gene, Ad-GFP)及Ad-KL购自上海吉凯公司;qPCR相关试剂均购自大连TaKaRa公司;Cell Counting Kit-8(CCK-8)分析试剂盒买于日本同仁研究所;ɑ-MEM培养基购自美国Hyclone公司;胎牛血清(fetal bovine serum, FBS)购自德国PAN公司;青霉素-链霉素(双抗)溶液、0.25%胰酶、配胶试剂盒等购自碧云天公司;兔抗鼠KL多克隆抗体购自英国Abcam;兔抗鼠Bcl-2抗体购自美国CST;兔抗鼠caspase-9抗体购自博奥森生物;辣根过氧化物酶标记的山羊抗兔IgG、兔抗鼠Bax抗体购自武汉三鹰生物;兔抗鼠GAPDH购于杭州贤至生物;山羊抗兔IgG荧光二抗购自美国Abbkine公司。
1.1.2仪器CFX96实时定量PCR仪(美国Bio-Rad公司),倒置相差显微镜(日本Olympus公司),低温高速离心机(美国Sigma公司),荧光倒置显微镜(日本Olympus公司),流式细胞仪FACSVantage (美国BD公司),全波长酶标仪(美国Thermo公司)。
1.2细胞培养、转染、DEX浓度筛选与分组
1.2.1细胞培养与转染MC3T3-E1成骨细胞于37℃、5% CO2的环境下培养于α-MEM完全培养基中。按每孔5×103个细胞接种于96孔板。待细胞紧密贴壁后,按感染复数(multiplicity of infection, MOI)=60、80、100、120分别加入Ad-KL和Ad-GFP,各组设置4个复孔。24 h后,常规培养基替代含病毒液的培养基培养24 h,荧光倒置显微镜下观察细胞转染后24、48 h的形态学特征。200倍物镜下各孔随机取3个视野,分别于绿光及白光下数同一视野下表达绿色荧光的细胞数和细胞总数,并计算转染效率,取均值。转染效率=绿色荧光细胞数/细胞总数×100%。按照以上方法筛选出转染最适的MOI值。
1.2.2诱导MC3T3-E1凋亡的DEX浓度筛选将MC3T3-E1成骨细胞以5×103个/孔接种于96孔板,每孔加入100 μL培养基。次日,更换至含所需浓度DEX的培养基,分别将浓度为0.125、0.25、0.5、1、2、4 mmol·L-1的DEX加入孔内,培养48 h后,每孔加入CCK-8液10 μL,于原培养环境下孵育1~1.5 h后分析吸光度。
1.2.3实验分组依据研究需要,设立5个实验组:对照组(Control组)、DEX诱导组(DEX组)、Ad-KL转染组(KL组)、Ad-KL转染DEX诱导组(KL+DEX组)、Ad-GFP转染DEX诱导组(GFP+DEX组)。本研究以每瓶5×105个细胞的密度将细胞接种于T25培养瓶内,待细胞贴壁后,按如下顺序开展实验:(1)根据MOI =100的浓度,分别计算出每孔需加入的Ad-KL和Ad-GFP病毒液的量。各组细胞换液后,按每瓶1 mL加入培养基,KL组、KL+DEX组添加计算剂量的Ad-KL病毒液,GFP+DEX组添加Ad-GFP病毒液转染24 h;(2)按每瓶2 mL的剂量更换培养基继续培养24 h;(3)更换培养基继续培养2 d,此时,使用含优化浓度DEX的培养基培养DEX组、KL+DEX组、GFP+DEX组成骨细胞。
1.3CCK-8法检测细胞存活率依据实验设计要求,将Control组、DEX组、KL组、KL+DEX组、GFP+DEX组的细胞分别培养于96孔板,按照设计方案的相应处理方法处理细胞,细胞实验结束时测定其相对存活率。细胞相对存活率计算参见文献[8]。
1.4qPCR检测各组细胞KL、Bcl-2、BaxmRNA的表达依据前述处理方法建立各组,开展以下实验。参考试剂盒的详细说明,根据研究需要提取处理组MC3T3-E1成骨细胞的总RNA、逆转录成cDNA并进行cDNA扩增。扩增样本为10 μL体系。扩增条件均为:95℃预变性30 s;95℃变性5 s,60℃退火30 s,50个循环;65℃ 5 s,95℃ 50 s终止。以GAPDH为内参,计算KL、Bcl-2和Bax mRNA的相对表达量。小鼠KL上游引物为5′-GTTGGGTCACTGGGTCAATC-3′,下游引物为5′- TCATCGTACAGATGCCAAGC-3′;小鼠Bcl-2上游引物为5′-CCACCTGTGGTCCATCTGAC-3′,下游引物为5′-GGTGCAGCTGACTGGACATC-3′;Bax上游引物为5′-CTGAGCTGACCTTGGAGCAG-3′,下游引物为5′-CCACGTCAGCAATCATCCTC-3′;内参基因GAPDH上游引物为5′-GGTTGTCTCCTGCGACTTCA-3′,下游引物为5′-TGGTCCAGGGTTTCTTACTCC-3′。
1.5Westernblot检测细胞中KL、Bcl-2、Bax蛋白表达各研究组细胞按前述方式培养,实验结束后,提取细胞总蛋白。采用BCA法测定蛋白浓度。取适量蛋白样品加样,SDS-PAGE电泳,将蛋白条带转到PVDF膜上,250 mA电流转膜30 min,5%脱脂奶封闭2 h,4℃孵育一抗过夜,复温、漂洗一抗,然后37℃下孵育二抗,ECL发光试剂显影,分析各组KL、Bcl-2、Bax蛋白表达情况。
1.6免疫荧光分析caspase-9荧光蛋白的表达以每孔5×103个的密度将成骨细胞接种于96孔板内,按照每孔100 μL的量加入培养基,各研究组细胞均采取前述干预方式。免疫荧光检测具体操作方法如下:PBS洗3次,多聚甲醛固定细胞15 min,按每孔100 μL加入Triton破膜10 min,接着PBS洗4次(轻拍孔板),甩干孔板,加入适量山羊血清(孔底铺满即可)于37℃封闭1 h;吸去封闭液并甩干孔板,按每孔40 μL加入兔抗鼠caspase-9抗体(1 ∶100稀释),4℃过夜;37℃复温30 min,PBS洗4次;以下步骤均要求暗室内操作,稀释山羊抗兔荧光二抗(1 ∶200)、DAPI(1 ∶100),按每孔50 μL加入二抗,37℃孵育1 h;吸净液体,PBS洗4次,滴加DAPI 50 μL作用10 min;PBS洗4次,甩干孔板,加入抗淬灭剂,铺满孔底即可。在荧光倒置显微镜下观察研究组细胞荧光强弱及荧光显示部位,依据检测荧光强度反映其caspase-9荧光蛋白的表达水平。
1.7流式细胞术检测细胞凋亡率各研究组细胞按前述分组操作结束后,均进行以下实验操作:(1)收集瓶内培养基,PBS清洗1次;(2)消化收集细胞,以1 500 r·min-1离心5 min;(3)预冷PBS洗涤细胞2次,弃上清。根据Annexin V-PE/ 7-AAD双染细胞凋亡试剂盒的指示做相应处理后,上机检测各组细胞凋亡率。

2 结果
2.1DEX对MC3T3-E1成骨细胞存活率的影响不同DEX浓度处理细胞后,其存活率随着DEX浓度的递增而呈现出递减的趋势。当DEX浓度为0.5 mmol· L-1时,存活细胞数目明显降低(P<0.01)。当DEX浓度增至2 mmol·L-1时,导致40%~60%细胞死亡,故本实验选取该浓度值做后续研究的DEX浓度标准(Fig 1)。
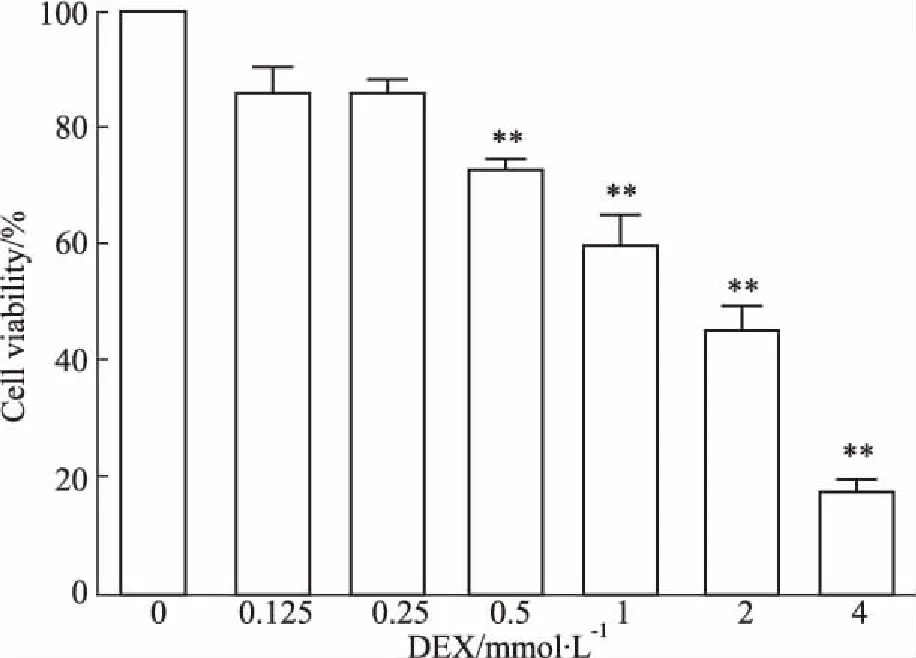
Fig 1 Effect of different concentrations of DEX on MC3T3-E1 cell viability
**P<0.01vsDEX 0 mmol·L-1
2.2重组腺病毒感染细胞情况及细胞形态特征病毒感染细胞24 h后可见少量荧光表达,48 h后,荧光强度随MOI值增加而增强;在MOI=100时,Ad-GFP和Ad-KL转染效率分别为92.9%、94.7%,且细胞状态良好(Fig 2)。
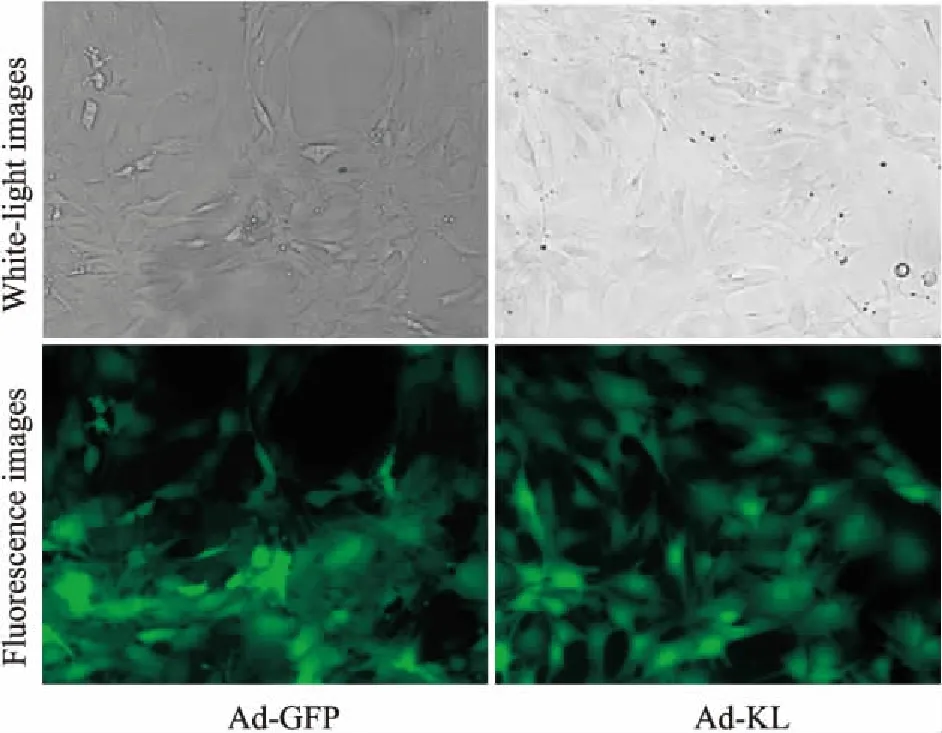
Fig 2 Transfection efficiency of Ad-GFP and Ad-KL in MC3T3-E1 cells and cell morphology(× 200)
2.3各组细胞KLmRNA和蛋白表达情况qPCR和Western blot法分别检测各研究组细胞KL mRNA和蛋白的表达情况。Fig 3结果显示,KL转染组与KL+DEX组细胞KL mRNA表达明显增加(P<0.01),Control组、DEX组与GFP+DEX组细胞也有少量KL mRNA表达;KL组和KL+DEX组细胞有明显的KL蛋白表达(P<0.01),其余各组细胞未检测出KL蛋白表达。提示重组KL腺病毒成功感染了MC3T3-E1成骨细胞,并且其携带的KL基因在MC3T3-E1成骨细胞内明显表达KL蛋白。
2.4各组细胞的存活率情况各研究组细胞经相应处理后分析其存活率,Fig 4结果显示,KL组成骨细胞细胞存活率与Control组细胞相当,DEX组其成骨细胞存活率较Control组明显降低(P<0.01);KL+DEX组存活率较DEX组、GFP+DEX组均明显升高(P<0.01),而对比DEX组,GFP+DEX组成骨细胞存活率差异无显著性。
2.5各组细胞凋亡率Fig 5结果显示,与Control组对比,DEX组凋亡率明显升高(P<0.01),KL组与Control组相当;与DEX组、GFP+DEX组对比,KL+DEX组凋亡率均明显降低(P<0.01),而相比于DEX组,GFP+DEX组凋亡率差异无显著性。
2.6各组细胞抗凋亡蛋白Bcl-2和促凋亡蛋白BaxmRNA、蛋白的表达情况Fig 6结果显示,与Control组相比,KL组成骨细胞Bcl-2 mRNA和蛋白水平明显增加(P<0.01),Bax mRNA和蛋白水平均明显降低(P<0.01);DEX处理组成骨细胞Bcl-2 mRNA和蛋白水平均明显降低(P<0.01),Bax mRNA和蛋白水平均明显增加(P<0.01)。与DEX处理组对比,KL+DEX组成骨细胞表达Bcl-2 mRNA和蛋白水平增高(P<0.01),而Bax mRNA和蛋白水平明显降低,差异有统计学意义(P<0.01)。与GFP+DEX组相比,KL+DEX组成骨细胞Bcl-2 mRNA和蛋白表达明显增高(P<0.01),而Bax mRNA和蛋白表达均明显降低(P<0.01)。研究还发现,对比DEX组,GFP+DEX组表达Bcl-2、Bax mRNA和蛋白无明显差异。

Fig 3 Expression of KL mRNA(A) and protein(B) detected by qPCR and Western blot
**P<0.01vscontrol
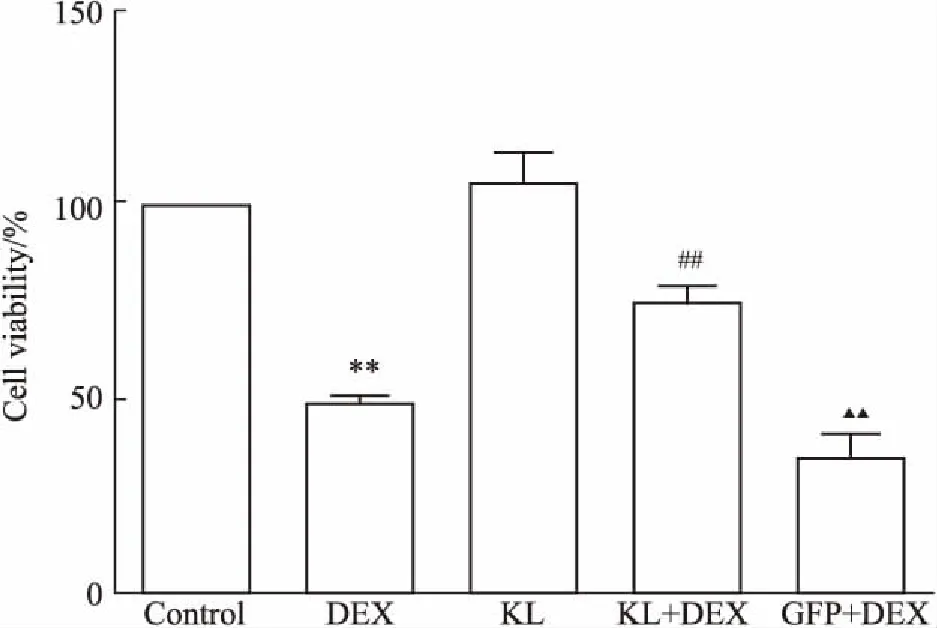
Fig 4 Cell viability in different groups
**P<0.01vscontrol;##P<0.01vsDEX;▲▲P<0.01vsKL+DEX
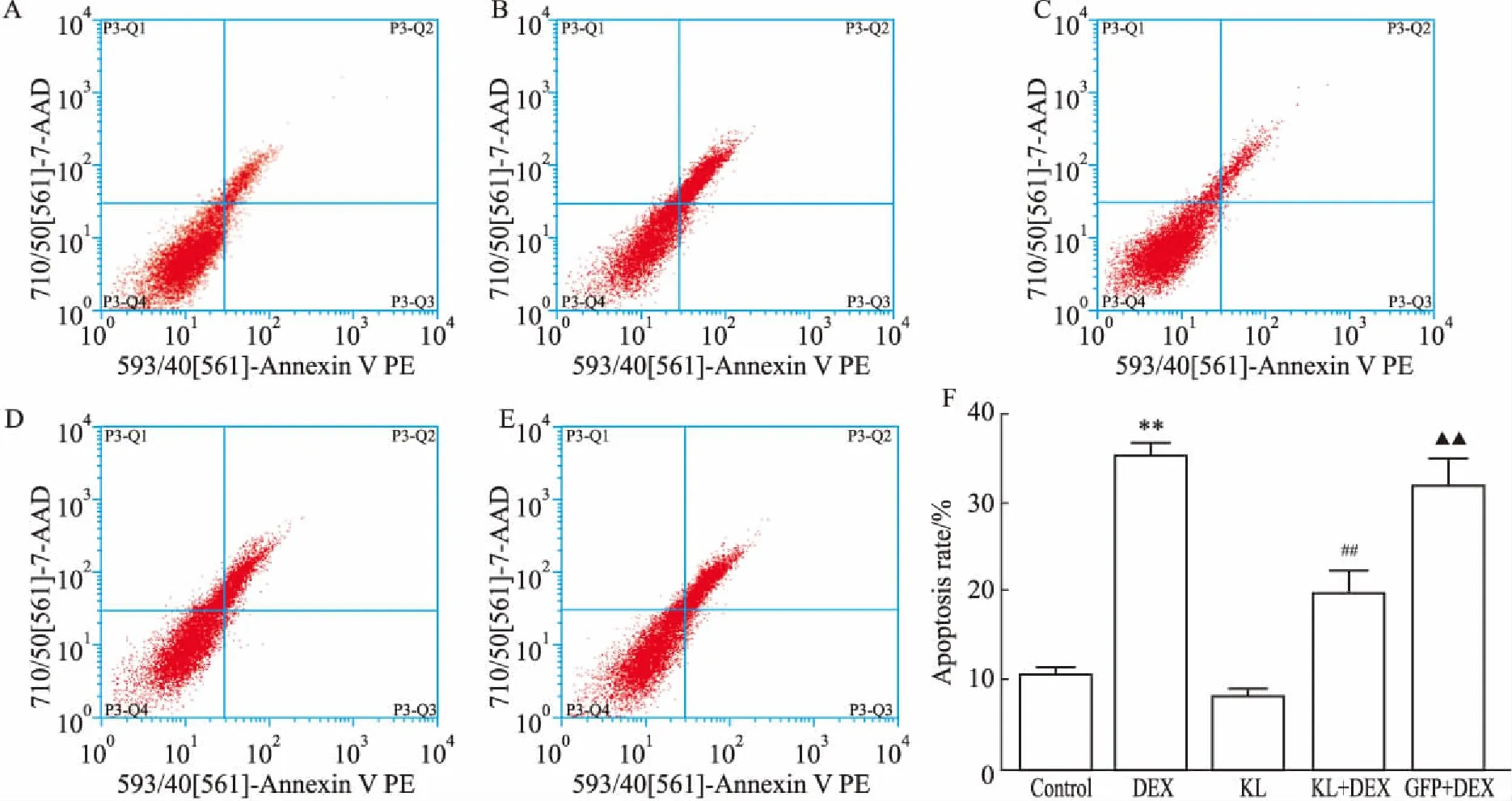
Fig 5 Apoptotic rate of MC3T3-E1 cells in different groups detected by flow cytometry
A: Control; B: DEX; C: KL; D: KL+DEX; E: GFP+DEX; F: Apoptosis rate.**P<0.01vscontrol;##P<0.01vsDEX;▲▲P<0.01vsKL+DEX

Fig 6 Expression of Bcl-2 and Bax mRNA(A) and protein(B) detected by qPCR and Western blot
**P<0.01vscontrol;##P<0.01vsDEX;▲▲P<0.01vsKL+DEX
2.7各组细胞内促凋亡蛋白caspase-9的荧光表达情况各研究组细胞采用免疫荧光法处理后,倒置荧光显微镜下观察促凋亡蛋白caspase-9在细胞内的荧光表达情况。Fig 7结果显示,成骨细胞质中充满红色荧光,提示蛋白表达于胞质内。与Control组相比,DEX组成骨细胞促凋亡蛋白caspase-9荧光表达强度明显增强(P<0.01),而KL组成骨细胞促凋亡蛋白caspase-9荧光表达强度较Control组降低,但差异无显著性;与DEX组对比,KL+DEX组成骨细胞caspase-9荧光表达强度显著性降低(P<0.01);相比于GFP+DEX组,KL+DEX组成骨细胞caspase-9荧光表达强度也显著性降低(P<0.01),而DEX组成骨细胞caspase-9荧光表达强度并无差异。
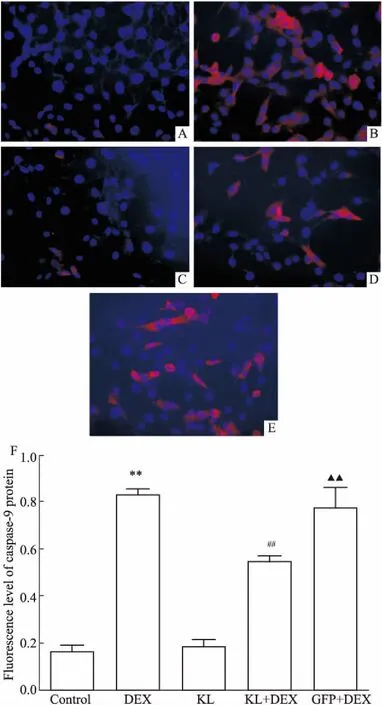
Fig 7 Caspasee-9 protein expression detected using immunofluorescence(×200)
A: Control; B: DEX; C:KL; D:KL+DEX; E:GFP+DEX; F:Fluorescence level of caspase-9 protein.**P<0.01vscontrol;##P<0.01vsDEX;▲▲P<0.01vsKL+DEX
3 讨论
近年来,糖皮质激素诱导性骨质疏松作为使用糖皮质激素所带来的最严重的副反应之一,已引起临床研究者的高度重视。研究表明,致使糖皮质激素诱导性骨质疏松发生的分子生物学机制主要包括:① 通过增强caspase家族成员的促凋亡活性,促进成骨细胞和骨细胞的凋亡,致使骨强度和骨质量减低[3];② 通过影响Wnt信号通路[9]、减少骨形成蛋白的表达[10]等途径,抑制成骨细胞分化并促进其凋亡,从而降低骨质量;③ 通过减少破骨细胞自身凋亡,最终致使骨质量减少[11]。研究表明糖皮质激素对破骨细胞的影响,其机制可能与其延长破骨细胞寿命的同时还降低了其细胞活性,进而影响骨的重吸收过程有关。除此之外,糖皮质激素还参与钙在小肠和肾小管内的重吸收过程的调节,进而对骨代谢过程形成干扰[3]。
KL基因作为衰老抑制基因,自1997年Kuro-o等研究发现以来,已得到广泛关注并进行了深入研究。研究发现KL基因其主要表达在肾脏、血液、脑脊液等组织器官内,其通过跨膜蛋白和分泌蛋白两种形式发挥其生物学作用[5]。KL除其抗衰老外,还抑制氧化应激、Wnt信号通路和insulin/IGF-1信号通路,促使FoxO转录因子激活,诱导血管生成,以及通过调节骨矿物质来干扰钙磷代谢过程[12],提示KL与骨质疏松的发生、发展紧密相关。
研究表明,长期使用糖皮质激素是医源性骨质疏松最常见的病因,与其相关性骨折发生率也相应增加了30%-50%[13]。流行病学证据表明,KL基因多态性与骨钙素、骨矿物质密度、骨质疏松等紧密相关。KL表达的蛋白主要以分泌型蛋白和跨膜蛋白两种形式存在,其中分泌型蛋白作为一种激素,主要通过血液、组织液作用于组织器官;而KL表达的跨膜蛋白被证实为内源性成纤维细胞生长因子23(fibroblast growth factor 23, FGF23)发挥功能的重要媒介,与成纤维细胞生长因子受体(fibroblast growth factor receptor, FGFR)结合,共同调节FGF23信号通路,进而发挥骨代谢调节效应[14]。鉴于糖皮质激素诱导性骨质疏松已引起临床医疗工作者的高度重视,而KL基因表达调节与骨质疏松发生、发展紧密相关,因而探讨KL基因表达调节在糖皮质激素诱导性骨质疏松中的作用具有十分重要的临床价值。
凋亡是细胞在炎症和损伤性环境中,细胞内组件发生分解的程序性死亡过程。抗凋亡蛋白Bcl-2通过与促凋亡蛋白Bax结合,阻断其分子同源二聚化过程来发挥抗凋亡效应。与之相反,Bax同源二聚化后,诱导线粒体释放细胞色素C,随后活化促凋亡蛋白caspase家族成员蛋白酶,从而启动细胞凋亡程序[3]。研究证实,caspase家族成员中,caspase-3、6、7、8、9参与调控哺乳动物内细胞程序性死亡过程,其中由caspase-8、9启动凋亡程序,caspase-3、6、7执行凋亡过程[15]。
本实验研究发现,DEX组相比于Control组成骨细胞存活率明显降低,而凋亡率明显增加;KL+DEX组相比于DEX组存活率明显增加,而凋亡率明显降低;此外,相比于GFP+DEX组,KL+DEX组存活率也增加,其细胞凋亡率也明显降低;提示KL基因转染发挥了抗DEX诱导成骨细胞凋亡的效应。进一步研究发现,KL+DEX组其成骨细胞内抗凋亡蛋白Bcl-2 mRNA和蛋白表达较DEX组明显增加,而促凋亡蛋白Bax的mRNA和蛋白表达较DEX组明显降低,同时还发现KL+DEX组其成骨细胞内促凋亡蛋白caspase-9也较DEX组明显降低,提示KL基因表达上调可能增加抗凋亡蛋白Bcl-2的表达或促进其生物学功能,其抗凋亡效应可能通过影响Bcl-2与Bax的结合过程实现;也可能抑制促凋亡蛋白Bax的表达,或者直接通过影响Bax的同源二聚化过程或下调Bax的活性,从而减少下游caspase-9等凋亡启动蛋白的活化来发挥其抗凋亡效应。另外,KL也可能直接通过减少促凋亡蛋白caspase-9的表达,抑制其启动凋亡程序,最终产生抑制细胞凋亡的作用,然而KL具体通过何种机制来调节Bcl-2、Bax、caspase-9的表达尚需要进一步研究。
综上,DEX可能通过减少抗凋亡蛋白Bcl-2、增加促凋亡蛋白Bax和caspase-9的表达,启动MC3T3-E1成骨细胞的凋亡程序,诱发细胞凋亡。本研究证实KL蛋白发挥了抵抗DEX诱导成骨细胞凋亡的效应,其机制可能是通过上调抗凋亡蛋白Bcl-2,与抑制促凋亡蛋白Bax、caspase-9表达而实现的,这为糖皮质激素性骨质疏松的研究、预防及治疗提供了一个新的参考方向。已有研究证实,DEX还通过影响Wnt通路而诱导成骨细胞凋亡[9],而KL参与调节Wnt信号通路[12],推测KL也可能通过调控Wnt信号通路来抑制DEX诱导成骨细胞凋亡过程,但其具体机制仍需进一步研究。
(致谢:本实验完成于重庆医科大学附属第一医院实验研究中心,感谢研究中心邓晓娟老师的悉心指导!)
参考文献:
[1]刘洋, 陈珺, 翟玉莹, 等. 阿魏酸钠治疗糖皮质性骨质疏松的实验研究[J]. 中国药理学通报, 2016,32(3):394-8.
[1]Liu Y, Chen J, Zhai Y Y, et al. Effect of sodium ferulate on glucocorticoid-induced osteoporosis[J].ChinPharmacolBull, 2016,32(3):394-8.
[2]Lin H, Gao X, Chen G, et al. Indole-3-carbinol as inhibitors of glucocorticoid-induced apoptosis inosteoblastic cells through blocking ROS-mediated Nrf2 pathway[J].BiochemBiophysResCommun, 2015,460(2):422-7.
[3]Liu Y, Porta A, Peng X, et al. Prevention of glucocorticoid-induced apoptosis in osteocytes and osteoblasts by calbindin-D28k[J].JBoneMinerRes, 2004,19(3):479-90.
[4]王艳娇, 马厚勋, 李宝善, 等. 腺相关病毒介导的Klotho基因表达对去势大鼠骨Runx2及MMP-13表达的影响[J]. 基础医学与临床, 2012,32(5):487-92.
[4]Wang Y J, Ma H X, Li B S, et al. Effects of adeno-associated virus-mediated klotho gene delivery on the expression of Runx2 and MMP-13 gene in the bone of the ovariectomy rats[J].BasicMedSciClin, 2012,32(5):487-92.
[5]Kuro-o M, Matsumura Y, Aizawa H, et al. Mutation of the mouse klotho gene leads to a syndrome resembling ageing[J].Nature, 1997,390(6655):45-51.
[6]杨秋晨, 马厚勋, 李运奎, 等. 体外转染Klotho基因对原代成骨细胞活性的影响[J]. 中国老年医学杂志, 2015,35(7):1866-9.
[6]Yang Q C, Ma H X, Li Y K, et al. The effect of Klotho gene transfection on the vitality of primary osteoblasts[J].ChinJGeriatr, 2015,35(7):1866-9.
[7]Chalhoub D, Marques E, Meirelles O, et al. Association of serum Klotho with Loss of bone mineral density and fracture risk in older adults[J].JAmGeriatrSoc, 2016,64(12):e304-8.
[8]吕峰, 王伟, 艾麦提·牙森, 等. MicroRNA-155在肝细胞癌对索拉非尼抗药中的作用研究[J]. 中国药理学通报, 2017,33(5):657-62.
[8]Lyu F, Wang W, Ai Mai Ti·Y S, et al. Effect of microRNA-155 on sorafenib resistance in hepatocellular carcinoma[J].ChinPharmacolBull, 2017,33(5):657-62.
[9]Yun S I, Yoon H Y, Jeong S Y, et al. Glucocorticoid induces apoptosis of osteoblast cells through the activation of glycogen synthase kinase 3beta[J].JBoneMinerMetab, 2009,27(2):140-8.
[10] Pereira R C, Delany A M, Canalis E. Effects of cortisol and bone morphogenetic protein-2 on stromal cell differentiation: correlation with CCAAT-enhancer binding protein expression[J].Bone, 2002,30(5):685-91.
[11] den Uyl D, Bultink I E, Lems W F. Glucocorticoid-induced osteoporosis[J].ClinExpRheumatol, 2011,29(5 Suppl 68):S93-8.
[12] Buendía P, Ramírez R, Aljama P, et al. Klotho prevents translocation of NF-κB[J].VitamHorm, 2016,101:119-50.
[13] Briot K, Roux C. Glucocorticoid-induced osteoporosis[J].RMDOpen, 2015,1(1):e000014.
[14] Zhang W, Xue D, Hu D, et al. Secreted klotho protein attenuates osteogenic differentiation of human bone marrow mesenchymal stem cellsinvitrovia inactivation of the FGFR1/ERK signaling pathway[J].GrowthFactors, 2015,33(5-6):356-65.
[15] McIlwain D R, Berger T, Mak T W. Caspase functions in cell death and disease[J].ColdSpringHarbPerspectBiol, 2013,5(4): a008656.
