佐剂性关节炎大鼠滑膜及血清中MANF的表达及其与炎症的相关性
2018-04-12马钰泱狄泽敏沈玉君沈玉先冯利杰
马钰泱,狄泽敏,曹 晴,沈玉君,沈玉先,冯利杰
( 安徽医科大学 1. 基础医学院,2. 生物药物研究所, 安徽 合肥 230032 )
类风湿性关节炎(rheumatoid arthritis, RA)是一种以关节病变为主的慢性全身性自身免疫性疾病。其病理特点为关节滑膜病变,包括滑膜细胞过度增生,淋巴细胞、浆细胞浸润,血管翳形成,关节骨和软骨破坏等,最终导致关节软骨基质和关节囊的破坏,关节强直畸形,失去原有的功能,严重影响了病人的生活质量[1-2]。RA发病机制复杂,迄今未有定论。深入探讨RA的发病机制,可为其临床诊断和治疗提供新思路和新靶标。内质网(endoplasmic reticulum, ER)应激是指在缺氧、氧化应激、钙平衡失调等情况下,ER内未折叠或错误折叠的蛋白明显增多,一旦超出ER的负荷能力,细胞会激活相关信号级联反应来恢复ER内正常的蛋白折叠环境[3-4]。已有研究报道,ER应激参与了RA的病理过程[5]。中脑星形胶质细胞源性神经营养因子(mesencephalic astrocyte- derived neurotrophic factor, MANF)基因是我们通过微阵列(microarray)技术,从30000个基因中筛选出的对ER应激最敏感的基因[6],其编码的MANF蛋白是一个分泌蛋白,ER应激可上调其表达和分泌[7]。为了了解MANF在RA中的表达情况,我们以佐剂性关节炎(adjuvant arthritis, AA)大鼠为疾病模型,检测致炎后不同时期大鼠关节滑膜中MANF和ER应激标志蛋白BiP和CHOP的表达,以及血清中MANF和急性期反应蛋白(C-reactive protein, CRP)、白细胞介素1β(interleukin-1 β, IL-1β)、肿瘤坏死因子α(tumor necrosis factor α, TNF-α)的水平;分析MANF表达与关节炎症状、CRP、IL-1β和TNF-α的相关性,探讨MANF在关节炎症中可能发挥的作用。
1 材料与方法
1.1 材料
1.1.1实验动物SPF级SD大鼠,♂,体质量(200±20)g,共50只,由安徽省实验动物中心提供。
1.1.2试剂弗氏完全佐剂(Freund complete adjuvant, FCA)购自Sigma公司;苏木精和伊红购自国药集团化学试剂有限公司;IL-1β、TNF-α的ELISA试剂盒购自武汉博士德公司;CRP的ELISA试剂盒购自R&D公司;MANF的ELISA试剂盒由本实验室制备[8];ECL显色试剂盒购自Pierce公司;MANF单克隆抗体由本实验室制备[9];兔抗BiP多克隆抗体购自Abcam公司;兔抗CHOP多克隆抗体购自Santa Cruz公司;HRP标记的GAPDH抗体购自上海康成生物工程有限公司。
1.1.3仪器YLS2TA足爪容积测量仪(山东省医学科学院设备站);Electron Px2型PCR仪(美国Thermo公司);JY92-ⅡD型超声波粉碎机(宁波海曙科生超声设备有限公司);凝胶成像系统(珠海Hema公司)。
1.2 方法
1.2.1大鼠AA模型的建立50只SD大鼠,随机分为正常组和模型组,其中正常组10只,模型组40只。常规消毒大鼠左后侧足趾,模型组大鼠左后足跖皮内注射1 g·L-1的FCA 0.1 mL致炎,正常对照组大鼠于相同部位注射等量生理盐水,此后每天观察大鼠的活动及关节肿胀情况。
1.2.2关节肿胀度测定致炎前(d 0)和致炎后d 7、14、21、28,用足爪容积测量仪测定大鼠右后侧(非致炎侧)足容积,求出关节肿胀度(△mL=致炎后容积-致炎前容积),以评价AA大鼠关节继发炎症变化。
1.2.3多发性关节炎指数(arthritis index, AI)评分采用AI评分评价关节炎病变的发展及严重程度。AI分为5分,0分:无红肿;1分:趾关节红肿;2分:趾关节和足跖肿胀;3分:踝关节以下的足爪肿胀;4分:包括踝关节在内的全部足爪肿胀。根据未注射佐剂的3个肢体的病变程度累计积分,计算出AI。
1.2.4HE染色大鼠造模3周后处死,取膝关节,用质量浓度40 g·L-1的多聚甲醛室温固定3 d,质量浓度100 g·L-1的EDTA室温脱钙4周,之后常规制备石蜡切片,切片厚度为5 μm。石蜡切片常规脱蜡至水,苏木精染色5 min,体积分数0.1的盐酸乙醇分色3 s,伊红染色5 min,常规脱水后二甲苯透明20 min,中性树胶封片。
1.2.5Western blot取正常以及致炎后d 2、7、14、21、28大鼠继发侧膝关节滑膜组织充分裂解,100℃变性10 min,SDS-PAGE电泳后湿转至PVDF膜, 用含0.5 g·L-1脱脂奶粉室温封闭30 min后,加入适当稀释度的一抗4℃孵育过夜,PBST洗10 min×3次后,加入适当稀释度的二抗室温孵育1 h,PBST洗10 min×3次后,ECL显影。
1.2.6逆转录PCR(reverse transcription PCR, RT-PCR)取正常和致炎后d 2、7、14、21、28大鼠继发侧膝关节滑膜组织,提取RNA后,逆转录为cDNA。 PCR扩增反应总体积20 μL,cDNA模板1 μL,引物(10 mol·L-1)1 μL,2×Premix Extaq 10 μL,去RNase无菌水8 μL,反应条件为95℃预变性5 min,94℃变性60 s,55℃(BiP、MANF、β-actin)或58℃(CHOP)退火60 s,72℃延伸60 s,扩增35个循环,72℃延伸10 min。BiP引物:上游5′-GGTATTG AAACTGTGGGAGG-3′,下游5′-TTGTCTTCAGCTGTCACTCG-3′;CHOP引物:上游5′-GGAGCTGGAAGCCTGGTATGA-3′,下游5′-TCCCTGGTCAGGCGC TCGATTT-3′;MANF引物:上游5′-TCCGCTACT GTAAGCAAGGT- 3′,下游5′-CT TCACCTAGGATCTTGGTG-3′;β-actin引物:上游5′-TCACCAACTGGGACGACAT-3′,下游5′-GCACAGCCTGGATAGCAAC-3′。
1.2.7ELISA检测取正常和致炎后d 2、7、14、21、28大鼠血清,分别采用MANF、CRP、IL-1β和TNF-α ELISA试剂盒,按说明书操作。用Curve Expert软件进行计算。
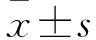
2 结果
2.1AA大鼠模型评价致炎后d 1注射足爪明显红肿,持续3 d后,逐渐减轻;致炎后d 12左右,非致炎右后足出现肿胀,开始主要表现在踝关节,逐渐累及整个脚趾,脚趾关节间及前足跖出现关节肿大,局部皮肤充血、红肿,d 21左右达到高峰,随后逐渐减轻。在致炎后d 7、14、21、28分别测量大鼠右后侧足容积。与正常对照组相比,致炎后d 14开始,AA大鼠的继发侧关节肿胀度明显增加,d 21左右达到高峰,随后稍有下降,一直持续到d 28(Tab 1);AI评分显示,致炎后d 14左右,AA大鼠开始出现全身症状,表现为未注射CFA的其余3个肢体关节红肿、变形,耳部及尾部结节,行走不便,消瘦等,AI评分明显升高,致炎后d 21 AI评分达到高峰并维持至d 28(Fig 1)。以上实验结果证明AA大鼠模型成功。

Fig 1 Change of arthritis index of AA rats (±s, n=6)
*P<0.05,**P<0.01vsd 7

Tab 1 The paw swelling in secondaryinflammation of AA rats (±s, n=6)
**P<0.01vsnormal group
2.2AA大鼠膝关节病理改变HE染色结果显示,正常对照大鼠膝关节关节囊的滑膜细胞仅有2~3层,排列规则,滑膜组织无血管增生和炎细胞浸润(Fig 2A);AA大鼠膝关节滑膜衬里层增厚,滑膜组织呈绒毛状或指状肥大,伸入到关节腔内,滑膜组织内可见大量炎细胞浸润,血管壁及其周围区域炎细胞浸润尤为明显。新生血管形成,关节软骨表面可见剥脱、缺损(Fig 2B)。
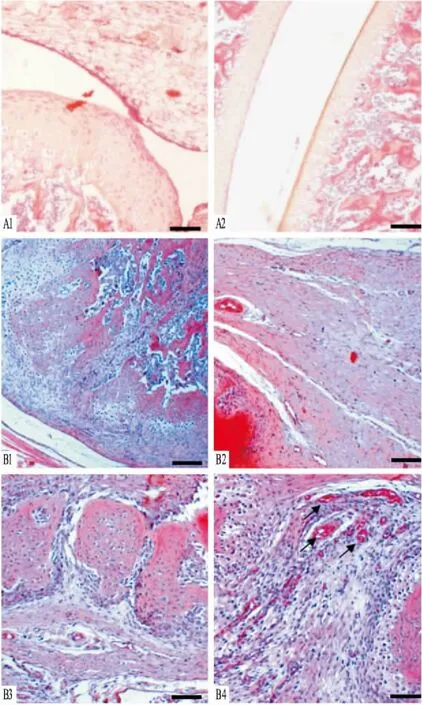
Fig 2 Histopathology of knee joint in normal and AA rats (scale bar=100 μm)
A: In normal control rats, synoviocytes were monolayer (A1) and articular cartilages were normal (A2); B: 21 days after FCA injection, synoviocytes proliferated three to six layers, inflammatory cells infiltrated into synovium, and pannus was formed (B1, B2), destruction of articular cartilages (B1, B3) and extensive newborn vessels (B4) were present in the hyperplastic synovium of the AA knee (arrows).
2.3AA大鼠炎症不同时期滑膜组织MANF、BiP和CHOP的表达取正常和致炎后d 2、7、14、21、28大鼠继发侧膝关节滑膜组织,分别提取RNA和蛋白,采用RT-PCR和Western blot检测MANF、BiP、CHOP的mRNA和蛋白水平。结果显示,MANF蛋白水平在致炎后d 2~7缓慢升高,d 14左右达到峰值,随后缓慢下降,d 28仍高于正常水平;ER应激蛋白BiP在致炎后d 2明显上调,随后略有下降,但仍维持较高水平;而CHOP则一直维持在低水平缓慢上升的状态(Fig 3B);RT-PCR结果也显示,相似的表达趋势(Fig 3A),提示关节炎症能诱导ER应激和MANF表达。
2.4AA大鼠血清中MANF水平及其与关节炎严重程度的相关性分析收集正常和致炎后d 2、7、14、21、28大鼠血清,ELISA检测MANF水平。结果显示,与正常组相比,致炎后d 2血清中MANF水平开始明显升高,d 14达到峰值,d 21开始下降,d 28仍高于正常水平(Tab 2)。为了进一步研究血清中MANF水平与关节炎严重程度的相关性,我们将致炎后不同时期血清中MANF水平与关节肿胀度和AI评分进行了相关性分析,结果发现,在继发性反应期,AA大鼠血清中MANF水平与二者均存在负相关,与关节肿胀度的相关系数为0.939 4,与AI评分的相关系数为0.954 1(Fig 4)。

Tab 2 Levels of MANF, CRP, IL-1β and TNF-α in bloodserum of AA rats at different phases (±s, n=6)
*P<0.05,**P<0.01vsd 0
2.5AA大鼠血清中MANF水平与CRP的相关性分析ELISA检测正常和致炎d 2、7、14、21、28大鼠血清CRP的水平(Tab 2),结果显示,与MANF相似的变化趋势;相关性分析发现MANF和CRP有着明显的相关性,相关系数r=0.943 3(Fig 4)。
2.6AA大鼠血清中MANF水平与IL-1β、TNF-α的相关性分析为了进一步研究血清中MANF水平与炎症因子的关系,我们检测了致炎不同时期血清中IL-1β和TNF-α的水平。ELISA结果显示,IL-1β在致炎后d 21明显增高,TNF-α在致炎d 2明显增高,到d 21~28趋于平缓(Tab 2、Fig 4)。相关性分析结果显示,在继发性反应期,血清MANF水平与IL-1β和TNF-α呈负相关,相关系数分别为0.900 4和0.938 1(Fig 5)。
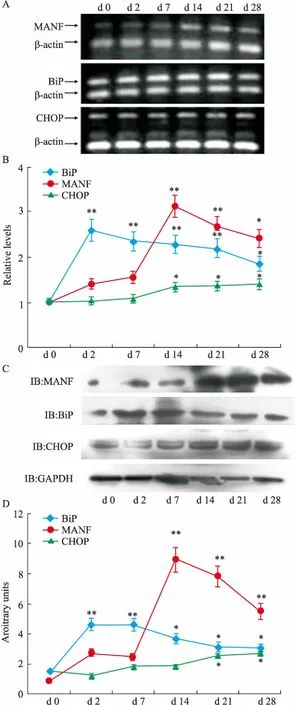
Fig 3 Expressions of MANF, BiP and CHOP in synovium during course of AA
A: The mRNA levels of MANF, BiP and CHOP in synovium; B: The quantitative data in A were normalized by β-actin; C: The protein levels of MANF, BiP and CHOP in synovium; D: The quantitative data in C were normalized by GAPDH. Error bars represent data from three independent experiments.*P<0.05,**P<0.01vsd 0.
3 讨论
AA模型一般分为两个时相,即原发性反应期和继发性反应期。原发病变属急性炎症反应,表现为致炎侧的关节、足跖红肿,致敏后即可出现,18~24 h达峰值,持续3~5 d后逐渐减轻;而继发性反应则是机体免疫功能紊乱所造成的免疫性炎症表现,表现为造模后10 d左右再度出现的致炎侧、非致炎侧及双前肢的关节和足趾肿胀,耳、尾关节炎结节,以及体重下降等全身变化;与人类RA近似。RA的发病机制十分复杂,至今尚未明确。已有研究发现,RA滑膜细胞核内有ER定位的转录因子ATF6的激活[10]。ER应激标志蛋白BiP在RA滑膜组织中高表达,80% RA患者血清中存在抗BiP抗体[11]。外源性的重组人BiP能促进外周血单核细胞中抗炎因子IL-10的表达,抑制TNF-α表达,从而抑制炎症。我们前期研究也发现,BiP在兔免疫性关节炎滑膜组织中表达上调[12]。本研究中我们进一步观察了BiP在AA大鼠不同阶段的表达情况,结果发现BiP在AA大鼠急性炎症期(d 2)表达明显升高,此后一直维持较高的水平。根据以往文献报道,我们推断BiP可能具有抑制炎症的作用,那么如何解释在BiP表达上调以及ER应激激活的情况下,炎性滑膜细胞仍然处于高度增殖的状态?我们推测,RA中是否还存在其他调控细胞增殖与凋亡平衡的因素存在,从而影响滑膜细胞的功能。因此,我们检测了CHOP表达。CHOP属于C/EBP转录因子家族的凋亡前因子,在ER应激诱导细胞凋亡中起着主导作用,也是公认的ER应激标志蛋白。本研究发现,AA进程中CHOP水平一直维持在缓慢上升的状态。CHOP在AA中持续低水平状态也进一步证明了滑膜细胞的异常增殖可能与ER应激状态下增殖与凋亡失衡有关。

Fig 4 Correlation between serum MANF level with arthritis symptoms and CRP level in AA rats
A: Correlation analysis of serum MANF level with swell of hind paw in the secondary inflammatory period of AA rats; B: Correlation analysis between serum MANF level with arthritis index in the secondary inflammatory period; C: Correlation analysis between MANF with CRP levels in serum in the secondary inflammatory period of AA rats.
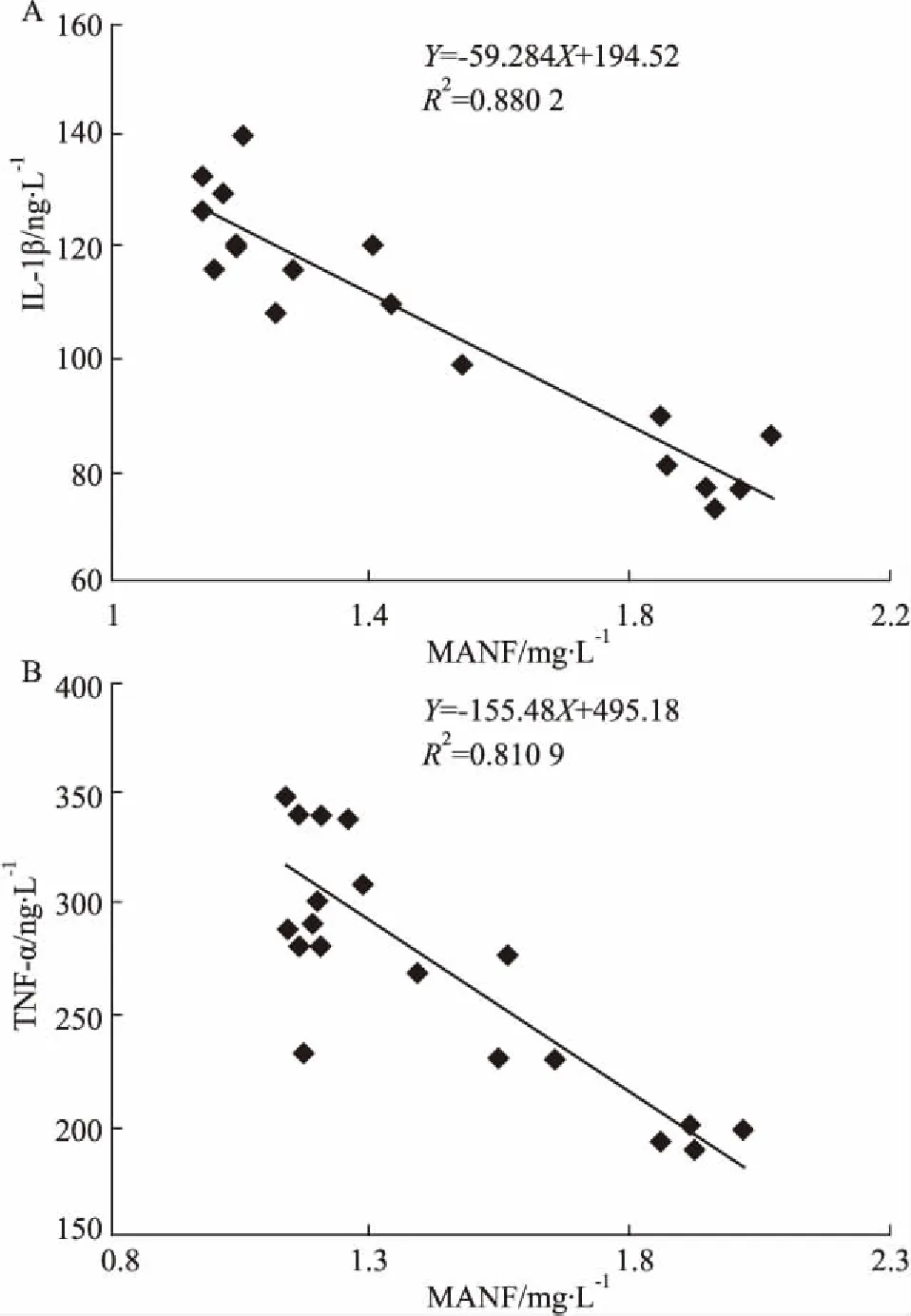
Fig 5 Relationship between MANF levels and IL-1β(A) or TNF-α(B) in serum of AA rats
MANF基因是我们从30 000个基因中筛选出的对ER应激最敏感的基因,在ER应激时其mRNA水平被上调8倍以上[6],我们推测MANF作为ER应激敏感基因,可能参与了关节炎症诱导ER应激的过程。本研究发现,正常滑膜组织中MANF仅有少量表达,可能用于维持正常滑膜功能,而致炎后d 2 MANF表达略有升高,到d 14左右MANF表达明显升高,随后逐渐下降,因此,我们认为MANF参与了AA炎症反应的全过程,且其对继发性炎症刺激的敏感程度高于BiP和CHOP。
MANF是一个分泌蛋白,ER应激能上调其表达和分泌。那么关节炎症能否诱导MANF分泌增加?我们发现,与正常大鼠相比,AA大鼠血清中MANF水平明显升高,在继发性反应初期达到峰值,随后有下降趋势,直到炎症消退时,其水平仍高于正常水平,提示AA炎症能诱导MANF分泌,并且MANF对继发性炎症刺激较为敏感。CRP是RA临床实验室检查的重要项目,CRP与RA的活动程度、骨质破坏程度及受累关节数相关,在RA活动期,CRP明显升高,与血沉(erythrocyte sedimentation rate, ESR)升高相平行,但比ESR升高出现的早,消失的也快,是反映炎症活动程度和治疗效果的良好指标[13]。我们的结果显示,AA大鼠血清CRP水平与MANF的升高水平呈正相关,因此,血清中MANF水平也可考虑作为RA临床早期诊断和评价疾病活动性的新指标。
本研究还进一步分析了AA大鼠外周血中MANF水平与继发性反应期足爪肿胀度、AI评分及血清中炎症因子TNF-α、IL-1β之间的相关性。结果发现在继发性反应期,外周血MANF水平与AA症状、TNF-α和IL-1β之间存在负相关。目前已有报道MANF能通过抑制NF-κB活性、调控p38 MAPK通路,抑制炎症[14-15],因此,AA中MANF的表达和分泌可能与继发性炎症进展密切相关。
综上所述,AA炎症伴随着ER应激,而MANF作为ER应激敏感蛋白,在AA中表达上调,尤其是在继发性反应初期;同时AA能诱导MANF分泌增加,血清MANF水平可考虑作为临床早期诊断和评价疾病活动性的新指标。通过MANF水平与关节继发性炎症及血清中炎症因子TNF-α、IL-1β之间的相关性分析,我们推测MANF的表达与RA的发生、发展有着密切关系,但其作用机制有待进一步研究。
(致谢:本文实验内容在安徽医科大学科教大楼生物药物研究所完成,感谢实验室老师与同学的帮助。)
参考文献:
[1]McInnes I B, Schett G. The pathogenesis of rheumatoid arthritis [J].NEnglJMed, 2011365(23): 2205-19.
[2]宋珊珊, 张玲玲, 魏伟. 实验性关节炎动物模型建立及病理机制研究进展[J]. 中国药理学通报,2011,27(12): 1648-53.
[2]Song S S, Zhang L L, Wei W. Progress in animal models and their pathogenesis of experimental arthritis [J].ChinPharmacolBull, 2011,27(12): 1648-53.
[3]冯利杰, 沈玉先, 李 俊. 内质网应激与炎症[J]. 中国药理学通报, 2013,29(6):756-60.
[3]Feng L J, Shen Y X, Li J. Endoplasmic reticulum stress and inflammation[J].ChinPharmacolBull, 2013,29(6):756-60.
[4]Hetz C, Mollereau B. Disturbance of endoplasmic reticulum proteostasis in neurodegenerative diseases [J].NatRevNeurosci,2014,15(4): 233-49.
[5]Yoo S A, You S, Yoon H J, et al. A novel pathogenic role of the ER chaperone GRP78/BiP in rheumatoid arthritis [J].JExpMed, 2012,209(4): 871-86.
[6]Apostolou A, Shen Y, Liang Y, et al. Armet, a UPR-upregulated protein, inhibits cell proliferation and ER stress-induced cell death [J].ExpCellRes, 2008,314(13): 2454-67.
[7]Tadimalla A, Belmont P J, Goodman S, et al. Mesencephalic astrocyte-derived neurotrophic factor is an ischemia-inducible secreted endoplasmic reticulum stress response protein in the heart [J].CircRes, 2008,103(11): 1249-58.
[8]王法财.抗人ARMET单克隆抗体的制备及ELISA检测方法的建立[D]. 合肥:安徽医科大学,2010.
[8]Wang F C. Preparation of anti-human ARMET monoclonal antibody and establishment of ELISA assay [D]. Hefei: Anhui Medical University, 2010.
[9]Yu Y Q, Liu L C, Wang F C, et al. Induction profile of MANF/ARMET by cerebral ischemia and its implication for neuron protection [J].JCerebBloodFlowMetab, 2010,30(1): 79-91.
[10] Amano T, Yamasaki S, Yagishita N, et al. Synoviolin/Hrd1, an E3 ubiquitin ligase, as a novel pathogenic factor for arthropathy [J].GenesDev, 2003,17(19):2436-49.
[11] Blass S, Union A, Raymackers J, et al. The stress protein BiP is overexpressed and is a major B and T cell target in rheumatoid arthritis [J].ArthritisRheum, 2001,44(4):761-71.
[12] Feng L, Jiang T, Zhou C, et al. Activated macrophage-like synoviocytes are resistant to endoplasmic reticulum stress-induced apoptosis in antigen-induced arthritis [J].InflammRes,2014,63(5): 335-46.
[13] Rossi J F, Lu Z Y, Jourdan M, et al. Interleukin-6 as a therapeutic target [J].ClinCancerRes, 2015,21(6): 1248-57.
[14] Chen L, Feng L, Wang X, et al. Mesencephalic astrocyte-derived neurotrophic factor is involved in inflammation by negatively regulating the NF-κB pathway [J].SciRep, 2015,5: 8133.
[15] Zhu W, Li J, Liu Y, et al. Mesencephalic astrocyte-derived neurotrophic factor attenuates inflammatory responses in lipopolysaccharide-induced neural stem cells by regulating NF-κB and phosphorylation of p38-MAPKs pathways [J].ImmunopharmacolImmunotoxicol, 201638(3): 205-13.
