竹节参总皂苷通过抑制NF-κB介导的炎性反应改善小鼠肿瘤恶病质研究
2018-04-12周志勇陈亚昕李德鸿宋亚男张长城
周志勇,陈亚昕,李德鸿,宋亚男,张长城,袁 丁
(1. 三峡大学医学院,湖北 宜昌 443002;2. 三峡大学仁和医院药剂科,湖北 宜昌 443000)
恶病质是一种复杂的代谢综合征,涉及到全身多个脏器和系统,常继发于肿瘤、心力衰竭、急性肾衰竭、慢性阻塞性肺病等疾病。恶病质的主要临床表征为短期内体质量急剧下降、骨骼肌和脂肪的流失,同时伴有厌食、乏力、贫血、衰竭等症状[1]。统计显示,高达一半的癌症患者死亡时伴有恶病质发生,且20%的患者直接死于恶病质[2]。恶病质不仅会影响手术、化疗和放疗的实施,同时会造成患者严重的营养不良,降低患者的生活质量。研究表明,恶病质的发生机制与代谢异常、促炎细胞因子、全身慢性炎症反应、氧化应激和神经肽等诸多因素有关。其中,免疫细胞和肿瘤细胞分泌的促炎细胞因子增多,引起机体慢性炎症反应进程,在肿瘤恶病质的发生机制中起着十分重要的作用[3]。如肿瘤坏死因子α(tumor necrosis factor α,TNF-α)通过成肌分化抗原(myogenic differentiation antigen,MyoD)或caspase途径抑制骨骼肌的分化,进而阻止骨骼肌的再生,而白细胞介素1β(interleukin 1β,IL-1β)可下调骨骼肌结构蛋白基因,调节凋亡相关基因表达[4]。其次,体外实验表明,TNF-α可能通过下调脂肪细胞中脂滴包被蛋白的表达,使脂肪失去保护,易在脂肪酶作用下溶解;同时抑制脂肪细胞分化,导致脂肪合成减少[5]。除此之外,有研究发现,在下丘脑的食物调节中枢中存在IL-1与TNF-α受体,他们能促进体内促肾上腺皮质激素释放激素(corticotropin releasing hormone,CRH)的表达,同时激活一些对葡萄糖敏感的神经元,引起机体厌食反应[6]。
竹节参(Panacis Japonici Rhizoma)系五加科人参属植物竹节参(PanaxjaponicusC. A. Mey.)的干燥呈竹鞭状根茎,是我国西南地区土家族、苗族民间常用中草药。研究表明,竹节参具有抗衰老、镇痛、免疫调节等药理活性,其主要活性组分为竹节参总皂苷(saponins fromPanaxjaponicus,SPJ)[7]。研究发现,SPJ具有良好的抗炎活性,能有效改善弗氏完全佐剂诱导的大鼠佐剂关节炎[8],明显抑制脂多糖(lipopolysaccharide,LPS)诱导RAW264.7细胞上清液中TNF-α和IL-1β含量的升高[9]。鉴于此,本课题拟探索SPJ对肿瘤恶病质的治疗作用,为进一步开发肿瘤恶病质的治疗药物提供实验基础。
1 材料
1.1实验动物SPF级BALB/c小鼠,♂,体质量(20±2)g,购自湖北省实验动物研究中心,动物质量合格证许可证号:SCXK(鄂)2008-0005),所有动物实验经三峡大学伦理委员会批准。
1.2细胞株小鼠结肠癌细胞株CT26由上海交通大学附属第六人民医院郭澄教授馈赠。
1.3药物与试剂竹节参购自湖北恩施州竹节参种植基地,经三峡大学药学系曾建红教授鉴定确认;蛋白预染marker、RIPA裂解液、BCA蛋白定量试剂盒购自北京普利莱基因技术有限公司;流式微球试剂盒、TNF-α及IL-1β抗体购自BD公司;NF-κB p65抗体购自CST公司;β-actin、肌肉环指蛋白1(muscle specific RING finger protein,MuRF1)、PAX7抗体购自Abcam公司。
1.4仪器PAC1000电泳仪(美国伯乐公司),ChemiQ4800化学发光成像系统(上海欧翔科学仪器有限公司),CKX41倒置荧光显微镜(日本奥林巴斯公司),FACSVerse流式细胞仪(美国BD公司),ALLEGRA 64R高速冷冻离心机(美国贝克曼公司)。
2 方法
2.1竹节参总皂苷的提取与制备取竹节参5 kg,碾碎后以水为提取溶剂提取4次,合并提取液,水浴蒸发浓缩。所得浓缩液用正丁醇萃取,减压回收正丁醇,得竹节参粗浸膏。将粗浸膏溶于水,过 D101大孔树脂,上样前依次用70%乙醇溶液-50%乙醇溶液(1.5 L)-30%乙醇溶液(1.5 L)-水冲洗树脂柱,进行预处理。上样后,用水洗脱至无色,弃去水洗脱液,以70%乙醇洗脱,收集70%乙醇洗脱液减压浓缩至浸膏,真空干燥,即得精制竹节参总皂苷供试品,香草醛-高氯酸紫外分光光度法测定竹节参总皂苷含量达86%。
2.2小鼠结肠癌肿瘤恶病质模型的建立按照文献报道方法建立小鼠肿瘤恶病质模型[18],具体方法如下:BALB/c小鼠32只,适应性喂养1周后,随机取24只小鼠前肢侧翼背部皮下注射0.2 mL(约1×106个)CT26细胞悬液,剩余的8只小鼠作为正常对照,接种4 d后,扪及小结节。每天定时监测各组小鼠的摄食量、精神状态、毛发及体质量。若荷瘤小鼠较对照小鼠出现活动减少、进食量下降、虚弱、精神不振等表现,即进入恶病质期。
2.3药物干预与标本采集接种4 d后,将接种小鼠随机分为模型组、竹节参总皂苷低、高剂量组,每组8只。正常组与模型组灌胃生理盐水10 mL·kg-1,竹节参总皂苷低、高剂量组分别灌胃竹节参总皂苷(20、60 mg·kg-1),每日给药1次,连续给药27 d。末次给药24 h后,小鼠眼球采血,分离血清,-80℃冻存,用于检测炎性因子。采血后颈椎脱臼处死小鼠,剥离皮下肿瘤称重,取脾脏、胫骨前肌、腓肠肌和附睾脂肪组织并称重,部分腓肠肌组织置于10%福尔马林溶液中固定,其余组织于-80℃冻存。
2.4观察指标
2.4.1小鼠一般状态观察每日定时观察小鼠毛发、精神状况以及体质量情况。
2.4.2腓肠肌纤维横切面积的检测将经福尔马林溶液固定的腓肠肌组织采用常规方法包埋成石蜡块,4 μm厚度连续横切片,常规HE染色后,光镜观察,采集图片。
2.4.3流式微球检测血清中TNF-ɑ与IL-1β水平微球法检测血清中炎性因子TNF-ɑ和IL-1β的水平,按试剂盒说明书操作:CBA分析试剂盒里的每一种捕获微球表面包被一种特异性抗体,检测试剂是PE标记的抗体混合物,其荧光强度与微球上捕获的细胞因子的量成正比。当捕获微球、检测抗体和待测样本共同孵育后,三者即形成双抗夹心复合物(捕获微球+分析物+检测抗体)。通过流式细胞仪分析捕获微球和微球上结合抗体的荧光强度,从而得到待测样本的数据,流式检测波长为488 nm,收集微球数1×104个。
2.4.4Western blot检测腓肠肌与胫骨前肌中NF-κB p65、PAX7与MuRF1蛋白表达水平提取各组小鼠腓肠肌总蛋白和核蛋白,BCA法测定蛋白浓度。蛋白样品经10% SDS-PAGE分离后,电转移至PVDF膜上,加入5%脱脂牛奶,于37℃封闭1.5 h,分别加入β-actin抗体(1 ∶10 000)、NF-κB p65抗体(1 ∶500)、MuRF1抗体(1 ∶1 000)、PAX7抗体(1 ∶500),4℃孵育过夜。次日以TBST 洗膜3次,再加入HRP标记的二抗(1 ∶10 000),37℃避光孵育1 h,TBST洗膜3次,ECL化学发光法显影。

3 结果
3.1小鼠一般情况及体质量变化荷瘤小鼠较正常组小鼠食欲明显下降,活动减少,皮毛颜色暗淡,精神萎靡。竹节参总皂苷干预后,低、高剂量组小鼠体质量与自发性活动均增加,且高剂量组变化更为明显。去瘤后体质量恶病质小鼠较正常组明显下降,且模型组下降最为明显(P<0.01),低、高剂量组小鼠体质量较模型组升高(P<0.05),见Fig 1。
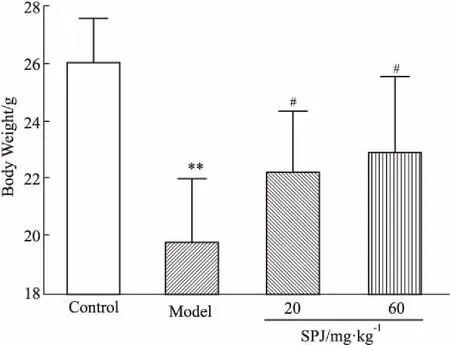
Fig 1 The body weight of mice after tumor removal(±s, n=8)
3.2腓肠肌、胫骨前肌、附睾脂肪与脾脏质量如Tab 1所示,与正常组相比,恶病质模型组小鼠腓肠肌和胫骨前肌质量明显降低(P<0.05)。竹节参总皂苷干预后,与模型组相比,高剂量组肌肉重量明显增加(P<0.05)。模型组小鼠附睾脂肪重量与正常组相比明显减少(P<0.05)。恶病质小鼠脾脏重量均明显增大(P<0.01),竹节参干预后,脾脏的肿大情况无明显改善。
3.3腓肠肌纤维横切面积如Fig 2所示,与正常组相比,恶病质小鼠腓肠肌纤维变细,肌肉束横切面积明显减小,且排列紊乱。竹节参总皂苷干预后,明显增加肌纤维横截面积,改善恶病质导致的肌肉降解,且呈剂量依赖性。
3.4血清中IL-1β与TNF-α含量如Fig 3所示,与正常组相比,肿瘤恶病质小鼠血清中IL-1β与TNF-α的含量均明显上升(P<0.05),竹节参总皂苷干预可明显改善恶病质导致的机体炎性反应。
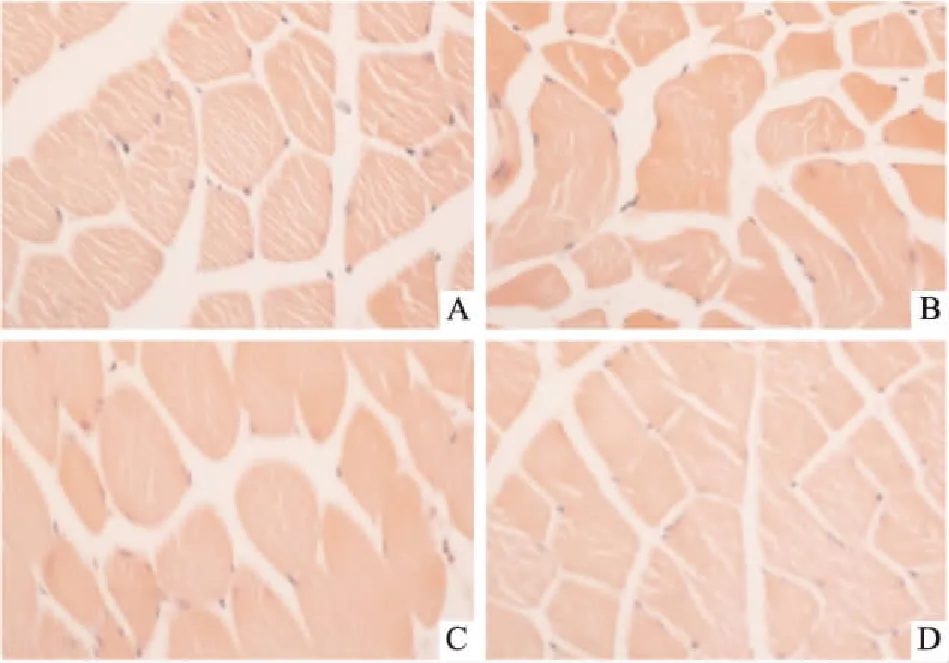
Fig 2 Effects of SPJ on cross-sectional area of gastrocnemius muscle fiber
A: Control; B: Model; C: 20 mg·kg-1SPJ; D: 60 mg·kg-1SPJ
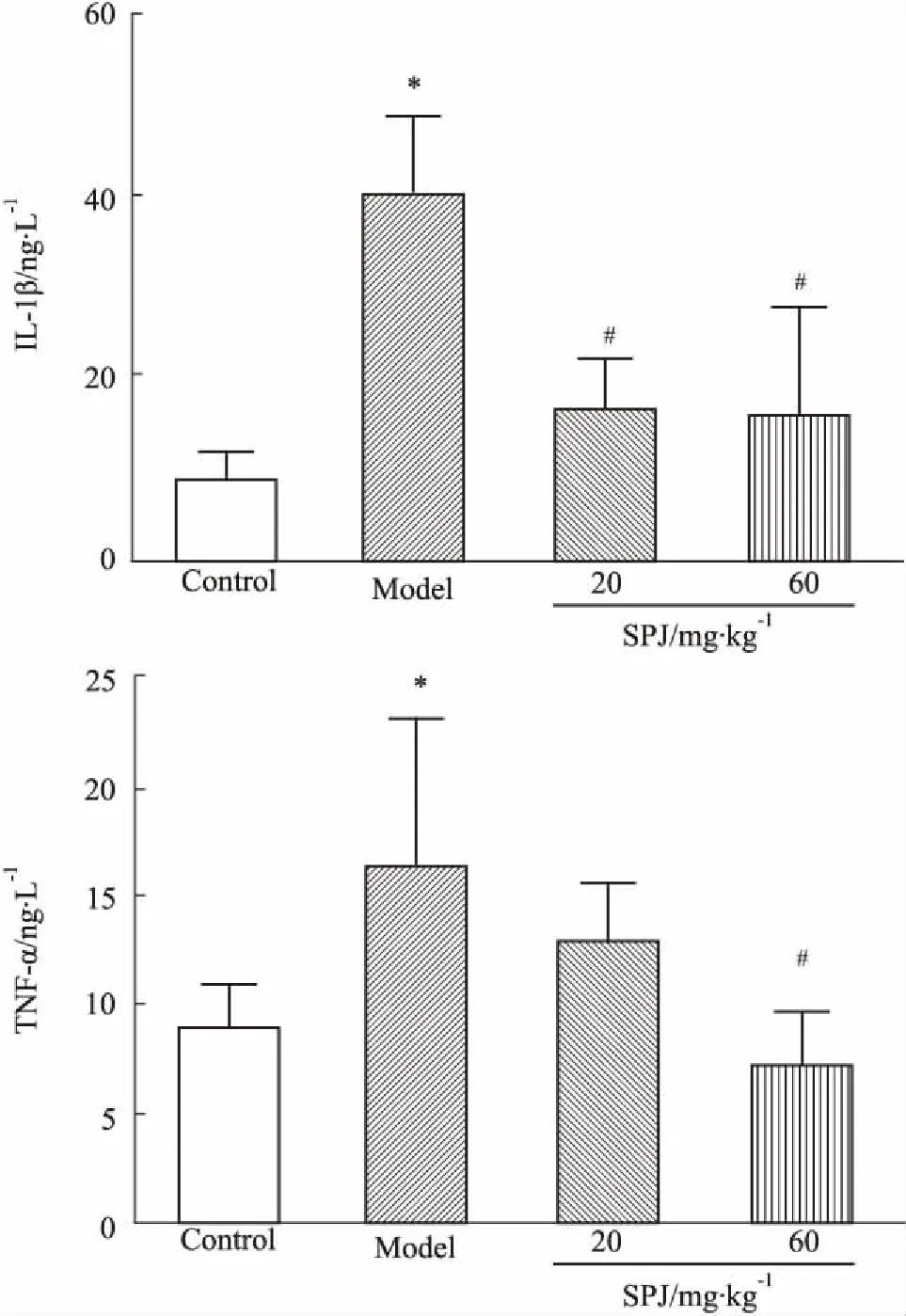
Fig 3 Effects of SPJ on IL-1β and TNF-α levels in serum of cachexia mice

*P<0.05 vs control; #P<0.05 vs model
3.5腓肠肌与胫骨前肌中NF-κB、PAX7与MuRF1的蛋白表达如Fig 4所示,与正常组相比,模型组腓肠肌中NF-κB p65与MuRF1的表达水平明显上升(P<0.05),而PAX7在腓肠肌中有所下降。竹节参总皂苷干预后,NF-κB与MuRF1的含量下降明显(P<0.05),但PAX7表达变化不明显。

Tab 1 Weight of gastrocnemius, anterior tibial muscle, epididymal fat and spleen in each group(±s,n=8)
*P<0.05,**P<0.01vscontrol;#P<0.05vsmodel

Fig 4 Effects of SPJ on protein expression of NF-κB, PAX7 and MuRF1 in gastrocnemius muscle(±s,n=4)
*P<0.05vscontrol;#P<0.05vsmodel
如Fig 5所示,与正常组相比,模型组胫骨前肌中NF-κB p65含量明显上升(P<0.05),MuRF1的表达有所升高,给予60 mg·kg-1竹节参总皂苷干预后,MuRF1表达明显降低(P<0.05),PAX7在胫骨前肌中的表达变化同样不明显。
4 讨论
恶病质是肿瘤常见的并发症,其发生与宿主体内各营养物质的代谢密切相关。肿瘤从人体固有的脂肪与蛋白质中夺取营养构建自身,形成以浪费型代谢为主的状态。本实验通过给小鼠皮下接种结肠腺癌CT26细胞建立恶病质模型,发现与正常小鼠相比,恶病质小鼠去瘤后体重、腓肠肌、胫骨前肌和附睾脂肪重量均明显下降,血清中TNF-ɑ和 IL-1β水平升高,同时伴随骨骼肌中MuRF1表达增加。作为泛素-蛋白酶体系统中的活性物质,MuRF1在蛋白质降解、肌肉萎缩中发挥着重要作用。以上系列指标变化说明恶病质小鼠体内骨骼肌与脂肪大量丢失,与临床恶病质的表现一致[10]。

Fig 5 Effects of SPJ on protein expression of NF-κB, PAX7 and MuRF1 in tibialis anterior muscle(±s, n=4)
*P<0.05vscontrol;#P<0.05vsmodel
目前,针对肿瘤恶病质的治疗着重于改善患者体质量下降,主要干预机制为刺激肿瘤患者食欲,改善机体营养,常用药物为醋酸甲地孕酮和甲羟孕酮等激素类似物[3,11];沙利度胺通过调节细胞因子的表达,降低瘦素对下丘脑的刺激,降低厌食性肽表达,改善肿瘤相关厌食症,对肿瘤恶病质的治疗有一定作用[12]。大量研究证实,炎性因子可通过多种途径诱导脂肪、肌肉的分解代谢,加速恶病质进程。相关研究显示,竹节参总皂苷具有良好的抗炎活性[8-9,13]。本实验用竹节参总皂苷干预CT26细胞诱导的恶病质小鼠,结果表明,竹节参总皂苷能明显增加恶病质小鼠体重,减少胫骨前肌、腓肠肌、脾脏和附睾脂肪的丢失,降低血清中TNF-α与IL-1炎性因子的表达,其中对TNF-α的作用呈剂量依赖性。作为体内多种进程调控的重要转录因子蛋白,NF-κB能调节TNF-α、IL-1等炎性因子的分泌,且当机体处于炎性环境时被大量激活。活化的NF-κB还能进一步激活泛素-蛋白酶体系统,启动转录因子FoxO,使MuRF1蛋白表达,引起肌肉蛋白的降解[14];同时抑制PAX7蛋白的表达,降低MyoD等肌肉分化生长因子mRNA水平,阻碍受损肌肉组织的修复[15]。本实验结果显示,竹节参总皂苷有效抑制肿瘤恶病质小鼠骨骼肌中NF-κB p65的表达。以上结果表明,竹节参总皂苷能有效改善荷瘤小鼠肿瘤恶病质状态,其机制可能与抑制NF-κB介导的炎性反应相关。
(致谢: 本实验完成于三峡大学医学院国家中医药管理局中药药理科研三级实验室。感谢三峡大学实验动物中心和肿瘤微环境与免疫治疗湖北省重点实验室对本课题提供的支持与帮助;感谢王俊涛、刘秀同学对实验动物的日常记录;感谢上海交通大学附属第六人民医院郭澄教授赠送CT26细胞株。)
参考文献:
[1]Ballyuzek M F, Mashkova M V, Stepanov B P. Cachexia as a complex metabolic syndrome and other causes of weight loss in elderly[J].AdvGerontol, 2015,28(2): 344-53.
[2]Von Haehling S, Anher S D. Cachexia as major underestimated unmet medical need: facts and numbers[J].IntJCardio1, 2012,161(3): 121-3.
[3]Tomoyoshi A, Krista P T, Ali Raza, et al. Cancer cachexia, mechanism and treatment[J].WorldJGastrointestOncol, 2015,7(4): 17-29.
[4]姜红, 饶丹, 郭和平, 等. 细胞因子IL-1β/IFN-γ对骨骼肌成肌细胞基因表达的影响[J]. 临床心血管病杂志, 2005,21(10): 605-7.
[4]Jiang H, Yao D, Guo H P, et al. Effects of cytokines IL-1β/ IFN-γ on rat skeletal myoblasts [J].JClinCardiol, 2005,21(10): 605-7.
[5]Rydén M, Arvidsson E, Blomgvist L, et al. Targets for TNF-alpha-induced lipolysis in human adipocytes[J].BiochemBiophysResCommun, 2004,318(1): 168-75.
[6]Scarlett J M, Jobst E E, Enriori P J, et al. Regulation of central mel-anocortin signaling by interleukin-1 beta[J].Endocrinology, 2007,148(9):4217-25.
[7]崔倩倩, 孙志伟, 刘朝奇, 等. 竹节参皂苷的免疫佐剂活性研究[J]. 时珍国医国药, 2014,25(10): 2324-6.
[7]Cui Q Q, Sun Z W, Liu C C, et al. Adjuvant study on saponins from Panax japonicus C. A. Meyer [J].LishizhenMedMaterMedRes, 2014,25(10): 2324-6.
[8]袁丁, 姚琦, 张长城.竹节参总皂苷对佐剂关节炎大鼠血清TNF-α和IL-1β表达的影响[J]. 山东医药, 2009,49(19): 4-6.
[8]Yuan D, Yao Q, Zhang C C. Effect of total saponins of Panax Japonicus on expression of serum TNF-α and IL-1β in rheumatoid arthritis rats [J].ShandongMedJ, 2009,49(19): 4-6.
[9]代艳文, 袁丁, 万静枝, 等.竹节参总皂苷通过NF-κB通路对LPS致RAW264.7细胞炎症的保护作用研究[J].中国中药杂志, 2014,39(11): 2076-80.
[9]Dai Y W, Yuan D, Wan J Z, et al. Study on protective effect of total saponins of Panax japonicus on LPS-induced RAW264.7 cell inflammation through NF-κB pathway [J].ChinaJChinMaterMed, 2014,39(11): 2076-80.
[10] 肖春红,徐迎新,张再重,等.癌性恶病质小鼠模型的建立及其自然发展过程研究[J].解放军医学院学报, 2016,37(11):1177-82.
[10] Xiao C H, Xu Y X, Zhang Z Z, et al. Establishment of animal model of cancer cachexia in mice and its natural development process [J].AcadJChinPLAMedSch, 2016,37(11):1177-82.
[11] Ruiz G V, López-Briz E, Carbonell S R, et al. Megestrol acetate for treatment of anorexia- cachexia syndrome[J].CochraneDatabaseSystRev, 2013,28(3):CD004310.
[12] Gordon J N, Goggin P M. Thalidomide and its derivatives: emerging from the wilderness[J].PostgradMedJ, 2003,79(929):127-32.
[13] 袁琴,袁丁,周志勇, 等.竹节参齐墩果烷皂苷对RAW264.7巨噬细胞SIRT1活性影响及抗炎作用研究[J].中国药理学通报, 2016,32(3): 349-54.
[13] Yuan Q, Yuan D, Zhou Z Y, et al. Anti-inflammatory effect of Chikusetsu oleanane saponin on RAW264. 7 cell through regulating SIRT1 activity [J].ChinPharmacolBull, 2016,32(3): 349-54.
[14] Ben-Nissan G, Sharon M. Regulating the 20s proteasome ubiquitin-independent degradation pathway[J].Biomolecules, 2014,4(3): 862-84.
[15] He W A, Berardi E, Cardillo V M, et al. NF-kappaB-mediated Pax7 dysregulation in the muscle microenvironment promotes cancer cachexia[J].JClinInvest, 2013,123(11): 4821-35.
