丹红注射液对高脂血症大鼠肝脏AMPK/SREBP-1/ACC通路的影响
2018-04-12汪胡风周惠芬万海同杨洁红
陈 娟, 汪胡风, 邓 军, 周惠芬, 万海同, 杨洁红
(1. 浙江中医药大学基础医学院, 浙江 杭州 310053; 2. 浙江省医学科学院安全性评价研究中心, 浙江 杭州 310013)
高脂血症是由于各种原因导致血浆中总胆固醇(total cholesterol, TC)、甘油三脂(triglyceride, TG)和(或)低密度脂蛋白胆固醇(low density lipoprotein- cholesterol, LDL-C)过高或高密度脂蛋白胆固醇(high density lipoprotein- cholesterol, HDL-C)过低的一种脂代谢异常性疾病,又被称为脂质异常血症[1]。世界卫生组织调查统计显示,高脂血症是心血管疾病发生的主要危险因素之一,而心血管疾病则是目前全球疾病的头号死因。
丹红注射液(Danhong injection, DHI)是由活血药对丹参、红花通过现代工艺精制而成的具有活血化瘀、通脉舒络功效的中药复方制剂[2]。其主要活性成分是丹参素、丹酚酸和原儿茶醛等,有抑制血小板聚集、抗炎症损伤、保护血管内皮、抗细胞凋亡等药理作用,临床上主要用于冠心病、心绞痛、脑梗死、血管性痴呆、糖尿病和高脂血症等的治疗[3]。腺苷酸活化蛋白激酶[adenosine 5’-monophosphate (AMP)-activated protein kinase, AMPK]是一种广泛存在的丝氨酸/苏氨酸激酶,胆固醇调节元件结合蛋白1(sterol regulatory element-binding transcription factor 1, SREBP-1)是脊椎动物细胞脂质稳态的调节物,而乙酰辅酶A羧化酶(acetyl CoA carboxylase, ACC)可以催化乙酰辅酶A生成丙二酸单酰辅酶A,是脂肪合成的限速酶[4],后两者均为前者的下游效应因子。大量研究表明,激活AMPK,抑制SREBP-1和ACC可以改善和治疗高脂血症[5-7]。
虽然DHI在降脂方面发挥着重要的作用,许多研究也证明了DHI对高脂血症具有非常明显的临床疗效[3],但目前国内外有关DHI如何调节高脂血症的机制研究,无论是在动物实验还是细胞实验方面都非常少。课题组通过前期研究发现[3],DHI可以影响高脂血症大鼠ACC、脂肪酸合成酶(fatty acid synthase, FAS)、肉碱脂酰转移酶I(carnitine palmitoyltransferase I, CPT-I)、过氧化物酶增殖物激活受体α(peroxisome proliferator-activated receptor alpha, PPAR-α)的mRNA表达水平,预实验发现SREBP-1的蛋白表达水平在药物干预组明显降低,推测DHI的调脂机制是通过干预AMPK-SREBP-1通路来影响下游脂质代谢相关酶来实现的。因此,该实验以高脂血症大鼠为模型,通过腹腔注射不同剂量的DHI来探究DHI通过AMPK/SREBP-1/ACC通路预防和治疗高脂血症的作用机制。
1 材料
1.1实验动物清洁级♂ SD大鼠48只,体质量(200±10)g,由浙江中医大学动物实验研究中心提供。实验所用的基础饲料由动物实验中心提供,购自上海斯莱克实验动物有限责任公司,合格证号:SCXK(沪)2008-0115,适应性喂养1周后开始实验。所有大鼠均根据实验动物饲养与使用指南喂养(NIH Publications, No.80-23, 1996年修订版),饲养条件:温度(23±1)℃,相对湿度(55±5)%,光暗各12 h,自由进食饮水[3-4]。
1.2药物与试剂高脂饲料(江苏省协同医药生物工程有限责任公司,配方为基础饲料68%、猪油10%、蛋黄粉10%、蔗糖10%、胆固醇2%);丹红注射液(菏泽步长制药有限公司,批号111050,规格10 mL);全蛋白提取试剂盒购自南京凯基生物科技发展有限公司;内参β-actin、ACC、p-ACC抗体购自美国Cell Signaling Technology公司;AMPK、p-AMPK、SREBP-1抗体购自英国Abcam公司;二抗购自美国LI-COR公司。
1.3仪器高速低温离心机(美国Thermo公司);Precellys 24多功能样品均质器(法国Bertin公司);垂直电泳转膜系统(美国Bio-Rad公司);Odyssey CLx红外成像系统(美国LI-COR公司)。
2 方法
2.1实验动物分组与给药选用清洁级♂ SD大鼠48只,参照邓祖跃等[8]的方法,制备高脂血症大鼠模型,实验开始前先用普通饲料进行1周的适应性喂养,之后随机选取12只为基础对照组,饲以普通饲料,其余饲以高脂饲料,每天12 h光照维持,昼夜循环,自由饮水进食。于第6周末夜间禁食12 h后,眼眶采血检测血脂水平,血脂含量升高并与基础对照组差异明显的大鼠作为成功的高脂模型纳入实验。选取成功的高脂模型大鼠,按血脂水平随机分为高脂对照组和腹腔注射DHI低、高剂量组(1.0、2.0 mL·kg-1·d-1),每组12只大鼠。两个对照组腹腔注射等体积生理盐水,每天注射1次,连续30 d。腹腔注射实验期间,除基础对照组外,其余各组大鼠均饲以高脂饲料,自由进食饮水[9]。
2.2样品采集丹红注射液腹腔注射30 d后,大鼠禁食12 h,腹主动脉取血,收集血液3 000×g离心15 min,分离血清,-20℃保存备用;取适量肝脏组织,液氮保存,立即存入。
2.3AMPK、p-AMPK、SREBP-1、ACC、p-ACC蛋白表达的测定各组取适量肝脏样本,加入含蛋白酶抑制剂的总蛋白抽提试剂,匀浆后抽提总蛋白。BCA法进行蛋白质定量。抽提好的蛋白样品进行SDS-PAGE电泳,电泳完成后将凝胶上蛋白质转移到PVDF膜上,30 mA恒流条件下,4℃过夜。转膜完成后的PVDF膜在含5 %脱脂奶粉的封闭液中,室温孵育1 h封闭,封闭后加抗体(一抗、二抗)孵育,孵育完成后在Odyssey CLx红外成像系统上扫膜,确定样品中AMPK、p-AMPK、SREBP-1、ACC、p-ACC表达的相对含量。

3 结果
3.1DHI对高脂血症大鼠肝脏AMPK和p-AMPK蛋白表达的影响如Fig 1所示,与对照组相比,高脂对照组中AMPK的蛋白表达水平明显升高(P<0.01);与高脂对照组相比,DHI低、高剂量组能明显降低肝脏AMPK的蛋白表达水平(P<0.01,P<0.05)。与对照组相比,DHI高剂量组能明显增高肝脏p-AMPK的蛋白表达水平(P<0.05),与高脂对照组相比,DHI高剂量组p-AMPK的蛋白表达水平增高,但差异无统计学意义(P>0.05)。
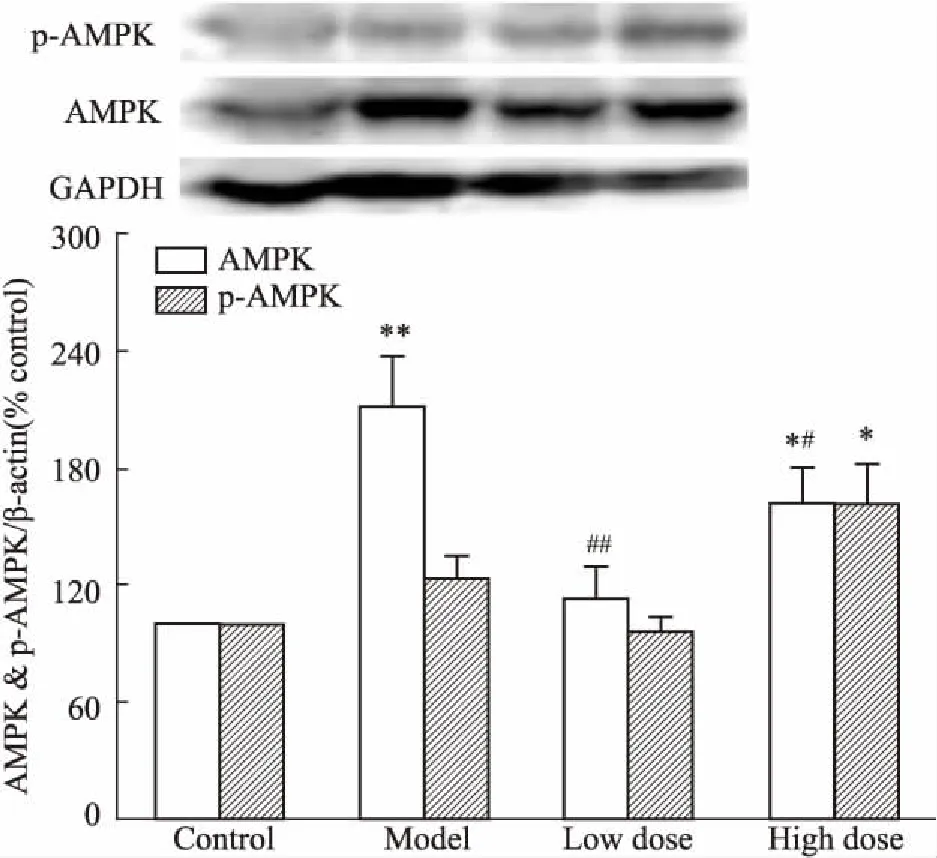
Fig 1 Relative expressions of AMPK and p-AMPK in rat liver of each group
*P<0.05,**P<0.01vsnormal control group;#P<0.05,##P<0.01vsmodel group
3.2DHI对高脂血症大鼠肝脏SREBP-1蛋白表达的影响如Fig 2所示,与对照组相比,高脂对照组中SREBP-1的蛋白表达无明显差异(P>0.05),DHI低、高剂量组SREBP-1表达明显下降(P<0.05);与高脂对照组相比,DHI高剂量组能明显降低肝脏SREBP-1蛋白的表达水平(P<0.05)。
3.3DHI对高脂血症大鼠肝脏ACC、p-ACC蛋白表达的影响如Fig 3所示,与对照组相比,DHI高剂量组ACC蛋白表达明显下降(P<0.05),高脂对照组中p-ACC的蛋白表达明显下降(P<0.01);与高脂对照组相比,DHI低剂量组能明显升高肝脏p-ACC蛋白的表达水平(P<0.05)。
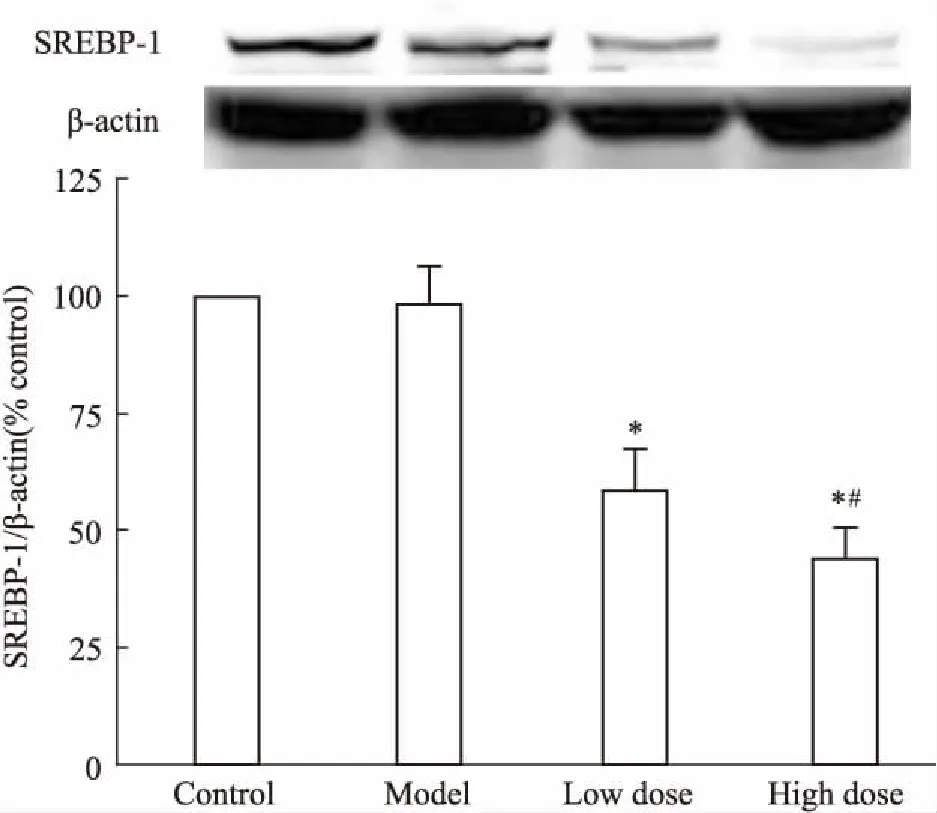
Fig 2 Relative expressions of SREBP-1 in rat liver of each group
*P<0.05vsnormal control group;#P<0.05vsmodel group.
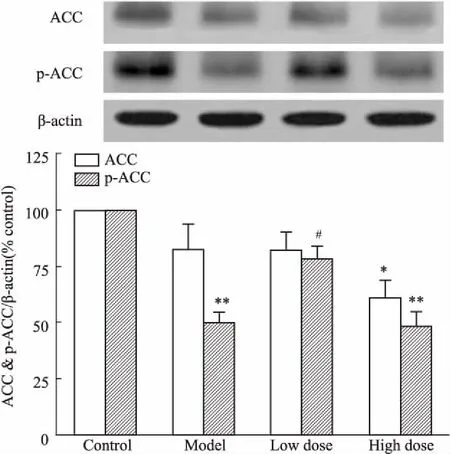
Fig 3 Relative expressions of ACC and p-ACC in rat liver of each group
*P<0.05,**P<0.01vsnormal control group;#P<0.05vsmodel group
4 讨论
本研究应用SD大鼠高脂血症模型评价了DHI的降脂活性,并探讨了其基于AMPK/SREBP-1/ACC通路的降脂作用机制。经过高脂饲料诱导后,SD大鼠的血清TC、TG、LDL-C的水平均明显升高,提示造模成功[3]。
AMPK是调节能量代谢的重要蛋白,其在脂肪酸代谢方面起到重要调节作用[10]。通过感受胞质内AMP 与ATP比值的变化,AMPK可以调节脂肪酸的氧化代谢,当AMP/ATP增高时,AMPK磷酸化为p-AMPK而激活[11]。在本实验中,与高脂对照组相比,DHI低、高剂量组能明显降低肝脏AMPK的蛋白表达水平(P<0.05);与对照组相比,DHI高剂量组能明显增高肝脏p-AMPK的蛋白表达水平(P<0.05),这可能是由于DHI促进AMPK磷酸化为p-AMPK,降低了AMPK的蛋白表达水平。研究表明,蛋白质的磷酸化调控蛋白质的降解[12]。而且在DHI的作用下,AMPK的下游因子SREBP-1和ACC活性的抑制也可以间接证明DHI通过AMPK蛋白调控了脂肪酸的代谢。
激活的AMPK可以使ACC磷酸化而失活[13]。ACC通过催化乙酰辅酶A生成丙二酸单酰辅酶A,在脂肪酸的代谢过程中发挥重要的作用,而抑制ACC活性可以抑制脂质的合成[14]。在本实验中,DHI明显升高了肝脏p-ACC蛋白的表达水平,表明DHI通过促进ACC磷酸化抑制ACC的活性,从而抑制脂质的合成。激活的AMPK同时通过磷酸化SREBP-1抑制其进入细胞核。SREBP-1是肝脏脂质代谢的关键调控因子,广泛参与机体脂质代谢,如甘油三酯、胆固醇和脂肪酸的合成或摄取等。在本实验中,与高脂对照组相比,DHI明显降低了高脂血症大鼠肝脏SREBP-1的表达水平,抑制了脂质的合成和摄取,从而减少脂肪的沉积。
另外,前期研究发现,当ACC的活性被抑制后,CPT-1的mRNA表达水平升高[3]。CPT-1在介导酰基进入线粒体的过程中发挥了重要的作用,是线粒体β氧化的关键酶,其表达水平的升高促进了脂肪酸分解,降低了机体的脂肪含量[15]。
综上所述,DHI能明显降低SD大鼠血脂水平。本实验通过Western blot检测结果分析发现,DHI可以激活AMPK/SREBP-1/ACC通路,即增强AMPK的活化,促进SREBP-1和ACC的磷酸化,抑制SREBP-1和ACC作用,减少脂质的合成和摄取,增加脂质分解,明显降低血脂水平,从而改善高脂血症。通过本研究与课题组前期研究结果[3]串联分析,推测激活AMPK/SREBP-1/ACC通路可能是DHI防治高脂血症的重要作用机制之一,根据相关结果绘制DHI干预AMPK/SREBP-1/ACC通路治疗高脂血症的作用机制图(Fig 4),阐释DHI降脂机制。
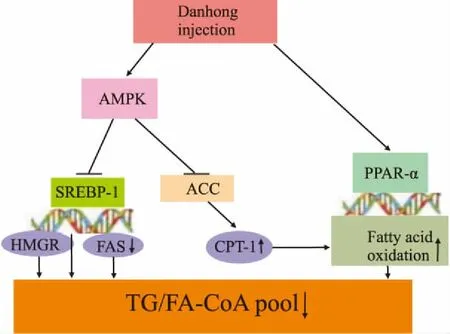
Fig 4 Lipid-lowering mechanism of DHI through AMPK/SREBP-1/ACC pathway
(致谢:本文实验在浙江中医药大学基础医学院、脑心同治研究院、动物实验研究中心及浙江省医学科学院安全性评价研究中心完成,在研究完成过程中得到了蔡月琴老师的悉心指导和热忱帮助,在此深表谢意!)
参考文献:
[1]陈华,陈淋,张男,等. 脂质组学在高脂血症的研究进展[J]. 药物分析杂志,2016,36(8):1324-9.
[1]Chen H, Chen L, Zhang N, et al. Research progress of lipidomics in hyperlipidemia[J].ChinJPharmaceutAnalys, 2016,36(8):1324-9.
[2]张倩, 戴国梁, 居文政, 等. 丹红注射液7种药效物质基础的人血浆蛋白结合率[J]. 中国药理学通报, 2017,33(5):712-8.
[2]Zang Q, Dai G L, Ju W Z, et al. Determination of binding rates of human plasma protein with seven bioactive components in Danhong injection[J].ChinPharmacolBull, 2017,33(5):712-8.
[3]Chen J, Deng J, Zhang Y Y, et al. Lipid-lowering effects of Danhong injection on hyperlipidemia rats[J].JEthnopharmacol, 2014,154(2):437-42.
[4]Ahn C W, Jun D S, Na J D, et al. Alleviation of hepatic fat accumulation by betaine involves reduction of homocysteine via up-regulation of betaine-homocysteine methyltransferase (BHMT) [J].BiochemBiophysResCommun, 2016,477(3):440-7.
[5]Zheng Z G, Zhou Y P, Zhang X, et al. Anhydroicaritin improvesdiet-induced obesity and hyperlipidemia andalleviates insulin resistance by suppressing SREBPs activation[J].BiochemPharmacol, 2016,122:42-61.
[6]Kim B L, Woo M J, Park C S, et al. Hovenia Dulcis extract reduces lipid accumulation in oleic acid-induced steatosis of HepG2 cells via activation of AMPK and PPARα/CPT-1 pathway and in acute hyperlipidemia mouse model[J].PhytotherRes, 2017,31(1):132-9.
[7]Ren T Y, Zhu Y P, Kan J Q, et al. Zanthoxylumalkylamides activate phosphorylated AMPK and ameliorate glycolipidmetabolism in the streptozotocin-induced diabetic rats[J].ClinExpHypertens, 2017,39(4):330-8.
[8]邓祖跃, 匡荣, 朱社敏, 等. 白藜芦醇对高脂血症大鼠多种抗氧化系统的影响[J]. 中国药理学通报, 2013,29(1):147-8.
[8]Deng Z Y, Kuang R, Zhu S M, et al. Effects of resveratrol on multiple anti-oxidant systems in hyperlipidemia rats [J].ChinPharmacolBull, 2013,29(1):147-8.
[9]陈娟, 邓军, 张宇燕, 等. 丹参素对高脂血症大鼠脂代谢调节机制研究[J]. 中国中药杂志, 2015,40(2):313-7.
[9]Chen J, Deng J, Zhang Y Y, et al. Study on regulatory effect of Danshensu on lipid metabolism of hyperlipidemia rats[J].ChnJChinMaterMed, 2015,40(2):313-7.
[10] 徐军, 王国恩, 章时杰, 等. 1,3,7,9-四甲基尿酸激活SirT3/AMPK/ACC信号通路减少高脂饮食小鼠肝脏脂肪化[J]. 中国药理学通报, 2014,30(6):791-6.
[10] Xu J, Wang G E, Zhang S J, et al. Human bone marrow-derived mesenchymal stem cells differentiate into retinal cells[J].ChinPharmacolBull, 2014,30(6):791-6.
[11] Zhang C S, Hawley S A , Zong Y, et al. Fructose-1,6-bisphosphate and aldolase mediate glucose sensing by AMPK[J].Nature, 2017,548(7665):112-34.
[12] 金佳丽. USP21调控小鼠胚胎干细胞自我更新及重编程的功能及其机制的研究[D]. 上海: 华东师范大学, 2017.
[12] Jin J L. The function and mechanism of USP21 regulate mouse embryonic stem cell self-renewal and reprogram[D]. Shanghai: East China Normal University, 2017.
[13] Liu H, Zhong H, Yin Y, et al. Genistein has beneficial effects on hepatic steatosis in high fat-high sucrose diet-treated rats[J].BiomedPharmacother, 2017,91:964-9.
[14] Wang J C, Xu R H, Wang R L, et al. Overexpression of ACC gene from oleaginous yeast Lipomyces starkeyi enhanced the lipid accumulation in Saccharomyces cerevisiae with increased levels of glycerol 3-phosphate substrates[J].BiosciBiotechnolBiochem, 2016,80(6):1214-22.
[15] Liu C X , Luo Z, Hu W, et al. Kinetics of carnitine palmitoyltransferase I (CPT I) in Chinese sucker (Myxocyprinus asiaticus) change with its development[J].Lipids, 2014,49(2):173-81.
