TGF-β/Smads信号通路在姜黄素改善糖尿病大鼠心肌纤维化中的作用
2018-04-12刘秀芬鲍翠玉
沈 豪,郭 霜,刘秀芬,鲍翠玉,徐 魁,
(湖北科技学院 1. 糖尿病心脑血管病变湖北省重点实验室、2. 临床医学院内科学教研室,湖北 咸宁 437100)
糖尿病心肌病(diabetic cardio myopathy,DCM)是在糖尿病情况下所导致的一种心脏并发症。其中心肌结构的异常变化主要表现在心肌肥大、凋亡和心肌间质纤维化,其中心肌间质纤维化是DCM主要的病理特征。研究表明,转化生长因子-β1(transforming growth factor-β1,TGF-β1)已被公认与器官纤维化密切相关的因子[1]。而Smads蛋白是细胞内TGF-β受体唯一的激酶底物,可介导下游细胞内信号传导[2],调控细胞外基质的相关基因合成和转录,参与了心脏、肾脏等重要器官的组织纤维化的形成。转化生长因子β Ⅲ型受体(type Ⅲ TGF-β receptor,TβR Ⅲ)是一种蛋白聚糖,一直以来被认为是TGF-β超家族的辅助受体,研究表明,其既可以参与调控经典的Smads信号通路,又可以调控其他信号通路,在纤维化、肿瘤、心血管系统等疾病中发挥重要作用,但其在糖尿病心肌纤维化中的研究甚少。姜黄素(curcumin,Cur)是从姜科植物根茎中提取的酚类姜黄色化合物。研究表明,Cur对2型糖尿病大鼠心肌病具有保护作用[3]。本研究通过建立体内体外糖尿病心肌纤维化模型,探究Cur对糖尿病心肌纤维化的保护作用及可能的作用机制。
1 材料与方法
1.1 材料
1.1.1实验动物♂ Sprague-Dawley大鼠购于华中科技大学同济医学院实验动物中心,动物准字号:SYXK(鄂)2013-0071,分笼饲养,自由进食和饮水。
1.1.2药品与试剂Cur、D-葡萄糖、TGF-β1抗体(Sigma公司);CCK-8试剂盒(日本同仁);天狼猩红染液、荧光二抗、一抗稀释液(武汉谷歌);DMEM培养基(Hyclone公司);胎牛血清(Gibco公司);Collagen Ⅰ、Collagen Ⅲ 抗体(Abcam公司);p-Smad2、Smad2、p-Smad3、Smad3、TβR-Ⅲ、β-actin抗体(CST公司)。
1.1.3仪器超净工作台(苏州安泰);CO2培养箱(Thermo);荧光显微镜(日本奥林巴斯);全波段多功能酶标仪(美国Bio-Tek公司);垂直电泳仪,电转移槽(美国Bio-Rad公司);自动发光凝胶成像系统(英国Syngene公司)。
1.1 方法
1.2.1糖尿病模型的制备Sprague Dawley大鼠,80只,♂,160~180 g,随机分为正常对照组(Con,10只)、正常+Cur组(Cur 300 mg·kg·d-1,10只)和模型组(DM,60只)。Con和Cur组喂以正常饲料,DM组给予4周高糖高脂饲料喂养后,经腹腔注射STZ(35 mg·kg-1,由pH 4.4的枸橼酸盐缓冲液配制)复制2型糖尿病模型,对照组给予等量的枸橼酸盐缓冲液。造模成功后(以随机血糖≥16.7 mol·L-1作为模型成功标准),DM组随机分为2组:DM组、DM+Cur组(DM+Cur 300 mg·kg·d-1)。其中,Cur由质量分数为1%的羧甲基纤维素钠配制。在实验过程中,大鼠自由进食饮水,不使用其他药物或胰岛素进行干预。给药16周后,检测相关指标。
1.2.2大鼠乳鼠心肌成纤维细胞(cardiac fibroblasts,CFs)原代提取培养新生Sprague Dawley大鼠(0~3 d),♀♂不拘,体积分数为0.75的乙醇消毒胸部后,迅速取出心脏,置于4℃ 预冷D-Hanks缓冲液中,剪成约1 mm3大小的组织碎块,洗去污血,弃去上清。将心肌组织转入安剖瓶中,加入5 mL 0.1%的Ⅱ型胶原酶,置于37℃水浴消化5~8 min,收集上清至含有10%胎牛血清的DMEM培养基(完全培养基)中终止消化,重复8~10次,直到心肌组织块消化完全。收集每次消化完全的细胞悬液,1 000 r·min-1离心10 min,弃上清,用完全培养基重悬细胞,接种于培养皿中,置于细胞培养箱中培养1~1.5 h后,弃上清,加入新鲜完全培养基于培养箱内常规培养。待长至80%~90%融合度时,消化转移至实验所需的培养皿中或者冻存,本实验中使用第2~4代CFs。
1.2.3天狼猩红染色各组心脏组织多聚甲醛固定以后,脱水,石蜡包埋,切片脱蜡至水,天狼猩红染液染色5 min,无水乙醇稍洗后沥干,脱水透明,中性黏合剂封片,于光镜和偏振光显微镜下观察。
1.2.4免疫荧光法石蜡包埋的心脏组织标本连续切片,切片厚度4 μm,65℃烘干60 min,脱蜡,将切片放入沸腾的0.01 mol·L-1枸橼酸钠缓冲溶液(pH 6.0)中加热5 min,停3 min,反复3次后自然冷却。PBS清洗,体积分数为0.03的过氧化氢避光浸泡25 min,PBS清洗, 5%的BSA封片30 min,PBS清洗,加入Collange Ⅰ和Collagen Ⅲ 抗体(1 ∶200稀释),4℃过夜。PBS清洗,加入荧光二抗(1 ∶300稀释),避光,室温静置1 h,PBS清洗,脱水,中性树胶封片,荧光显微镜下观察切片。
1.2.5CCK-8法检测细胞增殖①将CFs培养于96孔板中,无血清同步化以后,分别用不同浓度葡萄糖(5.5、20、25、30、35、50 mmol·L-1)诱导CFs 24 h,CCK-8试剂盒检测各组细胞增殖情况确定最佳高糖造模浓度;②30 mmol·L-1高糖加不同浓度Cur(10、25、50、100、200 μmol·L-1)诱导CFs 24 h,CCK-8试剂盒检测各组细胞增殖情况确定Cur最佳给药浓度。
1.2.6Western blot高糖(30 mmol·L-1)和Cur(25 μmol·L-1)处理CFs 24 h后,弃去培养液,用4℃ 预冷PBS清洗2~3次。将培养皿置于冰上,每皿加入150 μL裂解液,细胞刮刀冰上收集细胞,转至EP管中,冰上放置30 min继续裂解。4℃、13 000 r·min-1离心20 min后,取上清液,按BCA法测定各组蛋白浓度。蛋白样品与3×上样缓冲液按体积比(2 ∶1)充分混匀后,95℃灭活5 min。样本冰上冷却后,进行SDS-PAGE电泳,或者-20℃保存。加入按适当比例稀释的一抗,4℃摇床孵育过夜。用HRP标记的二抗室温下孵育1 h。用TBST 摇晃清洗后,采用ECL化学发光法显影检测条带灰度值。
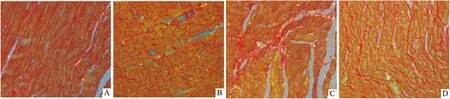
Fig 1 Sirius red staining for collagenA: Control; B: Cur; C: DM; D: DM+Cur
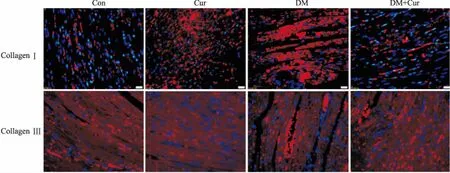
Fig 2 Immunofluorescence for CollagenⅠand Collagen Ⅲ

2 结果
2.1Cur对糖尿病大鼠心肌胶原沉积的影响显微镜下观察显示,胶原组织为红色,心肌组织为黄色;对照组大鼠胶原纤维均匀纤细,DM组大鼠心肌间质胶原纤维与对照组相比明显增加,且分布杂乱;DM+Cur组较DM组间质纤维化明显减少,纤维较为均匀细薄(Fig 1)。
2.2Cur对糖尿病大鼠心肌组织CollagenⅠ和CollagenⅢ表达的影响免疫荧光检测心肌组织切片发现,Collagen Ⅰ和Collagen Ⅲ主要分布在细胞外基质。DM组大鼠心肌组织中CollagenⅠ和Collagen Ⅲ明显增多。DM+Cur组较DM组间质Collagen Ⅰ和Collagen Ⅲ有所减少(Fig 2)。
2.3不同浓度高糖对CFs增殖率的影响Fig 3的CCK-8结果表明,以对照组(葡萄糖5.5 mmol·L-1)细胞存活率为100%作为参照,高糖条件下,CFs的增殖率随着高糖浓度(≤30 mmol·L-1)的升高而逐渐上升,而高糖浓度在50 mmol·L-1刺激后,CFs的增殖率明显下降,部分细胞出现死亡。其中,30 mmol·L-1高糖刺激24 h后存活率最高,与对照组比较差异具有显著性(P<0.05)。本研究选取的最佳高糖造模浓度是30 mmol·L-1。

Fig 3 Influence of high glucose on cell viability in cardiac fibroblasts(n=10)
*P<0.05vscontrol group
2.4不同浓度Cur对CFs增殖率的影响Fig 4的CCK-8结果表明,以对照组(葡萄糖5.5 mmol·L-1)细胞增殖率以100%作为参照,30 mmol·L-1高糖刺激24 h后存活率最高,与对照组比较差异具有统计学意义(P<0.05)。随着Cur浓度的增大,CFs的存活率明显下降。HG+Cur(10 μmol·L-1)刺激24 h后存活率开始下降,与HG组比较差异具有显著性(P<0.05)。为了确定给药的稳定性,本研究选取的最佳Cur给药浓度是25 μmol·L-1。
2.5Cur对高糖诱导的CFs内TβRⅢ/TGF-β/Smads信号通路的影响为进一步探讨高糖诱导心肌纤维化的可能机制,我们研究与纤维化密切相关的蛋白。如Fig 5所示,CFs经过高糖刺激24 h后,Collagen Ⅰ、Collagen Ⅲ、TGF-β1、p-Smad2、p-Smad3、TβR-Ⅲ明显增多,与对照组比较差异有统计学意义(P<0.05)。给予Cur后,以上各蛋白表达明显减少,与HG组比较差异有统计学意义(P<0.05)。
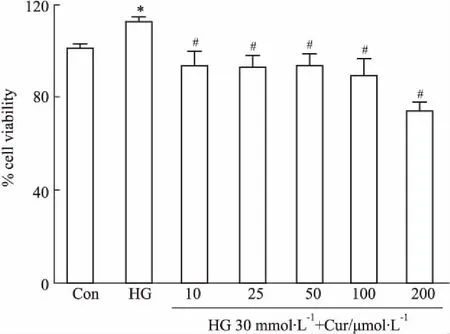
Fig 4 Influence of curcumin on cell viability in cardiac fibroblasts(n=10)
*P<0.05vscontrol group;#P<0.05vsHG group
3 讨论
DCM是一种独立于高血压和冠状动脉疾病的心肌病,其主要病理改变包括心肌胶原沉积、心肌肥厚及心肌间质纤维化[4]。其中,心肌间质纤维化可引起心脏舒张及收缩功能障碍,最终引起心脏结构和功能的异常,是导致晚期糖尿病患者发生死亡的主要因素之一[5]。分布在心脏细胞外基质中的胶原蛋白主要有Collagen I、Collagen Ⅲ、Collagen Ⅳ、Collagen V型等,其中Collagen Ⅰ和Collagen Ⅲ占大部分。在生理情况下,心肌中的胶原蛋白处于不断合成与降解的平衡状态,这种状态可以维持心脏结构和功能的完整性和协调性,任何一种胶原蛋白改变都可能引起心肌功能的改变。本研究中糖尿病大鼠心肌和高糖诱导的CFs内的Collagen Ⅰ和Collagen Ⅲ表达都增多,引起心肌间质纤维化,和已知文献[10]保持一致。
研究表明,TGF-β/Smads信号通路参与糖尿病心肌纤维化的发生与发展[6]。TGF-β1有3种广泛分布在细胞表面的跨膜糖蛋白,分别是Ⅰ型(TβR-Ⅰ)、Ⅱ型(TβR-Ⅱ)和Ⅲ型(TβR-Ⅲ)。其中TβR-Ⅲ是由二硫键链接的蛋白聚糖,含量最多,与TGF-β1结合后,可将TGF-β1传递给TβR-Ⅰ或者TβR-Ⅱ,但是TβR-Ⅲ本身无信号转导功能,主要与TGF-β的储存有关[7]。活化后的TβR-Ⅰ则调控下游Smad2/3磷酸化,然后与Smad4结合产物共同进入细胞核内,刺激成纤维细胞转化为肌成纤维细胞从而导致器官纤维化的发生与发展[8-9]。
前期研究显示,高糖刺激人心肌成纤维细胞(HCFs)24 h后,细胞内Collagen I、Collagen Ⅲ、TGF-β1、p-Smad2/3、TβR-Ⅱ表达明显增多[10]。本研究表明,在大鼠糖尿病心肌纤维化过程中,Collagen I和Collagen Ⅲ表达逐渐升高;高糖诱导24 h后的CFs,Collagen I、Collagen Ⅲ、TGF-β1、p-Smad2、p-Smad3的表达也逐渐升高,给予Cur干预后,上述各蛋白均具有逐渐降低的趋势。提示,在糖尿病心肌纤维化过程中,高糖可以激活TGF-β/Smads信号通路,胶原表达增加,促进纤维化的过程,而Cur对糖尿病心肌纤维化具有保护作用。其中,TβR-Ⅲ的表达明显增多,说明TβR-Ⅲ发挥受体作用,与TGF-β1结合后,将TGF-β1传递下去,激活TGF-β/Smads信号通路,而Cur则可以逆转上述现象,其具体机制,还需进一步研究。总之,在CFs上,Cur可以通过减少TβR-Ⅲ的表达,阻断高糖诱导的TGF-β/Smads信号通路的传导,从而抑制CFs胶原的合成,减少心肌纤维化的发生。
综上所述,Cur在体内和体外均对糖尿病心肌纤维化具有保护作用,其机制可能与抑制胶原的合成和TGF-β/Smads信号通路的传导有关,本研究为开发新型抗糖尿病心肌纤维化的药物的研究提供了新的理论基础。
(致谢:本实验在湖北科技学院糖尿病心脑血管病变湖北省重点实验室完成,感谢实验室的老师对本实验的帮助与指导。)

Fig 5 Influence of curcumin on expression of collagen Ⅰ, collagen Ⅲ, Smad2, Smad3 and TβRⅢ in cardiac fibroblasts (n=3)*P<0.05 vs control group; #P<0.05 vs HG group
参考文献:
[1]Teekakirikul P, Eminaga S, Toka O, et al. Cardiac fibrosis in mice with hypertrophic cardiomyopathy is mediated by non-myocyte proliferation and requires TGF-beta[J].JClinInvest, 2010,120(10): 3520-9.
[2]Derynck R, Zhang Y E. Smad-dependent and Smad-independent pathways in TGF-beta family signalling[J].Nature, 2003,425(6958): 577-84.
[3]刘忠和,余薇,刘超,等.姜黄素对糖尿病大鼠心肌的保护作用[J]. 中国病理生理杂志, 2014,30(4): 725-8.
[3] Liu Z H, Yu W, Liu C, et al. Protective effect of curcumin on myocardium in diabetic rats[J].ChinJPathophysiol, 2014,30(4): 725-8.
[4]Trachanas K, Sideris S, Aggeli C, et al. Diabetic cardiomyopathy: from pathophysiology to treatment[J].HellenicJCardiol, 2014,55(5): 411-21.
[5]金智生,王东旭,张花治,等. 红芪多糖对db/db小鼠糖尿病心肌病TGF-β1/Smads信号通路影响的实验研究[J]. 北京中医药大学学报, 2017,40(1): 20-6.
[5] Jin Z S, Wang D X, Zhang H Z, et al. Effect of hedysarum polybotrys polysacchcaide on TGF-β1 /Smads signaling pathway in db /db mice with diabetic cardiomyopathy[J].JBeijingUnivTraditChinMed, 2017,40(1): 20-6.
[6]Castro N E, Kato M, Park J T, et al. Transforming growth factor beta1 (TGF-beta1) enhances expression of profibrotic genes through a novel signaling cascade and microRNAs in renal mesangial cells[J].JBiolChem, 2014,289(42): 29001-13.
[7]陈蓉,谢梅林.TGF-β/Smads信号通路在心肌纤维化发生和治疗中应用前景的研究进展[J]. 中国药理学通报, 2012,28(9): 1189-92.
[7] Chen R,Xie M L. The research progress of TGF-β/Smads signal pathway in the treatment of myocardial fibrosis and its application[J].ChinPharmacolBull, 2012,28(9): 1189-92.
[8]Zhai Y, Gao X, Wu Q, et al. Fluvastatin decreases cardiac fibrosis possibly through regulation of TGF-beta(1)/Smad 7 expression in the spontaneously hypertensive rats[J].EurJPharmacol, 2008,587(1-3): 196-203.
[9]Zhan C Y, Tang J H, Zhou D X, et al. Effects of tanshinone IIA on the transforming growth factor beta1/Smad signaling pathway in rat cardiac fibroblasts[J].IndianJPharmacol, 2014,46(6): 633-8.
[10] Guo, S, Meng, X, Yang, X, et al. Curcumin administration suppresses collagen synthesis in the hearts of rats with experimental diabetes[J].ActaPharmacolSin, 2018,39(2):195-204.
