骨髓间充质干细胞与硫酸软骨素酶ABC联合移植对大鼠脊髓损伤的修复作用及其机制
2018-04-11文远超余云湖王波冉启山朱涛付晓红杨开华
文远超,余云湖,王波,冉启山,朱涛,付晓红,杨开华
(1遵义市第一人民医院,贵州遵义 563002;2遵义市心脑血管病研究所;3天津医科大学总医院)
脊髓损伤具有高发生率、高致残率及高耗费等特点[1],因此带来诸多并发症,使患者生活质量严重降低[2];目前采取的如药物、手术、针灸、物理康复等传统治疗方式,只能阻止病变进展和保证患者感觉及反射功能的暂时恢复[3,4],但无法有效修复因损伤导致的坏死神经组织。骨髓间充质干细胞(BMSCs)是一种成体干细胞,取材简便,在体内外具有很强的自我更新能力,同时能保持干细胞特性[5]。近年研究[6,7]认为,BMSCs在中枢神经系统疾病治疗和脊髓损伤修复方面具有广泛的前景。硫酸软骨素酶ABC(ChABC)是一种细菌胞外酶[8],通过降解脊髓损伤区疤痕中的硫酸软骨素蛋白多糖,清除神经组织再生过程中的障碍,促进运动功能的快速恢复及神经组织的再生[9]。近年研究人员尝试采用ChABC修复体内脊髓损伤,并取得不错的效果[10,11]。2013年9月~2015年6月,我们观察了BMSCs与ChABC联合移植对大鼠脊髓损伤的修复作用,并对其作用机制进行了探讨。现将结果报告如下。
1 材料与方法
1.1实验动物、仪器及试剂成年雄性SD大鼠80只,SPF级,体质量160~200 g。CO2培养箱(美国Thermo公司),脊髓损伤致伤仪(第四军医大学神经科学研究所),立体定位仪(日本Narishige 公司),超净工作台(苏州安泰空气技术有限公司),恒温冰冻切片机(Leucer公司),荧光倒置显微镜(Olympus公司),流式细胞仪(BD公司)。ChABC、兔抗大鼠胶质纤维酸性蛋白(GFAP)多克隆抗体(美国Sigma公司),小鼠抗大鼠生长相关蛋白43(GAP43)单克隆抗体(美国Sigma 公司),小鼠抗大鼠脑源性神经生长因子(BDNF)单克隆抗体(美国Sigma公司),小鼠抗大鼠CD34/CD44/CD90-FITC单克隆抗体(美国Santa Cruz公司)。
1.2BMSCs的分离培养取6只成年SD大鼠,采用颈椎脱臼法将其处死,将大鼠用75%酒精浸泡10 min,于无菌条件下取出股骨和胫骨,去除骨表面的软组织,反复冲洗骨髓腔[12],计数并调整细胞密度。将细胞接种到25 cm2塑料培养瓶中,在37 ℃、5%CO2的培养箱内培养24 h,后更换新鲜培养基洗掉未贴壁细胞,之后每2~3天更换1次新鲜培养基。待细胞生长到融合度为90%时用胰蛋白酶进行消化,传代培养。取第5代生长状态良好的细胞,采用流式细胞仪检测FITC标记的CD34、CD44和CD90抗体,鉴定BMSCs。
1.3大鼠脊髓损伤模型制备、分组及BMSCs、ChABC移植方法以大鼠T10为中心,行背部正中纵行切口,长约2 cm,紧贴棘突分离棘突旁肌肉组织至横突外侧,暴露T9、T10、T11棘突及椎板,无菌棉球止血,清洁术野。咬骨钳咬除整个T10与半个T9椎板。保留硬膜完整,避免损伤脊髓。打开椎管至两侧椎弓根,充分暴露脊髓。采用自制脊髓损伤打击仪器打击致伤,打击后迅速移去打击棒,查看损伤部位硬膜有无破损、出血。大鼠双后肢发生不同程度抽搐、尾巴摆动,数秒钟后完全松弛。逐层缝合肌肉与皮肤,并消毒切口。术后将大鼠放于清洁鼠笼内单独喂养观察大鼠生命体征。制模成功的大鼠随机分为A、B、C、D组各20只。损伤后第6天,A组沿脊髓损伤区边缘先后移植2.0×106/μL的原代BMSCs细胞悬液、1 U/mL的ChABC各20 μL,B组予等量BMSCs,C组予等量ChABC,D组予等量PBS。
1.4大鼠运动功能评估分别于制模后第1、7、14、28天采用运动功能评分(BBB评分)评价大鼠后肢的行走及后肢活动功能。将大鼠放置于同一光滑木板上,身体轴线与斜板纵轴垂直位放置,保持头高脚低方向,将木板由0°轻轻抬起,斜板每次升高5°,动作要保持均匀,以大鼠能够停留5 s的最大角度为其功能值。大鼠头朝前,身体纵轴与斜板纵轴垂直放置逐渐增大,移动板与水平底板的角度至大鼠不能保持原有位置5 s时记录临界角[3]。移动板从水平位置(0°)起绕轴旋转,测底板与移动板斜面角度。每只动物测5次,取平均值。
1.5大鼠后肢体感诱发电位(SEP)、经颅磁刺激运动诱发电位(MEP)潜伏期记录采用诱发电位仪检测。刺激电极为双极电极,刺激电极置于腓肠肌皮肤处,记录电极为单针电极,放置于冠状缝后3 mm,矢状缝右侧2 mm皮下,参考电极置于鼻根部,刺激强度4.0~6.7 mA,地线紧贴于大鼠脱毛的腰部,方波0.3 ms,频率2 Hz,截频为20~2 000 Hz,叠加500次,以后肢明显抖动为准。分别于移植前及移植后12周记录SEP、MEP潜伏期。
1.6大鼠脊髓组织病理学观察制模后6周处死全部大鼠,取出以脊髓损伤区为中心的脊髓2 cm,并进行连续矢状切片,片厚20 μm。挑选部分切片脱腊后进行常规HE染色,在Nikon Eclipse 55i显微镜下观察组织病理学变化,根据损伤区组织学变化程度确定SCI的损伤程度。
1.7大鼠脊髓组织GFAP、GAP-43、BDNF表达阳性细胞观察取术后第14天的大鼠脊髓组织,石蜡固定、切片后,从每段脊髓标本切片中随机抽取10张,行HE染色,观察脊髓的病理形态学变化。同时对经HE染色筛选出的同段脊髓组织切片进行免疫组化染色,光显微镜下观察各组GFAP、GAP-43、BDNF表达阳性细胞。具体步骤如下:用暖风机将切片上的蜡加热熔化;置于60 ℃烤箱内干燥2 h;二甲苯Ⅰ、Ⅱ分别脱蜡15 min;无水乙醇去二甲苯5 min×2次;75%乙醇3 min;80%乙醇1 min;充分水洗干净;放入苏木素浸染5~10 min;若染液上有氧化膜则需滤纸去除;充分水洗;盐酸乙醇分化(7%盐酸+酒精);充分水洗;饱和碳酸锂还原;伊红液1 min;80%乙醇1 min;95%乙醇1 min;无水乙醇Ⅰ 1 min;无水乙醇Ⅱ 1 min;碳酸:二甲苯1 3 min;二甲苯透明中性树胶封片,荧光显微镜下观察GFAP、GAP-43、BDNF表达阳性细胞,记录阳性细胞百分比。
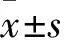
2 结果
2.1不同时点各组BBB评分比较结果见表1。

表1 不同时点各组BBB评分比较(分,
注:与D组比较,aP<0.05;与A组比较,bP<0.05。
2.2移植前后各组SEP、MEP潜伏期比较结果见表2。
2.3各组脊髓组织病理学变化HE染色结果显示,伤后14 d各组大鼠的脊髓损伤区均形成空洞及胶质瘢痕。A、B、C、D组损伤区面积分别为(2.54±0.81)、(4.54±0.98)、(3.65±0.81)、(5.78±1.23)mm2,A组与其余3组比较,P均<0.05。
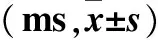
表2 移植前后各组SEP、MEP潜伏期比较
注:与同组移植前比较,aP<0.05;与其他各组比较,bP<0.05。
2.4各组GFAP、GAP-43、BDNF表达阳性细胞百分比比较结果见表3。
注:与D组比较,aP<0.05;与A组比较,bP<0.05。
3 讨论
近年来,脊髓损伤发病率有逐年增加的趋势,除及时有效的稳定脊柱和解除脊髓压迫等治疗外,早期采取有效的促进神经功能修复措施,改善脊髓损伤患者感觉、运动及反射功能障碍,也是临床工作中亟待解决的问题。传统观点认为,哺乳动物脊髓损伤后神经不能再生。近年研究表明,成年动物中枢神经损伤后神经轴突有再生能力,但由于脊髓损伤后神经细胞缺失及损伤局部微环境改变,脊髓损伤后很难出现自发性的功能和结构恢复。目前,国内外学者都致力于脊髓损伤后神经修复的研究,从神经干细胞、雪旺细胞、嗅鞘细胞、神经组织等的移植,到基因分子生物学技术的应用,还没有哪一种研究方法得到学术界的一致认可,由于脊髓损伤修复这一研究领域目前处于探索阶段,且有伦理学方面的限制,大都仅限于动物实验。中国科学院遗传与发育生物学研究所戴建武再生医学团队长期从事脊髓损伤再生修复研究,在世界上率先开展了神经再生胶原支架修复脊髓损伤的临床研究。成年哺乳动物脊髓中央管的室管膜细胞是一类神经干细胞,且是在正常条件下保持静息状态的神经干细胞[13],可被脊髓损伤激活。脊髓损伤微环境能够抑制神经干细胞定向分化为神经元。引导神经干细胞定向神经元分化形成神经桥接是脊髓损伤再生修复的主要机制。
BMSCs是骨髓中的造血结构性和功能性支持细胞,由于其在培养中增殖和对塑料培养材料的贴壁特性,过去被称为集落形成单位成纤维细胞或塑料贴壁细胞。这种细胞除具备干细胞的基本特点外,还具有可塑性或“克隆性”,表现为MSCs在某些信号的影响下,锚靠一类组织,并分化成该组织细胞,其细胞分化类型受其所处的组织微环境的诱导,而且骨髓中成熟细胞能够反分化。近年来发现,BMSCs作为供体细胞修复损伤脊髓具有神经干细胞和胚胎干细胞无法比拟的优点:①容易获得且对供体损害轻微(通过骨髓抽吸即可),在体外培养程序简单并易于扩增等优点;②免疫抑制特性;③避免伦理学方面争议。国内外许多学者先后进行了多项研究,证实MSCs可以分化为神经细胞。Lee等将分离纯化的MSCs应用核荧光标记物标记后直接注射到动物脊髓损伤区,动物运动功能明显恢复,移植4周后免疫组化检测发现有星形胶质细胞标记物GFAP表达。骨髓细胞植入大鼠中枢神经系统后分化的细胞能产生神经元特异性抗原,提示骨髓细胞分化为神经细胞。
ChABC能特异性破坏大部分硫酸软骨素蛋白聚糖(CSPGs)的GAG链,将CSPGs分解成核心蛋白和碳水化合物短链,使包围在损伤位点GAG链表达降低,同时行为学评分及HRP示踪结果也支持损伤后的脊髓有再生神经纤维生长。ChABC能减轻CSPGs对轴突再生的抑制作用,是轴突的再生能力加强,恢复脊髓的突触传递能力。最近研究[14]利用转基因技术通过星型胶质细胞表达ChABC,证实中枢神经系统损伤后硫酸软骨素蛋白聚糖(CSPGs)确实能阻碍轴突生长,并且ChABC能够通过降解CSPGs来促进CNS损伤后轴突生长及功能修复。Tom等[15]观察到利用ChABC分解CSPGs能够促进轴突再生,Houle等[16]将ChABC联合自体外周神经移植修复脊髓半切的大鼠,发现细胞外基质成分阻碍了神经轴突再生,而ChABC能够解除CSPGs的阻碍作用。
本研究显示,ChABC联合BMSCs能有效恢复脊髓损伤大鼠的运动功能,且感觉诱发电位和运动诱发电位潜伏期的恢复情况明显好于其他组,说明两者联合具有很好的协同作用。GFAP为神经胶质细胞的特异性生物标志物[17],能够维持神经元结构及星形细胞形态和功能。然而脊髓损伤后,星形细胞的胶质化具有双重作用,幼稚期能诱导神经纤维的再生,成熟期能够阻挡神经纤维再生,抑制神经功能的恢复。本研究还发现,A组较其余组的GPAP阳性率低,说明ChABC联合BMSCs通过实现脊髓损伤后神经生长抑制因子与促进因子间的平衡状态,有效促进脊髓损伤后功能的恢复。GAP-43是一类神经组织特有的生长相关性蛋白质,主要参与神经细胞外生长、神经细胞再生和突触发育形成。研究[18]表明,通过增强脊髓损伤组织GAP-43表达水平,能显著促进损伤脊髓的神经元再生和快速修复。本文结果显示,A、B、C组GAP-43阳性率均高于D组,且A组阳性率最高,说明联合移植治疗通过上调GAP-43的表达,抑制脊髓损伤部位形成胶质瘢痕,为轴突再生的再生清除障碍。BDNF是一类在神经系统中广泛分布的神经生长因子[19],其对维持神经元存活、促进神经元分化及减少脊髓损伤后神经元的自然死亡是必不可少的。本研究发现,A、B、C组BDNF阳性率均高于D组,且A组阳性率最高,说明联合移植治疗通过上调神经生长因子BDNF的表达,发挥脊髓损伤后的修复功能。
总之,BMSCs联合ChABC对大鼠脊髓损伤有修复作用,机制可能与其降低GFAP、GAP-43表达及升高BDNF表达有关。
参考文献:
[1] 卢曼鹏,权正学,刘渤.脊髓损伤动物模型的制备及评价[J].颈腰痛杂志,2008,29(5):480-483.
[2] Foumier AE, Takizawa BT, Strittmatter SM. Rho kinase inhibition enhances axonal regeneration in the injured CNS[J].J Neumsci, 2003,23(4):1416-1423.
[3] Rivlin AS, Tator CH. Objective clinical as sessment of motor function after experimental spinal cord injury in the rat[J]. J Neurosurg, 1977,47(4):577-581.
[4] 高德萱,贾全章,李东君,等.骨髓间充质干细胞修复损伤脊髓的实验及临床应用短期随访[J].中国组织工程研究与临床康复,2011,15(27):5016-5020.
[5] 王郦,王倩,张晓明.骨髓间充质干细胞治疗脊髓损伤的研究进展[J].中国骨伤,2014,27(5):437-440.
[6] 邢冉,陈旭义,刘英富,等.干细胞移植治疗脊髓损伤研究与临床应用[J].中风与神经疾病杂志,2014,31(8):752-754.
[7] 王飞,张晓君,岳冀,等.丹酚酸B联合骨髓间充质干细胞移植对大鼠脊髓损伤修复作用研究[J].环球中医药杂志,2012,5(11):804-807.
[8] 张纯,贺西京,李浩鹏.硫酸软骨素酶ABC联合BMSCs修复大鼠脊髓损伤的实验研究[J].中国修复重建外科杂志,2013,27(5):541-546.
[9] 高平,孙占胜,王伯珉,等.骨髓间充质干细胞诱导成神经元样细胞移植治疗脊髓损伤[J].中国组织工程研究,2013,17(23):4256-4263.
[10] 刘富顺.干细胞治疗与运动性脊髓损伤[J].中国组织工程研究,2012,16(6):1129-1132.
[11] 李兵奎,常巍,王达义,等.BMSCs静脉移植对大鼠脊髓损伤后神经功能恢复的影响[J].中国矫形外科杂志,2012,20(24):2292-2297.
[12] 兰静,闫金玉,夏润福,等.口服肉苁蓉联合骨髓间充质干细胞移植治疗大鼠脊髓损伤[J].中国组织工程研究,2014,18(41):6639-6644.
[13] Silver J, Miller J. Regeneration beyond the glial scar[J]. Nat Rev Neurosci, 2004,5(2):146-156.
[14] Cafferty WB, Yang SH, Duffy PJ, et al. Functional axonal regeneration through astrocytic scar genetically modified to digest chondroitin sulfate proteoglycans[J]. J Neurosci, 2007,27(9):2176-2185.
[15] Tom VJ, Houlé JD. Intraspinal microinjection of chondroitinase ABC following injury promotes axonal regeneration out of a peripheral nerve graft bridge[J]. Exp Neurol, 2008,211(1):315-319.
[16] Houle JD, Tom VJ, Mayes D, et al. Combining an autologous peripheral nervous system “bridge” and matrix modification by chondroitinase allows robust, functional regeneration beyond a hemisection lesion of the adult rat spin al cord[J]. J Neurosci, 2006,26(28):7405-7415.
[17] 智晓东,吕刚.大鼠骨髓间充质干细胞和许旺细胞联合移植治疗脊髓损伤[J].中国组织工程研究与临床康复杂志,2008,12(16):3015-3018.
[18] 段艳萍,王金德,黄佑庆,等.GAP-43治疗大鼠脊髓横断后神经中丝NF200表达的变化[J].神经解剖学杂志,2008,24(4):406-410.
[19] Sasaki M, Radtke C, Tan AM, et al. BDNF-hypersecreting human mesenchymal stem cells promote functional recovery axonal sprouting and protection of corticospinal neurons after spinal cord injury[J]. Neurosci, 2009,29(47):14932-14941.
