过表达脑红蛋白对AD转基因小鼠学习记忆能力、空间探索能力的影响及其机制
2018-04-11宋晓征张雄
宋晓征,张雄
(1中航工业三六三医院,成都 610000;2重庆医科大学神经科学研究中心)
阿尔茨海默病(AD)是常见的神经退行性变性疾病,神经元丢失是此病的三大病理特征之一,也是导致AD患者认知功能障碍的重要原因,主要表现为神经元的凋亡[1];半胱氨酸蛋白酶(Caspases)家族是一类与凋亡密切相关的特异性关键酶,其家族成员众多,而作为凋亡启动子和凋亡执行者的经典代表Caspase-9、Caspase-3,在凋亡的发生发展过程中发挥了关键作用。因此,如何抑制Caspases的活性,进而阻止神经元的凋亡,将是防治AD的关键策略[2]。过表达脑红蛋白(pNGB)是一种新型携氧球蛋白,以往多数研究集中于NGB对脑缺氧、缺氧的保护作用及机制[3,4]。我们前期体外研究已经证实,pNGB可通过抑制Caspase-3、Caspase-9表达,进而抑制Aβ1-42诱导的SH-SY5Y细胞凋亡,从而发挥神经保护作用[5]。那么在AD的体内模型中,pNGB是否也可通过抑制Caspase-3、Caspase-9表达,进而抑制神经元凋亡,从而发挥脑保护作用以往鲜有报道。因此,本研究以双转基因AD小鼠为研究对象,通过侧脑室注射pNGB,观察pNGB对AD小鼠的学习记忆能力、空间探索能力的影响,并探讨其机制是否与抑制Caspase-3、Caspase-9表达有关。
1 材料与方法
1.1实验动物及分组B6C3-Tg(APPswe/PSEN1dE9)85Dbo/j品系的双转基因小鼠(Tg2576)购自南京大学模式动物研究所[动物许可证号:SCXK(苏)2010-0111]。鉴定后,取24只AD胎鼠,雌雄各半,体质量25~30 g,于实验中心SPF级室饲养,每笼4只。所有室内温度保持在(24±1)℃,鼠粮、水充足。13月龄后,随机分为实验组、模型组、对照组各8只。
1.2质粒、试剂及仪器pNGB质粒、空质粒pCDNA3.1(没有插入外源要表达或克隆的片段)均由上海吉凯公司提供。Caspase-3、Caspase-9活性检测试剂盒、蛋白提取试剂盒、浓度检测试剂盒、SDS-Page胶配置试剂盒均购自碧云天生物技术研究所;兔抗人多克隆抗体Caspase-3、Caspase-9购自Bioworld公司;内参兔抗β-actin和HRP标记的山羊抗兔二抗购自博鳌森生物技术有限公司;PVDF膜和ECL发光试剂盒购自Bio-rad公司。脑立体定位仪、水迷宫视频分析系统、Bio-rad凝胶电泳系统、Bio-rad凝胶成像系统。
1.3 pNGB注射方法将AD小鼠置于立体定位仪上固定双耳,消毒后剪开头部皮肤,实验组、模型组、对照组分别于右侧侧脑室(前囟后2 mm,旁开1.5 mm,深度2 mm)注射pCDNA3.1(1 μg/μL)+pNGB(1 μg/μL)、生理盐水+pCDNA3.1(1 μg/μL)、生理盐水,注射体积均为5 μL[6],每周1次,连续8周[7]。
1.4大鼠学习记忆能力和空间探索能力评价采用Morris水迷宫实验评价小鼠学习记忆能力和空间探索能力。①定位航行实验:实验第1 d天,将平台(插小红旗)放置于第三象限,高出水面约1 cm。将小鼠随机放入某一象限,并开始计时,记录小鼠自己寻找平台的时间(逃避潜伏期)。若小鼠在1 min内找到并爬上平台,则记录具体时间;若小鼠在1 min后仍未找到平台,则将小鼠引导至平台附近使之爬上平台并停留10 s。按上述方法对每只小鼠每天训练5次,分别从不同的象限放入水中,并且每一轮的训练至少间隔1 h。在实验第2~5 d,使平台低于水面约1 cm,按照第1 d的象限顺序放入小鼠,记录每次找到平台的时间,计算平均成绩,以平均成绩作为评价小鼠学习记忆能力的指标。②空间探索实验:实验第6 d,撤掉平台,小鼠从第三象限放入,使之在池内游泳5 min,记录小鼠游泳轨迹,观察并记录其穿过第三象限的时间、次数及游泳时间,计算平均成绩,以平均成绩作为评价小鼠空间探索能力的指标。
1.5脑组织Caspase-3、Caspase-9酶活性检测PBS灌注后处死小鼠,迅速取脑,加入蛋白裂解液,小心研磨,离心后取上清液,并保存。根据试剂盒说明进行实验,将上清液移到预冷的EP管中,立即测定Caspase-3、Caspase-9酶活性。根据Caspase-3酶活性变化释放的pNA与Caspase-3的活性呈正比,将pNA释放的405 nm的波长OD值作为Caspase-3、Caspase-9酶活性值。
1.6脑组织Caspase-3、Caspase-9蛋白检测采取Western blotting法检测。称取脑组织,迅速加入蛋白裂解液,小心研磨,离心后取上清液。测定总蛋白浓度。上样40 μg的总蛋白,进行SDS-PAGE胶(8%~10%)电泳,然后转至PVDF膜上,5%脱脂奶粉封闭1 h后,PVDF膜浸泡在含有抗体Caspase-3(1∶200)、Caspase-9(1∶200)和β-actin(1∶5 000)的TBST液中,4 ℃孵育过夜。次日,TBST洗膜后,加入兔抗HRP(1∶5 000),室温下孵育1~2 h,ECL发光,凝胶成像系统分析各目的蛋白光密度灰度值和内参β-actin灰度值的比值。每次实验重复3次,取平均值。
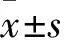
2 结果
2.1实验第1~5天各组小鼠逃避潜伏期比较结果见表1。
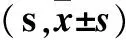
表1 实验第1~5天各组小鼠逃避潜伏期比较
注:与模型组、对照组比较,*P<0.05。
2.2实验第6天各组小鼠穿越次数、穿越距离、穿越时间比较结果见表2。

表2 实验第6天各组小鼠穿越次数、穿越距离、穿越时间比较
注:与模型组、对照组比较,*P<0.05。
2.3各组小鼠脑组织Caspase-3、Caspase-9酶活性比较结果见表3。

表3 各组小鼠脑组织Caspase-3、Caspase-9酶活性比较
注:与对照组比较,*P<0.05。
2.4各组小鼠脑组织Caspase-3、Caspase-9蛋白表达比较结果见表4。

表4 各组小鼠脑组织Caspase-3、Caspase-9蛋白表达比较
注:与模型组、对照组比较,*P<0.05。
3 讨论
AD是一种起病隐匿的中枢神经系统退行性变性疾病,主要表现为进行性的全面认知功能障碍。随着世界人口的老龄化变化,AD的发病率也不断增高,已然成为一类严重威胁人类健康的疾病。众所周知,AD的三大病理特征包括Abeta沉积形成老年斑、Tau蛋白过度磷酸化形成神经纤维缠结和神经元的丢失(凋亡),而后者与AD典型临床表现(认知和记忆功能障碍)的关系最为密切,因此如何抑制神经元的凋亡可能成为改善认知功能,进而防治AD的重要策略之一。
pNGB是一种在神经元内有丰富表达的新型携氧球蛋白,它在一些内分泌细胞和视杆细胞中也有少量表达。在人体内,pNGB含量会随着年龄的逐渐增加而呈递减趋势。Sun等[8]在对AD患者进行尸检的研究中发现,在AD早期,脑内pNGB是增加的,在进展期则更为明显,而到严重AD时,pNGB水平则降低到正常水平以下,这提示pNGB在脑内存在一个动态变化的过程。本实验中,我们选择13月龄大小的AD小鼠,因为这个阶段的AD小鼠认知功能受损严重,其脑内pNGB明显低于正常水平,因此符合我们的实验需要。
Caspase-3和Caspase-9是Caspases家族中最为重要的两个成员,一个是凋亡的启动子,另一个是凋亡的执行者,两者关系还十分密切,Caspase-9能激活Caspase-3,活化的Caspase-3能特异性地切割DNA,进而使参与DNA损伤修复过程的聚ADP核糖聚合酶以及DNA依赖的蛋白激酶等失活,促使染色质凝聚和核酶激活,最终导致细胞凋亡。Caspase-3还可以反过来可激活Caspase-9,形成正反馈。因此,Caspase-3、Caspase-9活性高低可以反映凋亡程度,抑制其活性,进而抑制凋亡导致的损伤[9]。研究[10]表明,在AD中Caspase的激活与AD的病理特征密切相关,在Aβ处理的PC12细胞以及Abeta注射的小鼠海马组织内可以检测到Caspase-3、9、12等水平增加;Caspase-9可与Abeta结合,抑制细胞内凋亡体的形成,进而抑制细胞的凋亡[11];APP存在着3个Caspase剪切位点,即(P4)DNVD 197(P1)/S、(P4)DYAD219(P1)/G、(P4)VEVD720(P1)/A[12],这些都提示抑制Caspase活性可降低Aβ诱导的细胞凋亡,从而对AD患者脑组织起保护作用[13]。我们前期体外实验通过水溶性Aβ1-42处理SH-SY5Y建立了AD的细胞模型,并转染pNGB,发现过表达的NGB不仅能够促进细胞的生长,而且还能够保护细胞的膜电位,抑制细胞的凋亡;进一步研究发现,NGB可以抑制细胞内Caspase-3、9表达,从而发挥神经保护作用,这说明pNGB可以通过抑制神经细胞的凋亡而发挥细胞的保护作用,这跟国外的报道[14]显示pNBG具有抗凋亡作用的结果一致,但这些实验多以细胞为研究对象。本实验中我们以转基因AD小鼠为研究对象,结果显示实验组第5天逃避潜伏期较模型组、对照组短,实验第6天穿越次数较模型组、对照组多,穿越距离、穿越时间较模型组、对照组长,脑组织Caspase-3、Caspase-9酶活性和蛋白表达较对照组降低。
总之,pNGB改善了转基因AD小鼠学习记忆能力和空间探索能力,这种神经保护作用与其能够抑制Caspase-3、Caspase-9活性和蛋白表达,进而抑制神经元凋亡、保护神经元密切相关,这为pNGB防治AD提供了理论依据,但其具体的机制需深入的研究。
参考文献:
[1] Kuo YC, Lin CY, Li JS, et al. Wheat germ aglutinin-conjugated liposomes incorporated with cardiolipin to improve neuronal survival in Alzheimer′s disease treatment[J]. Int J Nanomedicine, 2017,12:1757-1774.
[2] Wang X, Wu J, Yu C, et al. Lychee seed saponins improves cognitive function and prevent neuronal injury via inhibiting neuronal apoptosis in rat model of Alzheimer′ s disease[J]. Nutrients, 2017,9(2):105.
[3] Xue L, Chen H, Lu K, et al. Clinical significance of changes in serum neuroglobin and HIF-1a concentrations during the early-phase of acute ischemic stroke[J]. J Neurol Sci, 2017(375):52-57.
[4] Wu Q, Yu KX, Ma QS, et al. Effects of intermittent hypobaric hypoxia preconditioning on the expression of neuroglobin and Bcl-2 in the rat hippocampal CA1 area following ischemia-reperfusion[J]. Genet Mol Res, 2015,14(3):10799-10807.
[5] 张雄,孙洁芸,高敏娜,等.过表达脑红蛋白对SH-SY5Y细胞损伤的神经保护作用及其机制[J].中国生物制品学杂志,2013,26(12):1768-1771.
[6] Zhu J, Tang WY. Cerebroprotection with recombinant neuroglobin plasmid in a rat model of focal cerebral ischemia[J]. Neural Regen Res, 2010,5(1): 52-57.
[7] Wang Q, Xu Y, Chen JC, et al. Stromal cell-derived factor 1α decreases β-amyloid deposition in Alzheimer′s disease mouse model[J]. Brain Res, 2012(1459):15-26.
[8] Sun F, Mao X, Xie L, et al. Neuroglobin protein is upregulated in Alzheimer′s disease[J]. J Alzhei Dis, 2013,36(4):659-663.
[9] Sun ZZ, Lv ZY, Tian WJ, et al. MicroRNA-132 protects hippocampal neurons agaist oxygen-glucose deprivation-induced apoptosis[J]. Int J Immonopathol Pharmacol, 2017,30(3):253-263.
[10] Xie G, Tian W, Wei T, et al. The neuroprotective effects of beta-hydroxybutyrate on Abeta-injected rat hippocampus in vivo and in Abeta-treated PC-12 cells in vitro[J]. Free Radic Res, 2015,49(2):139-150.
[11] Sharoar MG, Islam MI, Shahnawaz M, et al. Amyloid beta binds procaspase-9 to inhibit assembly of Apaf-1 apoptosome and intrinsic apoptosis pathway[J]. Biochim Biophys Acta, 2014,1843(4): 685-693.
[12] Francois G, Daigen X, George S, et al. Involvement of caspases inproteolytic cleavage of Alzheimer′ amyloid-beta precursor protein and amyloidogenin Abeta peptide formation[J]. Cell, 1999,97(3):395-406.
[13] Shao H, Zhang Y, Dong Y, et al. Chronic treatment with anesthetic propofol improves cognitive function and attenuates caspase activation in both aged and Alzheiemr′s disease transgenic mice[J]. J Alzheimers Dis, 2014,41(2):495-513.
[14] Seal M, Uppal S, Kundu S, et al. Interaction of aponeuroglobin with heme-Abeta complexes relevant to Alzheimer′s disease[J]. J Biol Inorg Chem, 2015,20(3):563-574.
