运动训练对脊神经背根损伤大鼠痛觉功能的影响及其机制探讨
2018-04-11李脉超安普天崔晓娟朱文文孟敏张益萌金利新
李脉超,安普天,崔晓娟,朱文文,孟敏,张益萌,金利新
(1青岛大学医学部临床医学院,山东青岛 266001;2青岛大学基础医学院人体解剖与组织胚胎学系)
背根损伤是周围神经损伤的一种,损伤导致的部分感觉缺失可引起患者一系列的感觉和运动损伤症状。脊神经背根损伤后,脊髓胶质反应增强,脊髓后角神经元凋亡丢失,相应脊髓节段神经元失去了感觉信息传入,从而引起患侧感觉缺失和异常,严重影响患者生活和工作[1,2]。目前,临床上对于脊神经背根损伤的治疗大多处于实验阶段,如自体神经移植术及利用雪旺细胞、胚胎干细胞、神经干细胞来促进功能恢复[3,4],但这些治疗方法有一定的局限性[5]。运动训练是一种可以提高神经健康水平和促进功能恢复的辅助治疗方式,近年受到越来越多研究者的关注[6,7]。运动训练已广泛应用到诸如脑卒中、脊髓损伤、坐骨神经损伤等神经疾病康复领域,并取得的良好的效果。但目前运动训练对于各种原因引起的背根损伤的应用效果仍是未知。本研究观察了运动训练对脊神经背根损伤大鼠痛觉功能的影响,并探讨其可能机制。
1 材料与方法
1.1实验动物SPF级雄性Wistar大鼠45只,体质量230~250 g,由青岛市实验动物和动物实验中心提供。大鼠分笼饲养,温度20~24 ℃,湿度55%±15%;自由饮食,给予充足的饲料和水,12 h光照交替。实验过程符合动物实验相关伦理要求。
1.2 主要试剂及仪器胶原纤维酸性蛋白(GFAP)单克隆抗体、离子钙接头分子(Iba-1)单克隆抗体(美国Abcam公司),二步法超敏试剂盒(中杉金桥公司);ZH-PT型动物跑台(淮北正华生物仪器有限公司)。
1.3 实验动物分组、脊神经背根损伤模型制备及运动训练方法所有大鼠随机分为3组各15只。训练组及手术组均采用脊神经背根神经节切除术制备脊神经背根损伤模型:将大鼠俯卧于手术台上,腹腔注射10%水合氯醛(0.3 mL/100 g)麻醉,常规备皮消毒。找到L4腰椎,沿后正中线偏右依次切开右侧背部皮肤及皮下筋膜,分离棘突旁肌肉,显现椎间孔,用咬骨钳咬除L4椎体上下的关节突关节以扩大手术野。分离显示背根神经节,依次切断并取出右侧L3、L4脊神经节,断端间距2 mm。逐层消毒缝合切口。假手术组不制备模型,仅咬除相应关节突,分离至观察到脊神经,不损伤脊神经。制模后每天肌肉注射青霉素4 万U/只,连续注射3 d,预防感染。正常饮食,自然光照。训练组于制模后7 d开始跑步训练,大鼠在ZH-PT型动物跑台上进行平板运动,速度为15 m/min,每隔5 min休息30 s,持续30 min,1次/d,共28 d。手术组与假手术组不进行跑台训练,自由活动。
1.4 大鼠痛觉阈值测定 采用北京拜安吉科技有限公司电子测痛仪Electric von-frey测定各组大鼠制模前1 d及制模1、7、14、21、28 d的痛觉阈值。将刚性测试头安装在探头上,在大鼠胫骨中点处施加压力,如果大鼠出现快速缩足或鸣叫,即为一次阳性反应,此时读出电子控制器上的数值即为痛觉阈值。每只大鼠测量5次,每次测量间隔时间为10 min,去除最大值、最小值,取平均值。
1.5 大鼠脊髓后角Ⅱ板层GFAP、Iba-1检测于制模7、14、28 d各组分别取5只大鼠,用4 ℃生理盐水200 mL及4%多聚甲醛300 mL进行心脏灌注,然后取出L3、L4节段脊髓,放入4%多聚甲醛液中固定,3 d后进行常规石蜡包埋。石蜡切片,切片厚度3 μm。一抗为GFAP单克隆抗体和Iba-1单克隆抗体,使用二步法超敏试剂盒做两步法染色,DAB显色,中性树胶封片。在200倍显微镜下对患侧脊髓后角拍照,拍照时设定相关拍摄参数,保证图像获取的一致性。使用Image-pro plus6.0软件勾画出脊髓后角Ⅱ板层,并将此区域设为AOI,获取脊髓后角Ⅱ板层的OD值。
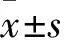
2 结果
2.1制模前后各组大鼠痛觉阈值比较见表1。
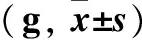
表1 制模前后各组大鼠痛觉阈值比较
注:与手术组比较,*P<0.05;与假手术组比较,△P<0.05;与同组制模前1 d比较,#P<0.05。
2.2各组大鼠脊髓后角Ⅱ板层GFAP OD值比较结果见表2。

表2 各组大鼠脊髓后角Ⅱ板层GFAP OD值比较
注:与手术组比较,*P<0.05;与假手术组比较,△P<0.05;与同组制模7 d比较,#P<0.05。
2.3各组大鼠脊髓后角Ⅱ板层Iba-1 OD值比较结果见表3。

表3 各组大鼠脊髓后角Ⅱ板层Iba-1 OD值比较
注:与手术组比较,*P<0.05;与假手术组比较,△P<0.05;与同组制模7 d比较,#P<0.05。
3 讨论
脊神经背根损伤多是由于车祸、手术、分娩等损伤后引起神经根受到牵拉,或出现脊柱损伤、骨折,从而使神经根受压甚至出现神经根断裂等原因所导致。脊神经背根损伤临床上常表现为患者感觉异常或丧失、患侧肢体无力等症状,甚至会出现病理性神经疼痛,严重影响患者的感觉功能、运动功能和生活质量。临床常用的治疗方式是通过手术对断开的神经进行缝合,或应用神经营养药物辅助治疗[8],但治疗效果并不理想。如何促进感觉功能的恢复是目前研究的热点。
神经损伤康复是建立在神经可塑性和功能重组的理论基础上的。运动训练作为一种康复方式,正是利用神经细胞所具有的可塑性,进行不断重复再学习的功能训练,从而实现一定的功能恢复。运动训练后,中枢神经系统产生的神经营养因子尤其是脑源性神经营养因子等增加[9],可以在一定程度上促进中枢神经的功能重塑。因此,运动康复训练被广泛应用于神经系统疾病的康复过程中。
痛觉作为感觉的一种类型,可以在一定程度上反映感觉系统的恢复程度。本文结果显示,脊神经背根损伤断后,手术组和训练组痛觉阈值升高,之后随时间推移逐渐降低,反映机体痛觉存在一定代偿机制。即当某一节段的神经节切除后,被切除神经节所支配区域的皮肤仍然存在一定的感觉,这是由于此重叠神经支配区域的其中一部分神经节的轴突失去作用时,与之相竞争的相邻神经的背根神经节起到维持该区域内的感觉传入作用[10,11]。而训练组制模痛觉阈值的升高明显低于手术组,提示运动训练在脊神经背根损伤后的早期就可以促进痛觉阈值的恢复。这可能与运动训练能提高内源性神经营养因子的表达,促进相邻节段脊髓内神经元的出芽,活化脊髓网络,形成代偿适应性的感觉传导旁路来传导感觉信息[12~14]有关。
另外,脊神经背根损伤后,激活的胶质细胞在中枢神经系统的病理变化中发挥重要作用[15,16],这也是代偿适应性感觉传导旁路形成的重要影响因素。有研究[17,18]表明,激活的胶质细胞会延缓神经通路的恢复和诱导非适应性的神经重塑。GFAP被认为是星形胶质细胞的标志物之一,其表达水平反映了胶质细胞的激活和胶质化的程度,并在一定意义上表明神经细胞损伤的程度[19,20]。星形胶质细胞的过度增生,可以使损伤局部产生瘢痕,阻止损伤神经的初级神经元轴突向远端生长。Iba-1为小胶质细胞活化的标志物之一,脊神经背根损伤可使小胶质细胞活化,活化后的小胶质细胞主动吞噬组织碎片,分泌炎性介质抑制轴突生长。有研究[21]表明,阻断小胶质细胞的激活及其活性物质的释放能显著减轻神经病理性疼痛症状,说明星形胶质细胞和小胶质细胞在感觉损伤后的修复过程中扮演着重要角色。本文结果显示,手术组脊髓后角Ⅱ板层GFAP、Iba-1 OD值增加,这与损伤后感觉功能显著下降相一致;训练组GFAP、Iba-1 OD值低于手术组,说明运动训练在一定程度上抑制了脊髓后角Ⅱ板层的胶质反应,从而减少胶质瘢痕形成,为脊髓突触的形成以及突触稳定性提供一个相对积极的“允许”环境,有利于代偿适应性感觉传导旁路的形成。
总之,运动训练可恢复脊神经背根损伤大鼠的痛觉功能,机制可能与其可抑制脊髓后角Ⅱ板层GFAP、Iba-1表达有关。
参考文献:
[1] Matsuura Y, Ohtori S, Iwakura N, et al. Expression of activating transcription factor 3 (ATF3) in uninjured dorsal root ganglion neurons in a lower trunk avulsion pain model in rats[J]. Eur Spine J, 2013,22(8):1794-1799.
[2] Wu L, Wu J, Chang HH, et al. Selective plasticity of primary afferent innervation to the dorsal horn and autonomic nuclei following lumbosacral ventral root avulsion and reimplantation in long term studies[J]. Exp Neurol, 2012,233(2):758-766.
[3] Kachramanoglou C, De Vita E, Thomas DL, et al. Metabolic changes in the spinal cord after brachial plexus root re-implantation[J]. Neurorehabil Neural Repair, 2013,27(2):118-124.
[4] Bozkurt A, Scheffel J, Brook GA, et al. Aspects of static and dynamic motor function in peripheral nerve regeneration: SSI and CatWalk gait analysis[J]. Behav Brain Res, 2011,219(1):55-62.
[5] Goel RK, Suri V, Suri A, et al. Effect of bone marrow-derived mononuclear cells on nerve regeneration in the transection model of the rat sciatic nerve[J]. J Clin Neurosci, 2009,16(9):1211-1217.
[6] 高晶晶,王玉阳,石浩,等.强化运动训练对脑缺血再灌注大鼠神经功能恢复及kalirin-7表达的影响[J].中华物理医学与康复杂志,2015,37(6):406-410.
[7] 周治来,陈银海,靳安民,等.运动训练对脊髓损伤大鼠Nogo-A、NgR mRNA表达的影响[J].中国康复医学杂志,2011,26(2):143-147.
[8] 侯红艳,刘诗翔.周围神经损伤康复治疗研究进展[J].临床军医杂志,2012,40(2):482-483.
[9] Park JS, Hoke A. Treadmill exercise induced functional recovery after peripheral nerve repair is associated with increased levels of neurotrophic factors[J]. PLoS One, 2014,9(3):e90245.
[10] Bajrovic F, Sketelj J. Extent of nociceptive dermatomes in adult rats is not primarily maintained by axonal competition[J]. Exp Neurol, 1998,150(1):115-121.
[11] Giaume C, Koulakoff A, Roux L, et al. Astroglial networks: a step further in neuroglial and gliovascular interactions[J]. Nat Rev Neurosci, 2010,11(2):87-89.
[12] Carlstedt T. Nerve root replantation[J]. Neurosurg Clin N Am, 2009,20(1):39-50.
[13] Benitez SU, Barbizan R, Spejo AB, et al. Synaptic plasticity and sensory-motor improvement following fibrin sealant dorsal root reimplantation and mononuclear cell therapy[J]. Front Neuroanat, 2014,8(10):96.
[14] Du Beau A, Shakya Shrestha S, Bannatyne BA, et al. Neurotransmitter phenotypes of descending systems in the rat lumbar spinal cord[J]. Neuroscience, 2012,227(1):67-69.
[15] Verkhratsky A. Physiology of neuronal-glial networking[J]. Neurochem Int, 2010,57(4):332-343.
[16] Papa M, De Luca CD, Petta F, et al. Astrocyte-neuron interplay in maladaptive plasticity[J]. Neurosci Biobehav Rev, 2014,42(5):35-54.
[17] De Leo JA, Tawfik VL, Lacroix-Fralish ML. The tetrapartite synapse: path to CNS sensitization and chronic pain[J]. Pain, 2006,122(1-2):17-21.
[18] 刘苏,沈光宇,吴勤峰,等.康复训练对脑损伤后大鼠神经功能及胶原纤维酸性蛋白和离子钙接头分子表达的影响[J].中华物理医学与康复杂志,2012,34(6):415-420.
[19] Eggers R, Tannemaat MR, Ehlert EM, et al. A spatio-temporal analysis of motoneuron survival, axonal regeneration and neurotrophic factor expression after lumbar ventral root avulsion and implantation[J]. Exp Neurol, 2010,223(1):207-220.
[20] Ozdemir M, Attar A, Kuzu I, et al. Stem cell therapy in spinal cord injury: in vivo and postmortem tracking of bone marrow mononuclear or mesenchymal stem cells[J]. Stem Cell Reviews, 2012,8(3):953-962.
[21] Takahashi Y, Nakajima Y. Dermatomes in the rat limbs as determined by antidromic stimulation of sensory C-fibers in spinal nerves[J]. Pain, 1996,67(1):197-202.
