XCRK基因在水稻与细菌性条斑病菌互作中的功能解析
2018-04-11张玉霞崔玉超
张玉霞,崔玉超,李 燕,周 丹,陈 亮*
(1.厦门大学 生命科学学院,厦门市植物遗传重点实验室,福建 厦门 361102;2.湖南理工学院化学化工学院,湖南 岳阳 414006)
水稻细菌性条斑病(bacterial leaf streak,BLS)是由Xanthomonasoryzaepv.oryzicola(Xoc)侵染引起的细菌性病害,简称细条病,现已成为威胁我国南方稻区水稻生产的重要病害[1-2].水稻BLS是1918年在菲律宾首次发现[3],而在中国则是20世纪50年代在广东省首次发现[4].该病引起的水稻产量损失通常为15%~25%,严重时可达40%~60%.抗病育种是水稻BLS防治的重要方法之一,因此,挖掘并分离抗病基因,进而培育抗逆品种有着非常重要的意义[5-7].
用蛋白质组学的方法分析Xoc侵染的水稻叶片蛋白表达的差异,从中鉴定差异表达的蛋白,是一种研究水稻与Xoc互作分子机制的重要方法,有望从中鉴定出参与水稻和Xoc互作的重要蛋白,包括参与水稻防御反应的重要蛋白,进而获得相应编码基因[8],这有助于加深对水稻BLS防御信号网络组分的认识,为进一步探讨水稻与Xoc互作的分子机制奠定基础.
XCRK(Xoc-associatedreceptor-likekinase)基因是本课题组(指第一单位,下同)在水稻BLS侵染应答的差异蛋白质组学研究中发现的一个拟抗病基因,其GenBank登录号为AK120121.本研究在对该基因进行生物信息学分析的基础上,分别构建超量表达和RNA干扰(RNAi)抑制表达载体,并分析转基因植株对BLS的抗性,为进一步探讨转基因植株抗性增强的分子机理奠定基础.
1 材料与方法
1.1 材 料
所用水稻(OryzasativaL.)为粳稻品种台北309(TP309),由本课题组保存;克隆菌株为大肠杆菌(Escherichiacoli)DH5α菌株、根癌农杆菌(Agrobacteriumtumefaciens)EHA105菌株;所使用的载体包括采用Gateway技术克隆的中间载体pENTRTM/D-TOPO(Invitrogen,上海),超量表达载体pH7WG2、RNAi抑制表达载体pH7GWIWG2(Ⅱ)和组织表达分析载体pMDC164(本课题组保存).
1.2 方 法
1.2.1水稻材料的培养及取样
TP309水稻种子经浸泡催芽后,播种于固定在保鲜盒的纱布上,保鲜盒内保持一定水面(以浸湿纱布为准).将这些水稻幼苗置于28 ℃、16 h光照/8 h黑暗条件下生长,每3 d换一次水并添加1/10体积的MS培养液以保持幼苗正常生长.取四叶期幼苗及其根和叶,以及孕穗期植株的根、叶、茎、叶鞘、茎节和花序,用于组织表达分析.所有采集样品立即用液氮速冻后置于-80 ℃下保存备用.
表1 本研究所用引物
Tab.1 Primers used in this study

名称序列(5'→3')用途XCRK-FCACCGAAGATCTATGTTTCTGAAGACATATGG超量表达载体构建XCRK-RCGCGGTAACCCTAAATCACAAGTTGATTTTXCRKi-FCACCCCGAAGTTAAGAAGATAGCG抑制表达载体构建XCRKi-RAAATTCCGAGAATATAGTTCXCRKpro-FCACCACCCACAAGGTAGAATCAC启动子片段扩增XCRKpro-RTGATGTCTGAGGCTCTGAGCAGXCRK-rq-FCCTCGGGCTATGCCTAAT基因转录水平检测XCRK-rq-RGAACACGACGGGCTTTAAActin-rq-FTGTATGCCAGTGGTCGTACCA实时荧光定量PCR(qRT-PCR)内参Actin-rq-RCCAGCAAGGTCGAGACGAA
1.2.2水稻基因组DNA和总RNA的提取及逆转录
取四叶期水稻幼苗,采用十六烷基三甲基溴化胺(CTAB)法提取基因组DNA,采用Trizol试剂(Invitrogen,上海)提取不同组织的总RNA,按照逆转录试剂盒(Invitrogen,上海) 说明书利用M-MLV反转录酶(TaKaRa,大连)合成cDNA第一链.
1.2.3水稻幼苗的胁迫处理
非生物胁迫处理参照Xiang等[9]的方法,取四叶期水稻幼苗分别进行以下处理:高盐胁迫采用150 mmol/L NaCl溶液浸泡幼苗根部;干旱胁迫将正常生长的幼苗根部浸泡于20%(质量分数)聚乙二醇 (PEG) 溶液中;低温胁迫将幼苗转移至4 ℃的光照培养箱中;H2O2处理采用1% (体积分数)H2O2溶液浸泡幼苗根部并喷洒叶片.植物激素处理参照Song等[10]的方法,分别用乙烯前体 (ACC)、生长素 (IAA)、脱落酸(ABA)、赤霉素 (GA3) 以及水杨酸 (SA) 溶液喷洒幼苗叶片,激素质量浓度均为100 μmol/L.上述4种非生物胁迫和5种植物激素处理均在处理0,1,2,4,8,12,24 和48 h时分别取样,用液氮速冻后置于-80 ℃下保存备用.
1.2.4引物设计与载体构建
根据水稻XCRK基因序列,使用 Primer Premier 5.0设计特异引物(见表1)用于基因表达水平检测与载体构建.以四叶期水稻基因组DNA为模板,扩增XCRK基因启动子片段,用于XCRK基因组织表达分析载体构建;以XCRK基因全长cDNA为模板,扩增用于构建超量表达和抑制表达载体的目的基因平末端产物,所得产物再与pENTRTM/D-TOPO 载体进行 TOPO 反应,PCR 检测目的基因片段是否插入pENTRTM/D-TOPO 载体,将含有阳性克隆质粒的菌液送Invitrogen 公司测序验证.
1.2.5根癌农杆菌介导的遗传转化
水稻成熟种子去除稻壳后消毒,将消毒的种子接种于诱导培养基N6D上,28 ℃黑暗条件下诱导培养2周,然后挑选诱导的愈伤组织在新鲜的N6D上继代培养;挑选生长旺盛的愈伤组织置于根癌农杆菌悬浮液中,于23 ℃黑暗条件下共培养3 d;取共培养的愈伤组织用无菌水洗净根癌农杆菌悬浮液后,转移至筛选培养基N6S上,置于28 ℃黑暗条件下培养至长出抗性愈伤组织;将抗性愈伤组织转移至分化培养基RGH上,置于23 ℃、16 h光照/8 h黑暗条件下培养直至长出绿色再生苗;将已分化的再生苗转移至生根培养基1/2MS上培养,让其根系充分生长.
1.2.6qRT-PCR检测XCRK基因表达水平
采用RNAprep pure 植物总 RNA 提取试剂盒 (北京天根生化科技有限公司) 提取野生型和转基因水稻植株成熟叶片的总 RNA;用 Invitrogen 公司的反转录试剂盒进行反转录.取反转录后的cDNA为模板,以水稻Actin基因作为内参,用qRT-PCR 检测目的基因的表达水平.反应体系为:2×SYBR®Premix ExTaqTMⅡ5 μL,上、下游引物各0.4 μL,cDNA模板1 μL,ROX Reference Dye 0.2 μL,用ddH2O补足至10 μL.反应程序为:95 ℃预变性30 s;95 ℃变性5 s,60 ℃退火30 s,40个循环,在每个循环72 ℃延伸最后5 s进行荧光采集.每个样品3个重复,每个实验重复3次.采用2-ΔΔCT方法[11]进行目的基因相对表达量分析.
1.2.7β-葡萄糖醛酸酶(GUS)组织化学分析
分别取正常生长条件下XCRK基因启动子融合GUS基因的不同转基因株系(至少 3株)的各组织器官,浸入 GUS 染色液中于 37 ℃恒温箱中过夜染色,倒去染色液后先加入 95%(体积分数,下同)乙醇脱色,再用 75%乙醇脱色后观察并拍照记录[12].
100 mL GUS 染色液配方为:50 mmol/L NaH2PO4,50 mmol/L Na2HPO4,10 mmol/L 乙二胺四乙酸二钠(EDTA),0.1%(体积分数)TritonX-100,0.65 mg/mL K3Fe(CN)6,0.85 mg/mL K4Fe(CN)6,1 mg/mL X-gluc,100 μg/mL 氯霉素,pH 7.0.配制好的GUS 染色液于4 ℃下贮存.
1.2.8BLS致病菌Xoc的接种
预先将Xoc强毒力菌株RS105在NA平板(加利福平至终质量浓度为100 μg/L)上划线培养2~3 d,然后用无菌水洗下菌体,配制细胞密度为1×108mL-1左右的菌液,最后加Tween-20至终体积分数为0.1%(下同),混匀备用.接种时间选择在8月,用上述菌液和无菌水(含0.1% Tween-20)分别在分蘖期水稻完全展开的叶片上用针刺法接种,在叶脉的两侧以及靠叶鞘端、中间和叶尖端分别扎针接种.
1.2.9生物信息学分析
利用NCBI(http:∥www.ncbi.nlm.nih.gov/)、RiceXPro(http:∥ricexpro.dna.affrc.go.jp/index.html)和RGAP(http:∥rice.plantbiology.msu.edu)数据库查找目的基因序列和注释信息;利用PLACE (http:∥www.dna.affrc.go.jp/PLACE/) 数据库提供的在线工具对目的基因上游启动子区的顺式作用元件进行预测;利用Genevestigator(https:∥genevestigator.com/)数据库分析XCRK基因在各种逆境处理下的表达情况;利用NCBI 中的 BLAST(http:∥blast.ncbi.nlm.nih.gov/)进行在线序列同源性检索;利用 NCBI 网站的CCD(conserved domains)程序对蛋白质保守结构域进行预测;利用ClustalX(http:∥bioinformatics.ubc.ca/resources/tools/clustalx)进行多重序列比对.
2 结果与分析
2.1 XCRK基因及其编码蛋白质的生物信息学分析
利用PLACE数据库对XCRK基因编码区上游约1 kb的启动子序列进行分析,结果显示该序列中含有大量的顺式作用元件,其中包括多个非生物胁迫和激素响应元件:干旱响应元件(DRE)6个,MYB结合位点(MYBRS)12个,MYC结合位点(MYCRS)5个,ABA响应元件(ABRE)4个,生长素响应元件(AuRE)4个,病原体响应元件2个以及NPR1响应元件5个(图1(A)).因此,推测XCRK基因可能参与了水稻的多种生物学过程,并在胁迫应答过程中发挥作用.
搜索RGAP数据库获得XCRK基因及其编码蛋白的信息,结果显示该基因位于水稻1号染色体上,编码一个含有322个氨基酸的蛋白激酶 (图1(B)).利用NCBI网站的CCD程序对XCRK基因编码的蛋白进行保守结构域预测,结果表明该蛋白含有一个保守的S/TKc结构域.使用ClustalX进行多重序列比对,结果显示XCRK蛋白的S/TKc结构域在水稻中有一个同源蛋白Os01g0115900,序列相似性高达84%;此外XCRK蛋白与水稻的Lr10蛋白,燕麦(Avenasativa)的LRK9和LRK45蛋白,小麦(Triticumaestivum)的 LRK14和Lr10同源蛋白及大麦(Hordeumvulgare)的 LRK10蛋白都有着高度相似性(见附录图S1,http:∥jxmu.xmu.edu.cn/upload/html/20180208.html).
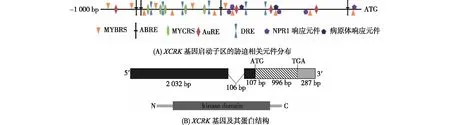
黑色框、灰色框和斜纹框分别为 5′-非编码区、3′-非编码区和编码区,ATG和TGA分别为翻译起始密码子和终止密码子,kinase domain为蛋白激酶结构域.图1 XCRK基因及其编码蛋白质的生物信息学分析Fig.1 Bioinformatic analysis of XCRKgene and the coding protein
2.2 XCRK基因在水稻不同组织中的表达分析
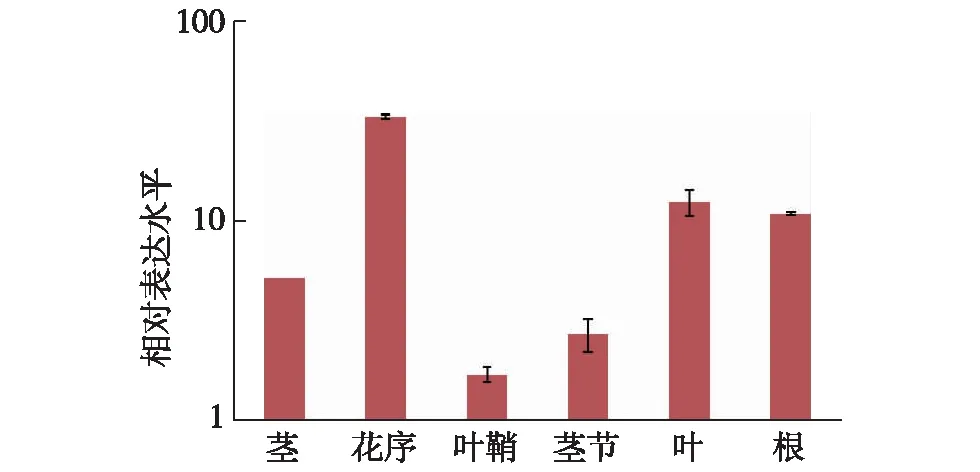
图2 qRT-PCR检测XCRK基因在不同组织中的表达Fig.2 Expression analysis of XCRK gene in different tissues by qRT-PCR
为了探究XCRK基因的表达是否具有组织特异性,利用qRT-PCR技术检测了XCRK基因的组织表达谱.结果如图2所示:XCRK基因在根、茎、叶、花序、茎节和叶鞘中均有表达,其中根、叶、花序和茎中的表达量明显高于其他组织,具体表现为花序中的表达量最高,根和叶中的表达量次之,茎节和叶鞘中的表达量较低.
为了进一步检测XCRK基因的组织表达模式,选取组织表达分析转基因植株的幼苗和生殖期成株的不同组织进行GUS活性检测,结果如图3所示:GUS活性在T0代幼苗的根、叶鞘、叶、稃片、花药和发育的种子中均有表达,与qRT-PCR检测显示在叶中的高表达相比,转基因植株叶中仅检测到较弱的GUS活性,这可能与qRT-PCR的高度灵敏性有关.由上述结果可知XCRK基因的表达具有一定的组织特异性.

(A)根;(B)叶鞘;(C)叶片;(D)稃片及花药;(E)发育的种子.图3 组织表达分析转基因植株的GUS活性检测Fig.3 GUS activity analysis of tissue-specific expression transgenic plants
2.3 XCRK基因的逆境表达模式分析
Genevestigator和RiceXPro公共数据库显示,XCRK基因的表达受到多种胁迫的影响.本研究利用qRT-PCR检测了该基因在不同非生物逆境胁迫下的表达谱,结果如图4(A)所示:XCRK基因显著被高盐和H2O2诱导,表达量在高盐处理12 h时提高约5.5倍,在H2O2处理24 h时提高约1.5倍;在干旱胁迫下,XCRK基因的响应不明显,表达水平略有降低;在4 ℃低温处理下,XCRK基因在胁迫1~8 h内快速下调至较低水平,12 h时被快速诱导而呈现高水平表达.
同时分析了四叶期的水稻幼苗在不同植物激素处理下XCRK基因的表达谱,结果如图4(B)所示:在ABA处理8 h时,XCRK基因表达量提高约4.5倍;在GA3和ACC处理下没有明显变化;而在SA处理下,1~8 h时没有明显变化,12 h时XCRK基因表达量有所提高,24 h时提高约4倍;在IAA处理下,XCRK基因表达水平总体呈现先下降后上升的趋势,在IAA处理2 h时显著下调至最低水平,4 h时表达量有所提高,12 h时最高,约提高12倍.以上结果表明XCRK基因的表达受高盐、H2O2和ABA的显著诱导,由此推测XCRK基因可能在植物的高盐胁迫、氧化胁迫等应答过程中发挥作用.
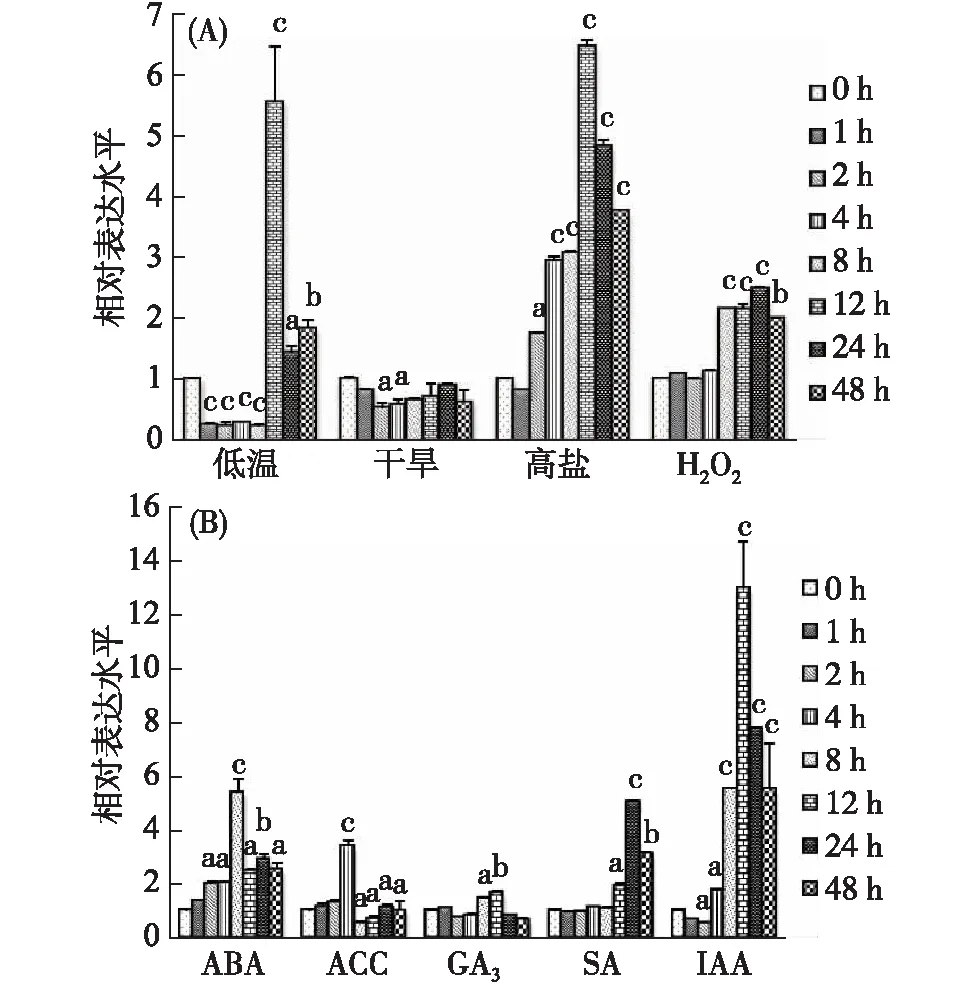
与同组0 h(初始状态)比较(t-检验),a.表示差异显著(p<0.05),b.表示差异很显著(p<0.01),c.表示差异极显著(p<0.001),下同.图4 XCRK基因在不同非生物胁迫(A)及植物激素处理(B)下的表达模式Fig.4 Expression profiles of XCRK gene in response to different abiotic stresses (A) and plant hormones (B)
2.4 转基因植株的获得与鉴定
通过根癌农杆菌介导的转化方法,分别将构建好的XCRK基因超量表达和抑制表达重组质粒导入 TP309 中,获得相应的转基因植株.取19株PCR鉴定为阳性的XCRK基因超量表达T0代转基因植株(分别命名为OE1~19),通过qRT-PCR检测目的基因XCRK的表达水平,结果显示:相对于野生型(WT)植株,XCRK基因在所选转基因植株中的表达量均有不同程度的提高,其中株系OE3和OE8的表达量较高(图5(A)),故选取其作为后续实验材料.同样地,选取10棵PCR鉴定为阳性的XCRK基因抑制表达T0代转基因植株(分别命名为RNAi1~10),并检测目的基因XCRK的表达水平,结果显示:相对于WT植株,XCRK基因在所选植株中的表达量均有不同程度的下降,选取表达量下降较大的株系RNAi2和RNAi8(图5(B))作为后续实验材料.
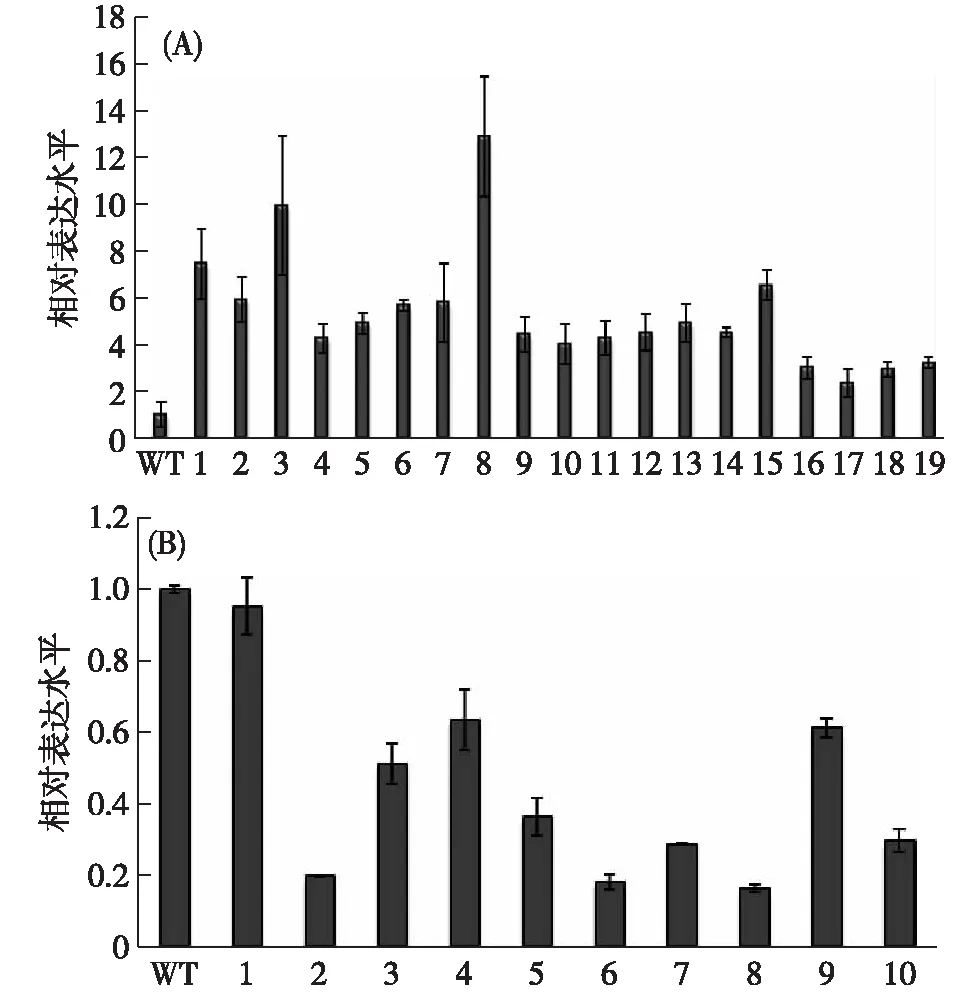
(A)中1~19分别对应OE1~19,(B)中1~10分别对应RNAi1~10.图5 XCRK基因超量表达(A)和抑制表达(B)转基因植株的表达水平分析Fig.5 Exprssion analysis of XCRK gene over-expression (A) and RNAi (B) transgenic lines
2.5 转基因植株对Xoc的抗性
依据T0代植株的鉴定结果,选取超量表达效果明显的OE3和OE8植株以及抑制表达效果明显的RNAi2和RNAi8 植株,通过qRT-PCR分析XCRK基因在T1代超量、抑制表达转基因植株中的相对表达水平,结果如图6(A)所示,可见所选植株中XCRK基因的表达情况与T0代植株中基本一致.在分蘖期对水稻植株进行接菌实验,结果如图6(B)所示:接菌10 d后,超量表达转基因植株OE3的病斑长度明显比WT植株的短,而抑制表达转基因植株RNAi2的病斑长度则略长于WT植株.在接菌10和15 d后分别统计分析不同超量、抑制表达转基因植株和WT植株的病斑长度,结果如图6(C)所示:接菌10 d后,2株超量表达转基因植株的平均病斑长度分别为2.5和2.1 mm,显著短于WT植株 (p<0.01),其中OE8与WT的差异极显著(p<0.001);抑制表达转基因植株则表现出相反的表型,2株T1代抑制表达转基因植株病斑长度分别为4.1和3.8 mm,均略长于WT植株,但差异不显著(p>0.05).接菌15 d后,OE3(4.0 mm)、OE8(3.6 mm) 与WT(6.5 mm)相比,病斑长度均达到极显著差异(p<0.001),而RNAi2和RNAi8与WT相比差异仍不显著(p>0.05).由此可见,T1代XCRK超量表达转基因植株对Xoc的抗性明显增强,而抑制表达转基因植株的抗性则变化不明显.
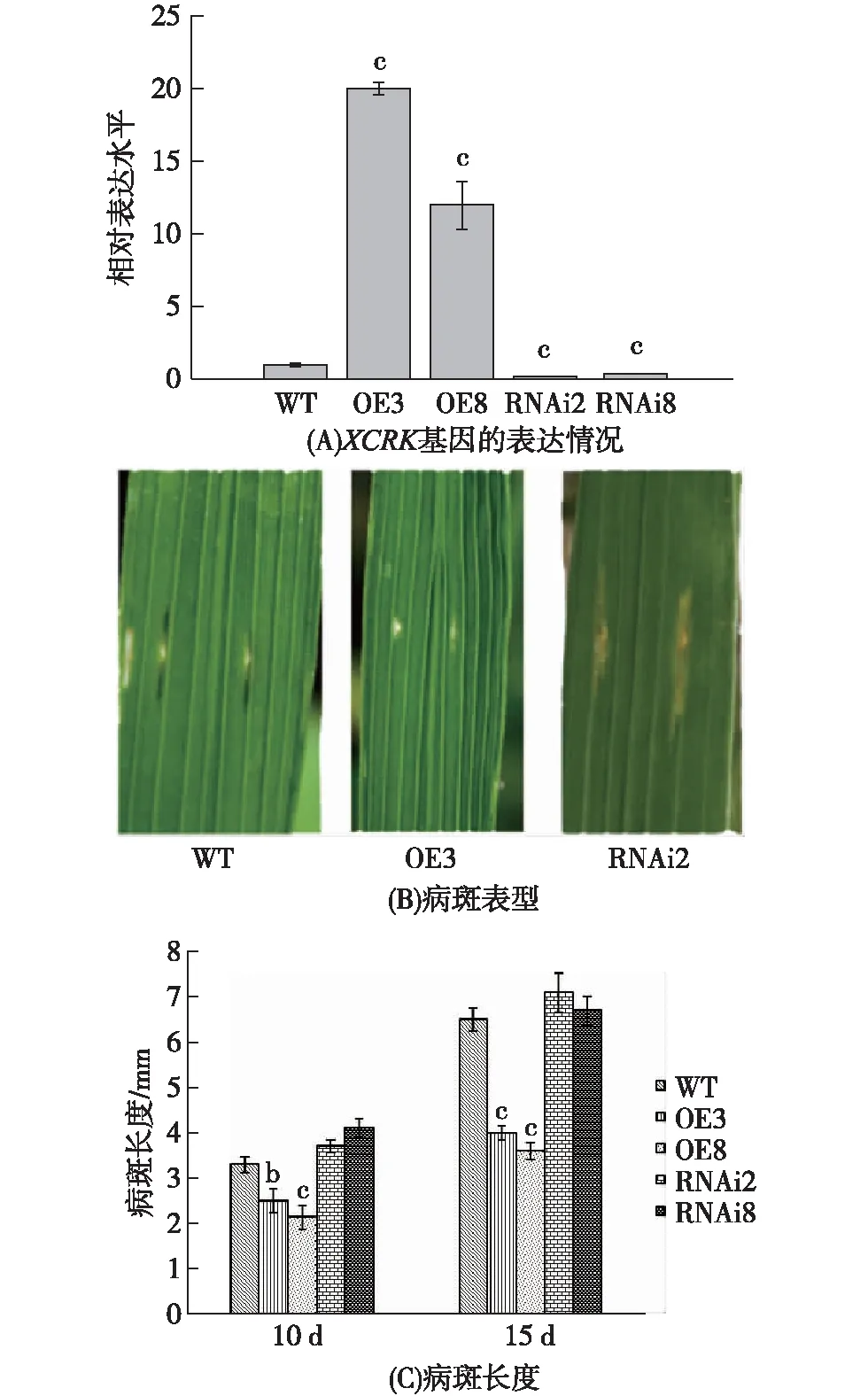
图6 T1代XCRK超量、抑制表达转基因植株对Xoc的抗性Fig.6 Resistant acitivity of T1 XCRK gene over-expression and RNAi transgenic plants upon Xoc challenge
3 讨 论
植物在生长发育过程中,不断感受外界生物和非生物因子的刺激,引发一系列信号转导途径,激活防御基因的表达,来避免或减轻由此带来的伤害.许多植物类受体激酶基因在病原菌侵染时被诱导表达.拟南芥(Arabidopsisthaliana)RBK1基因的表达受病原菌致病疫霉(Phytophthorainfestans)和灰霉葡萄孢菌(Botrytiscinerea)的诱导,RBK1蛋白通过与Rop GTPase互作参与植物生长和病原菌防御反应[13].Royo等[14]报道玉米(Zeamays)ZmLrk-1基因编码一个类受体激酶,受病原真菌尖孢镰刀菌(Fusariumoxysporum)的诱导,参与真菌病原菌的防御反应.在本研究中,XCRK基因在Xoc侵染激发的防御反应中被诱导表达,这为XCRK基因参与水稻对Xoc的防御反应提供了证据.XCRK基因被诱导表达后,是否会进一步调控下游基因表达有待后续实验的验证.
植物免疫系统的激活依赖于植物抗性蛋白对病原菌的识别,这一识别过程通常会伴随强烈的免疫反应,即局部程序性细胞死亡[15],这是植物普遍具有的一种抗病反应[16-17],以此保护植物免受病原菌侵染[18].在此过程中氧爆发(oxygen burst)导致活性氧中间体(ractive oxygen species,ROS)产生,对入侵病原物有直接杀死作用[19].本研究中发现XCRK基因的表达明显受到H2O2的诱导,后续可通过对转基因植株在Xoc侵染下的生理变化,进一步研究XCRK基因是否通过抗氧化途径来抵御Xoc的侵染.
XCRK基因编码胞质类受体激酶,超量表达XCRK基因的T1代转基因水稻对Xoc的抗性明显增强,抑制XCRK基因表达的T1代转基因水稻对Xoc的敏感性也略增强,表明XCRK基因是水稻对Xoc抗性的正调控因子.综上所述,XCRK基因在水稻和Xoc的互作中发挥重要作用,参与调控水稻对BLS的抗性,并响应多种防御信号.这为进一步解析Xoc侵染下复杂的水稻防御信号网络奠定了基础.
参考文献:
[1]DEAN R,VAN K J,PRETORIUS Z A,et al.The Top 10 fungal pathogens in molecular plant pathology[J].Mol Plant Pathol,2012,13:414-430.
[2]王汉荣,谢关林.水稻细菌性条斑病研究进展[J].农牧情报研究,1992(3):31-34.
[3]许志刚,钱菊梅.水稻细菌性条斑病适生性与控制研究进展[J].植物检疫,1995,9(4):239-244.
[4]范怀忠,伍尚忠.广东水稻细菌性条斑病的发生和为害情况调查[J].植物保护,1965,9(4):137-139.
[5]徐建龙,王汉荣,林贻滋,等.水稻细菌性条斑病和白叶枯病抗性遗传研究[J].遗传学报,1997,24(4):330-335.
[6]唐定中,李维明,吴为人.水稻细菌性条斑病的抗性遗传[J].福建农业大学学报,1998,27(2):133-137.
[7]周明华,许志刚,粟寒,等.两个籼稻品种对水稻细菌性条斑病抗性遗传的研究[J].南京农业大学学报,1999,22 (4):27-30.
[8]GUO L,LI M,WANG W,et al.Over-expression in the nucleotide-binding site-leucine rich repeat geneDEPG1 increases susceptibility to bacterial leaf streak disease in transgenic rice plants[J].Mol Biol Rep,2012,39(4):3491-3504.
[9]XIANG Y,HUANG Y M,XIONG L Z.Characterization of stress-responsiveCIPKgenes in rice for stress tole-rance improvement [J].Plant Physiology,2007,144(3):1416-1428.
[10]SONG Y,YOU J,XIONG L Z.Characterization ofOsIAA1 gene,a member of rice Aux/IAA family involved in auxin and brassinosteroid hormone responses and plant morphogenesis [J].Plant Molecular Biology,2009,70(3):297-309.
[11]HORTON R M,CAI Z L,HO S N,et al.Gene splicing by overlap extension:tailor-made genes using the polymerasechain[J].Biotechniques,1990,8(5):528-535.
[12]JEFFERSON R A,KAVANAGH T A,BEVAN M W.GUS fusions:β-glucuronidase as asensitive and versatile gene fusionmarker in higher plants [J].The EMBO Journal,1987,6(13):3901-3907.
[13]MOLENDIJK A J,RUPERTI B,SINGH M K,et al.A cysteine-rich receptor-like kinase NCRK and a pathogen-induced protein kinase RBK1 are Rop GTPase interactors [J].Plant J,2008,53(6):909-923.
[14]ROYO J,GOMEZ E,BALANDIN M,et al.ZmLrk-1,a receptor-like kinase induced by fungal infection in germinating seeds [J].Planta,2006,223(6):1303-1314.
[15]CESARI S,KANZAKI H,FUJIWARA T,et al.The NB-LRR proteins RGA4 and RGA5 interact functionally and physically to confer disease resistance [J].The EMBO Journal,2014,33(17):1941-1959.
[16]CHEN K,DUL,CHEN Z.Sensitization of defense res-ponses and activation of programmed cell death by a pathogen-induced receptor-like protein kinase inArabidopsis[J].Plant Mol Biol,2003,53(1/2):61-74.
[17]DODDS P N,LAWRENCE G J,CATANZARITI A M,et al.Direct protein interaction underlies gene-for-gene specificity and coevolution of the flax resistance genes and flax rust avirulence genes [J].Proceedings of the National Academy of Sciences of the United States of America,2006,103(23):8888-8893.
[18]MA Y Y,GAN R,WANG N N.Biological functions of leucine-rich repeat class of receptor-like protein kinases in plants [J].Journal of Plant Physiology and Molecular Biology,2005,31(4):331-339.
[19]CAPLAN J,PADMANABHAN M,DINESH-KUMAR S P.Plant NB-LRR immune receptors:from recognition to transcriptional reprogramming [J].Cell Host & Microbe,2008,3(3):126-135.
