杨树枝条不同施用方式对宁夏沙化土壤性质的短期影响
2018-04-11李志刚李金林
庞 飞, 李志刚, 李 健, 李金林
(1.宁夏大学 生命科学学院, 银川 750021; 2.宁夏大学 农学院, 银川 750021;3.宁夏林业研究院 种苗生物工程国家重点实验室, 银川 750004)
作为土壤退化的一种形式,沙漠化成为影响中国社会经济和生态环境发展的重要问题之一。在中国有近4亿人受沙漠化的危害,沙漠化主要发生在干旱半干旱地区[1],地处中国干旱半干旱地区的宁夏同样受到沙漠化的影响。宁夏的沙漠化面积占宁夏国土面积的24.3%,并且占宁夏国土面积47.17%的天然草地的土壤质量并不高,且有向沙漠化发展的趋势,这意味着在宁夏沙漠化的治理仍是一项任重而道远的工作。土壤有机碳含量的下降被认为是土壤沙漠化最主要的表征指标[2]。有机碳的下降会使田间持水率下降[3-4],尤其在干旱半干旱地区,加上较大的田间水分蒸发量,使田间水分进一步的下降。同时造成的土壤物理结构的恶化,会威胁土壤微生物的生存以及造成养分的流失[5-6]。因此改良沙化土地,首要措施是提高土壤中的有机碳[7]。近些年相关研究主要利用秸秆、凋落物、其他有机物料改良土壤,提高土壤有机碳含量[8-9]。而少见利用林木废弃物改良土壤的研究。防护林的建设是宁夏进行沙漠化治理的一项重要举措,特别是以杨树(PopulusL.)为主的三北防护林和农田防护林在宁夏广泛分布[10],为遏制当地沙漠化起到了重要的作用,但这些防护林每年产生的大量林木修剪物多被焚烧或掩埋,造成了环境污染和资源的极大浪费。而关于林木枝条对沙化土壤的改良的报道则较少,本试验以宁夏最常见的杨树枝条为材料,通过模拟试验将枝条以不同形式施入沙化土壤,通过分析研究其对沙化土壤的物理、化学及微生物性质的影响,以期为当地沙化土壤改良与林木废弃物循环利用提供理论基础。
1 材料与方法
1.1 研究区概况
试验区位于贺兰山东麓银川腹部沙地(106°08′—107°22′E,38°28′—38°42′N,海拔约1 115 m),地处我国西北内陆,其西、北面分别是腾格里沙漠和乌兰布和沙漠,中部是毛乌素沙地。主要气候特点是昼夜温差大、雨雪稀少、蒸发强烈、气候干燥、风大沙多等,为中温带半干旱大陆性气候,是宁夏的沙漠化地区。年均气温10.1℃,年均降水量181.2 mm,年均蒸发量1 882.5 mm。1月份平均最低气温-15.2℃,极端最低气温-27.9℃,7月份平均最高气温30.1℃,极端最高气温37.2℃,土壤pH值9.07,有机质含量为1.14 g/kg、全氮含量0.11 g/kg、全磷含量0.08 g/kg、全钾含量14.51 g/kg[11]。
1.2 试验设计
本研究于2013年3月在宁夏林业研究院种苗生物工程国家重点实验室试验基地完成试验布置,供试土壤为银川腹部沙地的沙化土壤,杨树枝条收集于当地的防护林,收集到的枝条晒干后去除叶片后备用。试验设5个处理(各处理凡是覆盖的均为2 cm厚,凡翻埋的其添加量均为土壤质量的5%):对照(CK),即不做任何处理;未粉碎枝条表施(UBM),覆盖2层树枝,两层呈纵横交错状,覆盖厚度为2 cm;粉碎枝条表施(GBM)即土表覆盖约2 cm的杨树粉碎枝条(粉碎至长度为0.5 cm左右);粉碎枝条混施(GBI),即土壤0—20 cm翻埋5%(质量比)的杨树粉碎枝条;混施粉碎枝条+表施未粉碎枝条(GBI+UBM),即在土壤混施粉碎枝条(5%)的基础上土表覆盖2 cm 的未粉碎枝条,覆盖度为60%~70%。先将采集于研究区沙化地的土壤混匀以保证土壤性质一样,然后将土添加到基地内长×宽×深:1 m×1 m×2 m的水泥池(池内之前的土壤已清理干净)。试验均在水泥池中进行。水泥池先埋入直径为15 cm、高度为23 cm且底部不封闭的PVC管。随后杨树枝条按照试验方案处理沙化土壤,混合材料均装于直径为10 cm、高度为23 cm且底部封闭的PVC容器中,材料装置深度为20 cm。所有PVC容器最后全部放置于直径为15 cm的PVC管中。每个处理4个重复,处理随机区组排列,每个处理浇水的量依照宁夏当地的降雨量。
1.3 土样采集与处理
于2014年4月将内桶移至室内解冻。将土样混匀后取约500 g土装入无菌密封袋,一部分土样去除可见枝条残体,过2 mm不锈钢无菌筛后保存于4℃冰箱中用于测定微生物活性指标。一部分土样自然风干后过1 mm筛用于有机碳、全氮及其他理化性质的测定。
1.4 测定指标与方法
土壤物理性质指标:土壤密度、总孔隙度、田间持水率和土壤含水量采用环刀法采集原状土,带回实验室一次性测定[12]。
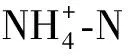
土壤微生物性质指标:微生物量碳、氮的测定采用氯仿熏蒸浸提法[16]。过氧化氢酶的测定采用高锰酸钾滴定法[17],纤维素酶的测定采用3,5—二硝基水杨酸比色法[17];脲酶的测定采用苯酚钠—次氯酸钠比色法[17]。土壤可培养微生物(细菌、真菌、放线菌)采用稀释平板法测定[14]。
1.5 数据分析
利用Microsoft Excel 2007建立数据库及绘图。采用SPSS 19.0进行单因素方差分析、相关分析及主成分分析。
2 结果与分析
2.1 杨树枝条表施与混施对土壤物理特性的影响
表1所示杨树枝条不同处理方式对沙化土壤物理性质影响不同。与CK相比,UBM和GBM的土壤密度和田间持水率均无显著差异,但两处理都显著提高了土壤总孔隙度和土壤含水量,其中GBM较CK土壤含水量显著提高了5.75倍(p<0.05)。与CK相比,GBI与GBI+UBM对土壤含水量无显著变化,但GBI较CK土壤密度显著降低了15.17%(p<0.05),土壤总孔隙度和田间持水率分别显著提高了35.64%和101.05%(p<0.05)。GBI+UBM较CK处理的土壤密度显著降低了14.48%(p<0.05),土壤总孔隙度和田间持水率分别显著提高了31.17%和105.23%(p<0.05),而GBI+UBM与GBI之间土壤物理性质差异不显著。
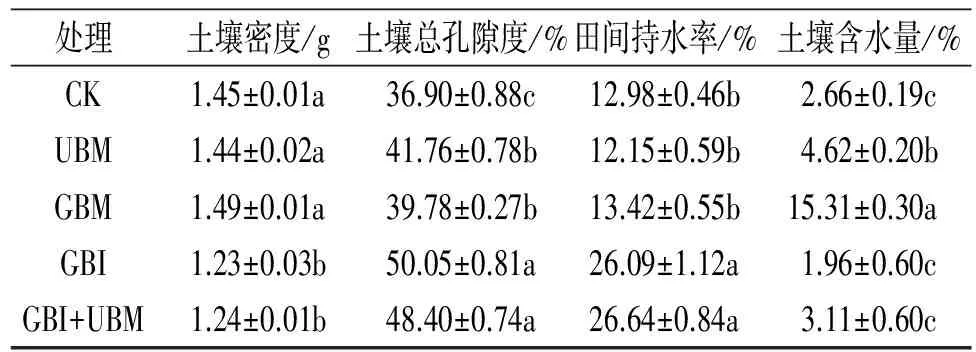
表1 杨树枝条表施与混施下沙化土壤的物理性质
注:不同字母表示同一时期不同处理间差异显著(p<0.05),下表同。
2.2 杨树枝条表施与混施对土壤化学特性的影响
如表2所示,与CK相比,GBI与GBI+UBM有降低土壤pH值趋势,其中GBI显著降低了土壤pH值(p<0.05),UBM与GBM有增加土壤pH值趋势,UBM显著增加了土壤pH值(p<0.05)。杨树枝条不同处理方式对土壤养分含量的影响亦不同。各处理对土壤养分有不同程度的提高。与CK相比,GBI和GBI+UBM显著提高了有机碳、速效钾、无机氮、碱解氮含量(p<0.05),并且GBI+UBM较GBI显著提高了有机碳、无机氮、速效钾含量(p<0.05),分别提高了7.32%,10.55%,11.74%。UBM和GBM与CK相比显著提高了全钾含量(p<0.05),且GBM较UBM全钾显著提高了4.15%(p<0.05)。总体上各处理对土壤养分含量的提高幅度呈GBI+UBM>GBI>GBM>UBM>CK趋势。
2.3 杨树枝条表施与混施对土壤微生物活性的影响
土壤微生物是衡量土壤肥沃程度的重要指标,表3数据显示,各处理均不同程度提高土壤中微生物数量。GBI,GBI+UBM与CK相比均显著提高了微生物数量(细菌、放线菌、真菌)、微生物量氮、微生物量碳(p<0.05),而且GBI+UBM的细菌、真菌、放线菌、微生物量碳含量较GBI的分别显著提高了14.54%,16.67%,11.11%,12.54%(p<0.05),与CK相比,UBM和GBM除对放线菌显著提高外(p<0.05),对其他微生物数量及微生物量碳、氮均无显著提高。土壤酶是土壤生物化学过程中的重要因子,本试验各处理间脲酶、纤维素酶活性规律同微生物数量的变化规律一致,与CK相比各处理间过氧化氢酶活性则无显著差异。总体上处理间对土壤微生物性质的影响呈GBI+UBM>GBI>GBM>UBM>CK趋势。
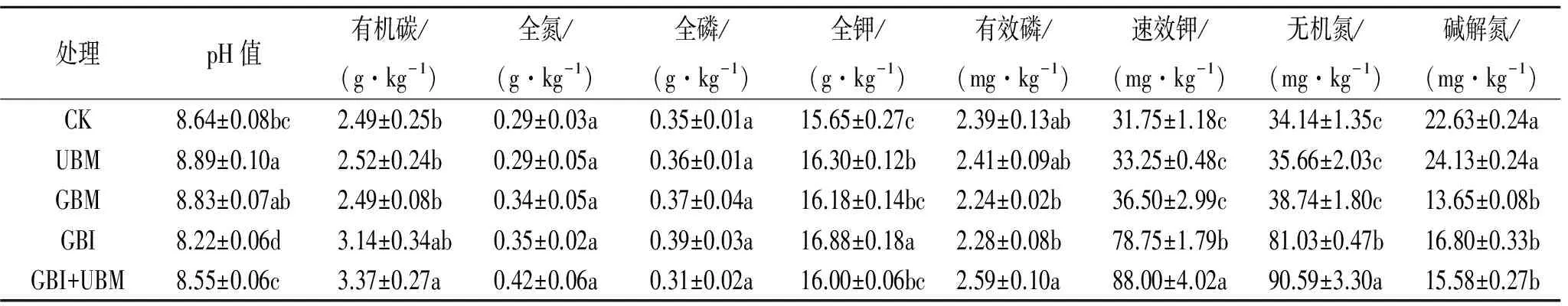
表2 杨树枝条表施与混施下沙化土壤的化学性质

表3 杨树枝条表施和混施下土壤的微生物活性
2.4 杨树枝条表施与混施对土壤质量的综合评价
采用上述各生理生化指标评价沙化土壤的改良效果具有一定的局限性,因为各处理的众多指标并非均向同一方向变化,因此需要对各处理的指标做综合分析,以便直接观察土壤改良的综合效果,本文采用隶属函数结合因子分析的方法算出各种处理的土壤质量综合评价指数,以便整体宏观地观察土壤的变化,主成分的特征值和贡献率是选择主成分的依据,将5种不同处理方式的21个与土壤改良有关的生理生化指标转化为20个主成分,前3个主成分贡献率分别为60.846%,10.258%,7.164%,它们的累计贡献率为78.268%(表4)。能够基本包含土壤的肥力信息,因此,选取前3个主成分作为土壤改良效果的重要主成分,对20个土壤肥力因子在各主成分上的因子载荷分析,由表5所示,土壤总孔隙度、田间持水量、细菌、真菌、放线菌、微生物量碳、微生物量氮、脲酶、纤维素酶对第一主成分影响较大,主要包含了土壤物理性质及微生物相关信息,可将F1命名为土壤物理性质及微生物因子,全磷、全钾对第二主成分影响较大,包含土壤磷、钾养分信息,可将F2命名为磷钾因子,无机氮、水解氮对第三主成分影响较大,包含了土壤中氮元素的含量情况,可将F3命名为氮因子,根据主成分分析数学模型,原始变量经过标准化处理的值,以每个主成分所对应的特征值占所提取主成分总的特征值之和的比例作为权重,计算各处理的综合主成分值作为综合得分,由表6所示,GBI+UBM的得分最高为2.056,表明其土壤改良的效果最好,GBI处理则次之。
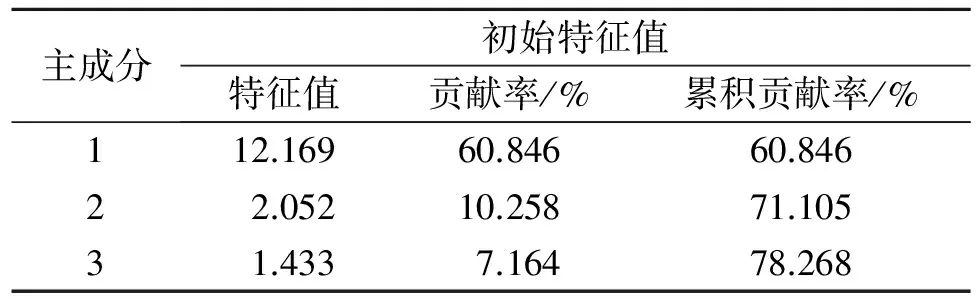
表4 主成分特征值及贡献率
3 讨 论
在本研究中杨树枝条不同处理方式均降低了土壤密度、提高了土壤总孔隙度、田间持水率,土壤含水量(GBI除外)这与李志刚[11]、陈金海[18]、崔新卫[19]等的研究结果相一致,但在不同杨树枝条施用方式下,土壤密度和总孔隙度、田间持水率、土壤含水量的降低幅度和提高幅度不同。GBI,GBI+UBM较CK显著降低了土壤密度和显著提高了总孔隙度、田间持水率(p<0.05),GBI+UBM的田间持水率是CK的2.05倍。UBM和GBM与CK相比土壤密度、田间持水率变化则不显著,但GBM较CK土壤含水量提高了5.75倍。这在干旱半干旱地区对于土壤水分的保持具有重要意义。同时对比GBI+UBM和UBM以及GBI+UBM和GBI发现混施措施(GBI+UBM,GBI)较表施措施(UBM,GBM)能显著改善土壤的密度、孔隙度、田间持水率,这是因为杨树材料混施短期内较表施更能与土壤充分接触,通过土壤微生物的作用分解形成更多腐殖质,使得土壤团粒结构更易形成,从而使得其土壤容重较表施处理的土壤容重低,最终使得混施处理的土壤总孔隙度较表施处理的显著提高[20]。而UBM较CK显著提高土壤含水量则说明在干旱半干旱地区土壤水分蒸发量较大的情况下有机物料覆盖是较为有效的保水措施。
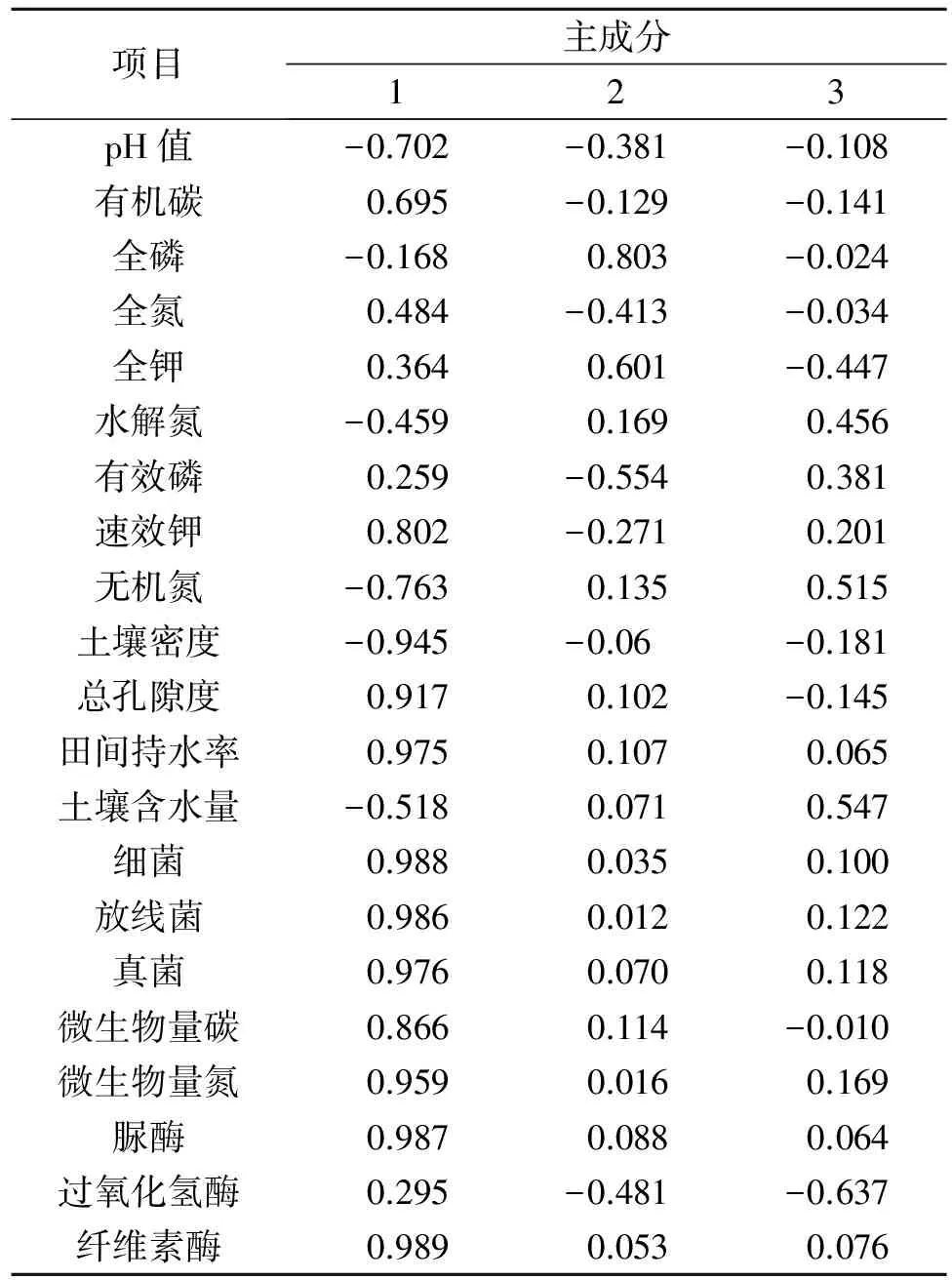
表5 各因子载荷矩阵

表6 主成分因子得分及土壤质量综合评价指数得分
杨树枝条不同方式施入沙化土中会对土壤物理性质产生影响,而土壤的密度、孔隙度等物理性质决定着土壤的水、肥、气、热及微生物性质。有机碳和氮含量是影响土壤肥力的最重要因素[21]。在本试验中,杨树枝条的不同施用方式均能提高土壤中的有机碳、氮,其中GBI+UBM,GBI较CK有机碳显著提高35.34%,26.1%(p<0.05)。这与薄国栋[22]、潘剑玲[23]、徐金强[24]等的研究结果相同。UBM和GBM与CK相比虽然对土壤的化学性质影响不显著,但总体上都有提高趋势,而UBM和GBM之间养分含量差异不显著,说明杨树枝条的外观性状对于其分解释放养分无显著的影响。混施处理(UBM+GBI,GBI)较表施处理(UBM,GBM)对土壤的化学性质改善效果更好,分析是杨树枝条首先改善了土壤的物理性质,因为混施杨树枝条与土壤接触面积更大,土壤密度、孔隙度的改善,材料分解更快,直接分解释放的养分更多,形成更多的腐殖质参与土壤颗粒形成,进而参与吸附各种营养元素[21]。此外本试验中各处理全氮、全磷含量与CK相比均不显著,可能是杨树枝条C/N、木质素含量较高,难以在短期内大量分解氮素[24]。GBI与GBI+UBM较CK显著提高土壤中无机氮、碱解氮含量(p<0.05),而作为植物生长过程中所必需的无机氮、碱解氮的含量的提高将对土壤改良后期的植物生长具有重要意义,也说明了杨树枝条混施措施对土壤改良是有效的。
添加杨树枝条影响土壤的物理性质、化学性质,最后通过影响土壤的微生物性质表现出来,因此土壤微生物能够很好地反映外在环境因子的刺激以及人为作用[25]。土壤微生物在秸秆碳、氮的矿化,腐殖质形成、分解等生物化学过程中有着不可替代的作用[26],并且微生物本身的代谢产物对于土壤质量有很大的影响。细菌在土壤微生物中占比最大,是土壤微生物中最为活跃的组分;真菌可以分泌产生大量的胞外酶,是分解有机物料的主导微生物种群;放线菌对木质素分解起着重要的作用[28-30]。因此研究者多以研究添加秸秆后土壤中细菌、真菌、放线菌的群落结构、组成以及遗传多样性等,借此评判秸秆改良土壤的效果。在田中加入秸秆能够为微生物提供有效的碳源、氮源,这将极大的促进微生物的生长[27]。李晓莎等[31]研究了秸秆还田和无秸秆还田对夏玉米田土壤呼吸及微生物活性的影响。结果表明:秸秆还田和保护性耕作在0—20 cm能明显提高土壤微生物量碳和微生物数量。Ocio等[32]将秸秆翻压还田7 d后研究微生物含量变化,结果显示微生物数量增加了2倍。这些结果与本试验结果一致,在本试验中,与CK相比,GBI和GBI+UBM均显著提高土壤中细菌、真菌、放线菌的数量,UBM和GBM处理与CK相比微生物数量虽有提高但不显著。说明杨树枝条与秸秆一样在还田后能够促进土壤微生物的生长与繁殖。混施处理(UBM+GBI,GBI)较表施处理(UBM,GBM)效果较好,特别是UBM+GBI最显著则是因为混施处理除了较表施处理提供更多的碳、氮等化学养分促进微生物的生长外,其对沙化土壤物理结构的改善较好于表施也会对土壤微生物产生显著影响,田间持水量、孔隙度、通透性的显著提高,能够使得微生物生存环境改善,从而最终使得混施处理显著提高微生物数量与活性,且本试验中混施的基础上又做表施的处理(UBM+GBI)会在土壤表面形成一层与大气热交换的隔层,阻止太阳长波辐射的同时也会减少土壤热量的散失,有高温时“降温”和低温时“增温”的双重效果[11],这使得微生物处在温度相对稳定的环境,更有利于微生物的生长代谢,极大提高了微生物含量,因此使得GBI+UBM较GBI显著提高土壤微生物数量(p<0.05)。
微生物量碳、氮与微生物数量密切相关。在本研究中微生物量碳、氮的变化趋势与微生物数量变化趋势一致。土壤酶是土壤微生物和植物分泌的有机物质,与土壤质量理化性质的大部分指标显著相关,纤维素酶、脲酶、过氧化氢酶与生物化学过程及养分释放过程密切相关。在本研究中各处理的3种酶的活性均有提高,其中混施处理(GBI,GBI+UBM)脲酶、纤维素酶活性显著提高,可能是杨树枝条施入特别是混施后酶的底物量增加了,也可能改良措施特别是混施措施使土壤微生物含量、物理化学性质的改善会促进酶活性的提高,使得混施处理的酶活性显著提高。总的来看杨树枝条的施入对沙化土壤生物特性的积极响应是有效的。各处理对土壤微生物特性与土壤物理化学性质趋势基本一致。
4 结 论
综上所述,本试验各处理总体上能改善土壤物理性质,与CK相比,UBM和GBM的土壤密度和田间持水率均无显著差异,但两处理都显著提高了土壤总孔隙度和土壤含水量。与CK相比,GBI,GBI+UBM对土壤含水量无显著变化,但GBI,GBI+UBM较CK显著降低了土壤密度,提高了土壤总孔隙度和田间持水率,而GBI+UBM与GBI之间土壤物理性质差异不显著。各施用方式对土壤化学性质各指标变化并不完全是趋于同一方向,但总体上对土壤有机碳、全氮和无机氮、速效钾均有不同程度提高,其中对于有机碳、无机氮、速效钾、碱解氮,GBI+UBM是CK的1.35倍、2.65倍、2.51倍、1.13倍,处理间呈现GBI+UBM>GBI>GBM>UBM>CK趋势。各处理均提高了土壤中细菌、真菌、放线菌数量以及微生物量碳、氮含量,且各处理间同样呈现GBI+UBM>GBI>GBM>UBM>CK趋势。各处理间土壤酶活性变化趋势呈现同微生物数量变化趋势(过氧化氢酶除外),且GBI+UGM处理效果最显著。土壤质量综合评价指数显示各处理对沙化土壤的改良效果依次为GBI+UBM>GBI>UBM>GBM>CK。这为宁夏当地沙化土壤改良及林木废弃物合理利用提供了可借鉴实例。
参考文献:
[1]Verón S R, Paruelo J M, Oesterheld M. Assessing desertification[J]. Journal of Arid Environments, 2006, 66(4): 751-763.
[2]Zhao H L, He Y H, Zhou R L, et al. Effects of desertification on soil organic C and N content in sandy farmland and grassland of Inner Mongolia[J]. Catena,2009,77(3):187-191.
[3]Wang X M, Chen F, Hasi E, et al. Desertification in China:An assessment[J]. Earth-Science Reviews,2008,88(3):188-206.
[4]Li J, Yang X, Jin Y, et al. Monitoring and analysis of grassland desertification dynamics using Landsat images in Ningxia, China[J]. Remote Sensing of Environment,2013,138:19-26.
[5]王少昆,赵学勇,张铜会,等.造林对沙地土壤微生物的数量、生物量碳及酶活性的影响[J].中国沙漠,2013,33(2);529-535.
[6]路文涛,张鹏,王维,等.秸秆还田对宁南旱作农田土壤活性有机碳及酶活性的影响[J].农业环境科学学报,2011,30(3):522-528.
[7]Graham M H, Haynes R J. Organic matter status and the size, activity and metabolic diversity of the soil microflora as indicators of the success of rehabilitation of mined sand dunes[J]. Biology and Fertility of Soils, 2004,39(6):429-437.
[8]蔡立群,牛怡,罗珠.秸秆促腐还田土壤养分及微生物量的动态变化[J].中国生态农业学报,2014,22(9):1047-1056.
[9]钱海燕,杨滨娟,黄国勤.秸秆还田配施化肥及微生物菌剂对水田土壤酶活性和微生物数量的影响[J].生态环境学报,2012,21(3):440-445.
[10]孙颖,王得祥,张浩,等.宁夏森林生态系统服务功能的价值研究[J].西北农林科技大学学报:自然科学版,2009,37(12):91-97.
[11]李志刚,谢应忠.翻埋与覆盖木枝条改善宁夏沙化土壤性质[J].农业工程学报,2015,31(10):174-181.
[12]Liu X, Zhang G, Heathman G C, et al. Fractal features of soil particle-size distribution as affected by plant communities in the forested region of Mountain Yimeng, China[J]. Geoderma,2009,154(1/2):123-130.
[13]Nelson D W, Sommers L E. Methods of soil analysis [M]. Wisconsin, USA: Soil Science Society Ofamerica, 1982.
[14]鲁如坤.土壤农业化学分析方法[M].北京:中国农业科技出版社,2000.
[15]鲍士旦.土壤农化分析[M].北京:中国农业出版社,2000.
[16]吴金水,林启美,黄巧云,等.土壤微生物生物量测定方法及其应用[M].北京:气象出版社,2006.
[17]关松荫.土壤酶及其研究方法[M].北京:农业出版社,1986.
[18]陈金海,李艳丽,王磊,等.两种基于芦苇秸秆还田的改良措施对崇明东滩围垦土壤理化性和微生物呼吸的影响[J].农业环境科学学报,2011,30(2):307-315.
[19]崔新卫,张杨珠,吴金水,等.秸秆还田对土壤质量与作物生长的影响研究进展[J].土壤通报,2014,45(6):1527-1532.
[20]殷程程.深层秸秆还田对土壤物理性质的影响[D].长春:吉林农业大学,2014.
[21]Smith P, Pownlson D S. Considering manure and carbon sequestration[J]. Science, 2000,287:428-429.
[22]薄国栋,张继光,申国明.秸秆还田对植烟土壤有机质及团聚体特征的影响[J].中国烟草科学,2014,35(3):12-17.
[23]潘剑玲,代万安,尚占环,等.秸秆还田对土壤有机质和氮素有效性影响及机制研究进展[J].中国生态农业学报,2013,21(5):526-535.
[24]徐金强,刘庆涛,刘素慧,等.大蒜秸秆还田对温室番茄连作土壤理化性质及其根系的影响[J].北方园艺,2016(1):152-156.
[25]Heinze S, Oltmanns M, Joergensen R G, et al. Changes in microbial biomass indices after 10 years of farmyard manure and vegetal fertilizer application to a sandy soil under organic management[J]. Plant & Soil, 2011,343(1/2):221-234.
[26]Icoz I, Saxena D, Andow D A, et al. Microbial populations and enzyme activities in soil in situ under transgenic corn expressing cry proteins from Bacillus thuringensis[J]. Journal of Environmental Quality, 2008,37(2):647-662.
[27]Powlson D S, Hirsch P R, Brookes P C. The role of soil microorganisms in soil organic matter conservation in the tropics[J]. Nutrient Cycling in Agroecosystems, 2001,61(1/2):41-51.
[28]Silva1 R G, Jorgensen E E, Holub S M, et al. Relationships between culturable soil microbial populations andgross nitrogen transformation processes in a clay loam soil across ecosystems[J]. Nutrient Cycling in Agroecosystems, 2005,71(1):259-270.
[29]Henriksen T M, Breland T A. Carbon mineralization, fungal and bacterial growth, and enzyme activities as affected by contact between crop residue sand soil[J]. Biolfert Soils, 2002,35(1):41-48.
[30]Nsabimana D, Haynes R J, Wallis F M. Size activity and catabolic diversity of the soil microbial biomass as affected by land use[J]. Applied Soil Ecology, 2004,26(2):81-92.
[31]李晓莎,武宁,刘玲,等.不同秸秆还田和耕作方式对夏玉米农田土壤呼吸及微生物活性的影响[J].应用生态学报,2015,26(6):1765-1771.
[32]Ocio J, Brookes P, Jenkinson D. Field incorporation of straw and its effects on soil microbial biomass and soil in organic N [J]. Soil Biology and Biochemistry, 1991,23(2):171-176.
