血尿酸与脑小血管病患者血管性轻度认知障碍的相关性研究
2018-04-11李衍芳高鸣张志超李雪梅
李衍芳,高鸣,张志超,李雪梅
脑小血管病(cerebral small vessel disease,CSVD)是引起血管性轻度认知障碍(vascular mild cognitive impairment,VaMCI)最常见的病变,VaMCI是正常认知与血管性痴呆的过渡阶段,是痴呆防治的关键时期[1-2]。在早期阶段,大多数VaMCI患者无明显临床症状,所以有必要寻找对疾病预测有意义的因素[3]。
尿酸(uric acid,UA)是一种抗氧化剂和自由基清除剂,是影响老年人心脑血管的重要因素,UA作为大动脉粥样硬化的危险因素已经得到许多研究的支持[4-5]。目前很少有研究探讨血清UA与CSVD患者VaMCI之间的关系,本研究对此进行了探讨。
1 研究对象与方法
1.1研究对象 连续收集2015年10月-2017年6月于潍坊医学院附属医院神经内科就诊的CSVD患者,符合以下标准:①依据中国CSVD诊治共识,患者表现为进行性行走困难、二便失禁或认知功能下降等症状,头颅磁共振成像(magnetic resonance imaging,MRI)表现为新发小的皮质下梗死、白质高信号、腔隙、微出血或血管周围间隙,且皮层下病变直径小于20 mm,既往无卒中史[6]。②年龄40~85岁。
参考美国心脏学会(American Heart Association,AHA)/美国卒中学会(American Stroke Association,ASA)血管性轻度认知障碍诊断标准及蒙特利尔认知评估量表(Montreal cognitive assessment scale,MoCA),CSVD患者被分为轻度认知障碍组(MoCA<26分)和认知正常组(MoCA≥26分)[7]。对照组为年龄性别相匹配,头颅MRI未见异常,且认知功能正常的体检者。所有入组者均签署知情同意书。
排除标准:①由于中毒、炎症、肿瘤等其他病理改变引起的白质病变的患者;②根据美国精神障碍诊断与分类统计手册第四版诊断为痴呆者[8];③帕金森病等患有认知障碍的患者;④服用促智药或维生素制剂的患者;⑤严重的心肝肾疾病、代谢综合征、免疫性疾病、造血系统疾病的患者;⑥存在沟通障碍的患者;⑦近2周有手术史或严重感染的患者。
1.2临床资料收集 记录受试者的病史资料,包括人口统计学信息(年龄、性别、教育史),既往史(高血压史、糖尿病史、高脂血症史、冠状动脉粥样硬化性心脏病史)[9-12],吸烟史(平均每天吸烟1支及以上并连续1年及以上者)和饮酒史(平均每天饮酒50 g及以上并连续1年及以上者)[13],实验室检查(血糖、血脂、尿酸、同型半胱氨酸)等。
血清尿酸及其他生化指标检测:采集受试者空腹肘静脉血(禁食时间大于8 h),UA采用比色法测定,试剂盒由上海可华生物试剂有限公司提供,将静脉血2 ml置于乙二胺四乙酸(ethylenediaminetetraacetic acid,EDTA)抗凝管,3000 r/min离心10 min,取上清液置于强生VITROS3600全自动免疫分析仪进行检测。同时测定同型半胱氨酸、总胆固醇、甘油三酯、低密度脂蛋白胆固醇、高密度脂蛋白胆固醇和空腹血糖等。以上操作由检验科医师进行。
神经心理学测试:采用MoCA量表进行评估,受试者15 min内完成该量表,总分30分,教育年限≤12年加1分,总分<26分被认为有认知功能障碍。
1.3统计学方法 采用SPSS 17.0软件进行统计学分析。计量资料符合正态分布,以表示,组间比较采用单因素方差分析。计数资料以率表示,组间比较采用卡方检验。相关分析采用Pearson相关分析。采用Logistic回归分析进行多因素检验,将单因素分析中P<0.05的因素纳入多因素分析,计算比值比(odds ratio,OR)和95%可信区间(con fi dence interval,CI)。P<0.05表示差异有统计学意义。
2 结果
2.1单因素分析结果 研究共入组CSVD患者87例,男性52例(59.8%),平均年龄(67.83±6.98)岁,其中无认知障碍组40例,平均年龄(67.71±7.04)岁,男性24例(60.0%);轻度认知障碍组47例,平均年龄(68.02±7.08)岁,男性28例(59.6%)。对照组44例,平均年龄(66.05±8.05)岁,男性25例(56.8%)。
无认知障碍组、轻度认知障碍组与对照组在年龄、受教育程度、高血压史、糖尿病史、冠状动脉粥样硬化性心脏病史、高脂血症史、吸烟史、饮酒史、血糖、总胆固醇、甘油三酯、高密度脂蛋白、低密度脂蛋白、同型半胱氨酸方面的差异无统计学意义(表1)。血清UA及同型半胱氨酸(homocysteine,Hcy)水平在3组之间的差异有统计学意义(P<0.001),两两比较显示无认知障碍组及轻度认知障碍组UA水平[(315.15±56.76)μmol/L、(363.32±42.58)μmol/L]均高于对照组[(269.66±40.21)μmol/L](均P<0.001),Hcy水平[(17.28±3.82)μmol/L、(20.08±3.61)μmol/L]均高于对照组[(10.02±2.35)μmol/L](均P<0.001),且轻度认知障碍组血UA及Hcy水平高于无认知障碍组(均P<0.001)(表1)。
2.2多因素分析结果 Logistic回归分析显示,血清UA(OR1.020,95%CI1.009~1.032,P=0.010),Hcy(OR1.246,95%CI1.061~1.463,P=0.007)是CSVD患者血管性轻度认知障碍的独立危险因素。
2.3血UA与轻度认知障碍患者MoCA的相关性分析 轻度认知障碍组UA水平与患者蒙特利尔评估总分、视空间与执行能力、记忆、语言负相关(表2)。
3 讨论
CSVD是导致血管性轻度认知障碍的重要原因,若持续进展可转化成血管性痴呆。既往研究发现,CSVD引起的认知障碍可能是由于脑内小血管发生病变,致皮质下白质及深部灰质缺血,以至额叶-皮层下环路切断,特别是额前回背外侧、额叶眶部和前扣带回与纹状体、苍白球、丘脑腹内侧核和丘脑背侧核之间环路阻断,最终影响信息处理速度、注意力及额叶执行功能[1,14]。CSVD导致轻度认知障碍的传统危险因素,除如高血压、高脂血症、糖尿病外,目前尚缺乏可靠的量化的预测因素。

表1 认知正常组、轻度认知障碍组与对照组临床特征比较
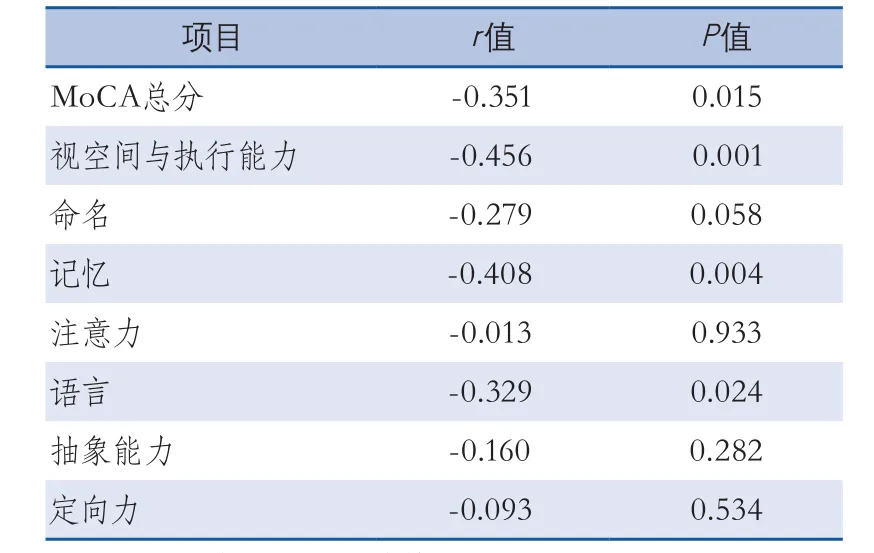
表2 血清UA与轻度认知障碍组患者MoCA的相关性分析
尿酸是嘌呤代谢的最终产物,高尿酸水平会通过促进血管内皮炎症反应和氧化应激,导致血管内皮功能紊乱和白质损伤,从而影响认知功能[15-16]。尿酸与认知功能关系密切,但目前研究结果不一。Schretlen David J等[17]对血清尿酸水平及脑白质病变进行分析发现,随着血清尿酸水平增高,脑白质病变的程度逐渐增加。2013年的鹿特丹研究中发现,较高的血清尿酸水平与脑萎缩及认知功能减退呈正相关[18]。但S. M. Euser等[19]研究发现血清尿酸水平与认知障碍并无明显相关,较高的尿酸水平可能意味着较好的认知演变。本研究将脑小血管病患者分为非认知障碍组及轻度认知障碍组,结果显示,两组患者血清尿酸水平均高于对照组,且认知障碍组血清UA水平高于非认知障碍组。多因素分析显示血UA是CSVD患者轻度认知障碍的独立危险因素。
血清尿酸水平对认知障碍的具体倾向,已经有学者进行了相关研究。Schretlen David J等[17]发现高尿酸人群的言语及工作上的记忆能力、信息处理速度等方面下降。Tracy D Vannorsdall等[15]研究显示血清尿酸与脑缺血患者的运算速度、记忆力、言语流畅性和白质高信号等显著相关。本研究的相关性分析显示,血清UA水平与CSVD轻度认知障碍患者蒙特利尔评估总分、视空间与执行能力、记忆及语言呈负相关,与先前的研究相符。
本研究中,无认知障碍组、轻度认知障碍组与对照组在一些传统危险因素上如高血压、糖尿病、血脂之间的差异无统计学意义,与既往研究存在不一致性。高血压、糖尿病、血脂异常等可导致血管受损,研究对象患有上述疾病病程的长短、病情的严重程度以及对疾病的防治都会对研究结果产生影响,研究结果的不一致可能与上述因素有关。本研究仅通过收集病例数进行研究,未对上述危险因素进行病程分级、严重程度分级,进一步研究其与认知功能损害的关系,那样可能会获得更精准的结果。
本研究还存在其他的局限性,首先本研究是横断面研究,不能解释尿酸与脑小血管病患者轻度认知障碍的因果关系。其次本研究样本量较少,研究对象为就诊患者,存在一定局限性,还需进一步扩大样本量进行深入研究。
[1]BENJAMIN P,LAWRENCE A J,LAMBERT C,et al. Strategic lacunes and their relationship to cognitive impairment in cerebral small vessel disease[J/OL].Neuroimage Clinical,2014,4:828. https://doi.org/10.1016/j.nicl.2014.05.009
[2]CHO S J,YU K H,MI S O,et al. Post-stroke memory impairment among patients with vascular mild cognitive impairment[J]. Bmc Neurology,2014,14(1):1-6.
[3]WADA M,TAKAHASHI Y,ISEKI C,et al. Plasma fi brinogen,global cognitive function,and cerebral small vessel disease:results of a cross-sectional study in community-dwelling Japanese elderly[J]. Internal Medicine,2011,50(9):999-1007.
[4]WARING W S,WEBB D J,MAXWELL S R.Systemic uric acid administration increases serum antioxidant capacity in healthy volunteers[J]. J Cardiovasc Pharmacol,2001,38(3):365-371.
[5]ACEVEDO A,BENAVIDES J,CHOWDHURY M,et al. Hyperuricemia and Cardiovascular Disease in Patients with Hypertension[J]. Conn Med,2016,80(2):85-90.
[6]中华医学会神经病学分会. 中国脑小血管病诊治共识[J]. 中华神经科杂志,2015,48(10):838-844.
[7]GORELICK P B,SCUTERI A,BLACK S E,et al.Vascular contributions to cognitive impairment and dementia:a statement for healthcare professionals from the american heart association/american stroke association[J]. Stroke,2011,42(9):2672-2713.
[8]JIMÉNEZ M C,CURHAN G C,CHOI H K,et al. Plasma Uric Acid Concentrations and Risk of Ischemic Stroke in Women[J]. Eur J Neurol,2016,23(7):1158-1164.
[9]《中国高血压基层管理指南》修订委员会. 中国高血压基层管理指南(2014年修订版)[J]. 中华健康管理学杂志,2015,30(1):10-30.
[10]中华医学会糖尿病学分会. 中国2型糖尿病防治指南(2013年版)[J]. 中华内分泌代谢杂志,2014,30(10):447-498.
[11]中国成人血脂异常防治指南修订联合委员会. 中国成人血脂异常防治指南解读(2016年修订版)[J]. 中国循环杂志,2016,31(10):937-939.
[12]陈灏珠. 心脏病学[M]. 北京:人民卫生出版社,2003:1203.
[13]张永红,赵玉泉,佟卫军,等. 蒙古族居民吸烟、饮酒与高血压关系研究[J]. 中华高血压杂志,2001,9(2):154-156.
[14]TULLBERG M,FLETCHER E,DECARLI C,et al. White matter lesions impair frontal lobe function regardless of their location[J]. Neurology,2005,63(2):246-253.
[15]VANNORSDALL T D,JINNAH H A,GORDON B,et al. Cerebral Ischemia Mediates the Effect of Serum Uric Acid on Cognitive Function[J]. Stroke,2008,39(12):3418-3420.
[16]RYU E S,KIM M J,SHIN H S,et al. Uric acidinduced phenotypic transition of renal tubular cells as a novel mechanism of chronic kidney disease[J]. Am J Physiol Renal Physiol,2013,304(5):F471-480.
[17]SCHRETLEN D J,INSCORE A B,JINNAH H A,et al. Serum uric acid and cognitive function in community-dwelling older adults[J]. Neuropsychology,2007,21(1):136-140.
[18]VERHAAREN B F J,VERNOOIJ M W,DEHGHAN A,et al. The Relation of Uric Acid to Brain Atrophy and Cognition:The Rotterdam Scan Study[J]. Neuroepidemiology,2013,41(1):29-34.
[19]EUSER S M,HOFMAN A,WESTENDORP R G J,et al. Serum uric acid and cognitive function and dementia[J]. Brain,2009,132(Pt 2):377-382.
