利用核磁共振(31P-NMR)测定b型流感嗜血杆菌荚膜多糖中磷含量的新方法研究
2018-04-10普元倩朱文勇吴雅楠靳玮华李卫东廖国阳
普元倩,朱文勇,吴雅楠,靳玮华,李卫东,廖国阳
1.大理大学 基础医学院,云南 大理671000;2.中国医学科学院 北京协和医学院 医学生物学研究所,云南 昆明650018
b 型流感嗜血杆菌(Haemophilus influenzaetype b,Hib)是引起婴幼儿严重细菌感染的主要致病菌,可导致脑膜炎、肺炎、败血症、会厌炎、蜂窝组织炎、心包炎、脊髓炎等多种侵袭性疾病。据世界卫生组织(WHO)统计,全球每年约330 万5 岁以下儿童受到Hib 感染,其中38 万~50 万儿童死于Hib 感染性疾病,并且有30%~40%的儿童出现严重的并发症与残疾[1]。Hib 疫苗的研发和使用能够降低Hib 疾病的发病率。在Hib 疫苗研发和生产过程中,其荚膜多糖的质量控制至关重要,其中包括血清型鉴定,磷含量、蛋白含量、核糖含量的测定等。传统上采用《中国药典》三部(2010 版)收录的化学法对Hib 荚膜多糖中的磷含量进行测定。由于这类方法一般使用强腐蚀性酸,操作复杂、危险系数高,且灵敏度较低,有时易受到干扰,不能用于细菌培养过程中多糖磷含量的检测。定量核磁共振波谱(quantitative nucle⁃ar magnetic resonance spectroscopy,QNMR)方 法操作简便,样品用量少,无其他元素干扰,无需对照品即可进行定量分析。 目前QNMR 包括1H-、13C-、19F-、31P-、14N-、15N-NMR 及一些二维技术[2],广泛应用于化学药物[3-4]、食品农业[5-6]、中药与植物提取物[7-8]、代谢组学[9-10]、生物学[11-12]等研究领域。在细菌多糖质量控制中,氢核磁共振波谱(1H-NMR)技术已用于原料多糖的型别鉴定[13-14]、含量测定、计算多糖中特异化学基团(如O-乙酰基)的含量[15]、多糖纯度(如Pn C-PS、残余化学试剂)分析[14]。目前,NMR 已经是《欧洲药典》和WHO 推荐的多糖质量控制方法[17-18]。我们运用31P-NMR 谱的定量功能,采用内标法,摸索适当的测试条件,并与传统化学方法进行比较,建立了31P-NMR 测定Hib 荚膜多糖中磷含量的方法。
1 材料与方法
1.1 材料
磷酸氢二钾(99%纯度)、六甲基磷酰三胺(99%纯度,为核磁共振化学位移内标试剂)购自Sigma公司;Hib荚膜多糖(批号:20130826,20130909,20130923;2~8℃保存)由昆明医学生物学研究所生物制品五室制备;重水(D2O,99.9%纯度)购自CIL 公司;硫酸购自川东化工集团有限公司;高氯酸购自金鹿化工有限公司;钼酸铵购自国药集团化学试剂有限公司;亚硫酸氢钠、亚硫酸钠购自西陇化工股份有限公司;1-氨基-2-萘酚-4-磺酸购自上海金山亭新化工试剂厂;蒸馏水由昆明医学生物学研究所制备;400 MHz 核磁共振仪购自Bruker 公司;四环冻干机购自北京四环科学仪器厂;连续波长酶标仪购自Thermo 公司;核磁共振样品管(d=5 mm)购自Wilmad-Lab⁃Glass 公司。
1.2 NMR法
1.2.1 核磁法样品配制 用D2O 分别配制50 mmol/L 内标溶液、50 mmol/L 磷酸氢二钾溶液、100 mmol/L Hib 荚膜多糖样品溶液,其中Hib 多糖以其重复单元计算物质的量,每一重复单元相对分子质量为368[19](磷酸二氢钾、3 批样品多糖、内标试剂均先冷冻干燥过夜)。
1.2.231P-NMR 谱参数设置31P-NMR 图谱采集所用仪器参数设置见表1。
1.2.3 核磁定量精密度、重复性及精确度验证取100 μL 磷酸氢二钾溶液、300 μL 内标溶液,加D2O 600 μL 混匀,配制成终浓度为5 mmol/L 磷酸氢二钾溶液和15 mmol/L 内标溶液混合液,取550 μL 至核磁样品管。同法配制10、15、20、25 mmol/L 样品混合液,内标终浓度固定为15 mmol/L。每个浓度均配制5 个平行核磁样品,分别按表1 优化参数设置进行31P-NMR 测试。利用31PNMR 谱图中质子峰面积与质子数成正比的原理,通过下式[20]计算含量,进而进行平均值、相对标准偏差、误差和相对误差的分析。

式中,WS为样品质量,AS为样品定量峰面积,nS为样品定量峰包含磷原子数,WR为内标质量,AR为内标定量峰面积,nR为内标定量峰包含磷原子数,MS为样品摩尔质量,MR为内标摩尔质量,S为磷酸氢二钾,R为六甲基磷酰三胺。
1.2.4 核磁法测定Hib 荚膜多糖中的磷含量 分别取3 批多糖溶液300 μL、内标溶液300 μL,加D2O 400 μL 混匀,吸取550 μL 至核磁样品管,配制成含15 mmol/L 多糖和15 mmol/L 内标溶液,按1.2.2 项参数设置进行31P-NMR 测试。同样利用上述公式得到多糖中的磷含量。
1.3 化学法
1.3.1 标准曲线绘制 用蒸馏水配置20 μg/mL磷酸氢二钾标准溶液、100 μg/mL 磷酸氢二钾溶液(作为供试样品)、100 μg/mL 3 批多糖样品(磷酸氢二钾、3 批多糖样品均先冷冻干燥过夜),参照《中国药典》三部(2010 版)附录ⅦA 操作[21],以质量浓度(μg/mL)为横坐标、吸光度值为纵坐标制标准曲线。
1.3.2 定量精密度、重复性及精确度验证 先将100 μg/mL 磷酸氢二钾样品作为供试品用蒸馏水依次稀释至6、9、12、15、18 μg/mL,每个浓度各5个平行,按《中国药典》三部(2010 版)附录ⅦA 操作[21],测定吸光度值,代入回归方程即得供试品质量浓度,计算磷酸氢二钾质量,并计算平均值、相对标准偏差和相对误差。
1.3.3 测定Hib 荚膜多糖中的磷含量 配制3 批100 μg/mL 多糖样品溶液,参考《中国药典》三部(2010 版)附录ⅦA 进行检测[21]。
2 结果
2.1 磷酸氢二钾31P-NMR谱
将一定量的内标物六甲基磷酰三胺溶液和磷酸氢二钾溶液加入核磁管,按表1 优化参数进行31P-NMR 测定,其31P-NMR 谱见图1。可以看出,所选内标物的定量峰a 与磷酸氢二钾的定量峰b 完全分离,对不同的物质峰进行归属,在化学位移30 和0 ppm 出现2 个较大的尖锐峰,且无其他杂峰干扰。
2.2 NMR法的精密度及准确度
公式计算结果如表2 所示,不同浓度的相对误差均小于3%,相对标准偏差(RSD)除最低浓度(5 mmol/L)和最高浓度(25 mmol/L)外,均小于1.0%;其中,RSD 最小(0.7%)的样品浓度为15 mmol/L,相对误差也几近最小(2.1%),表明该浓度下的数据精密度,重复性最好。

图1 磷酸氢二钾加入六甲基磷酰三胺31P-NMR 谱
2.2 化学法的精密度及准确度
标准曲线见图2。所有样品的相对误差均超过5%,明显高于31P-NMR 法,说明精确性不如31P-NMR 法。不同浓度样品的RSD 为1%~3%,18 μg/mL 时RSD 最 大(3.185%),12 μg/mL 时RSD 最小(1.222%),说明各平行浓度间重复性不够好,可能由于炭化消化过程中玻璃试管壁厚度不均一导致受热不均,有个别管底残留液难以炭化,使得相对误差与RSD 值偏大,见表3。
2.3 Hib多糖中磷含量的测定结果
31P-NMR 法定量Hib 多糖中的磷含量时,多糖定量峰在化学位移0.06 ppm 处呈独立单峰(图3,d 峰),与内标定量峰c 完全分离,其峰面积可以作为公式中的AS进行计算。31P-NMR 法和化学法检测的3 批多糖中的磷含量无明显差异,均在《中国药典》三部(2010 版)合格范围内(68~90 mg/g)(表4),表明2 种方法均可用于3 批多糖的磷含量检测,且检测结果均合格。
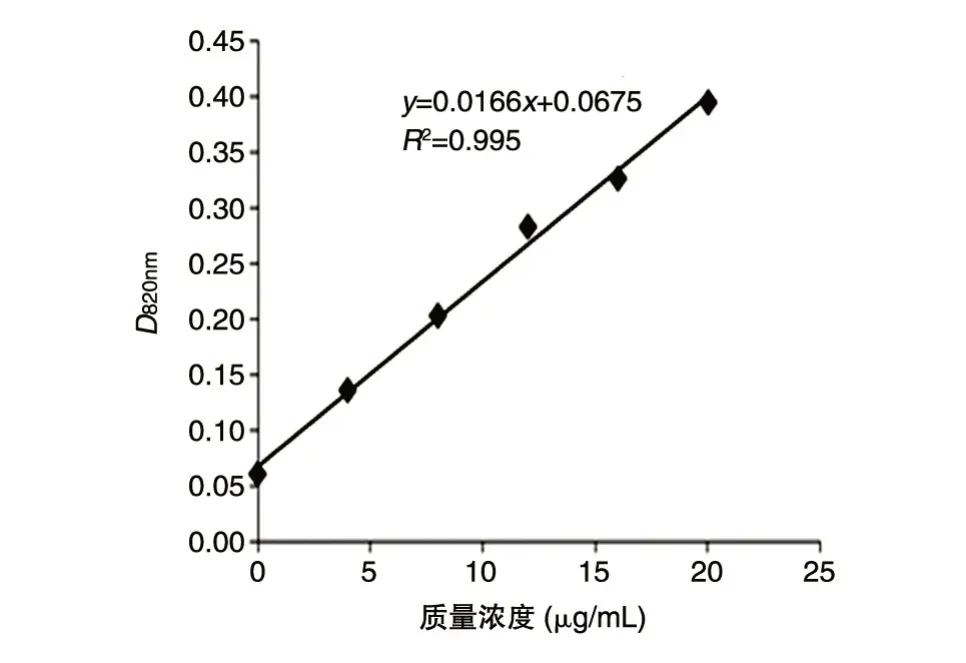
图2 标准曲线
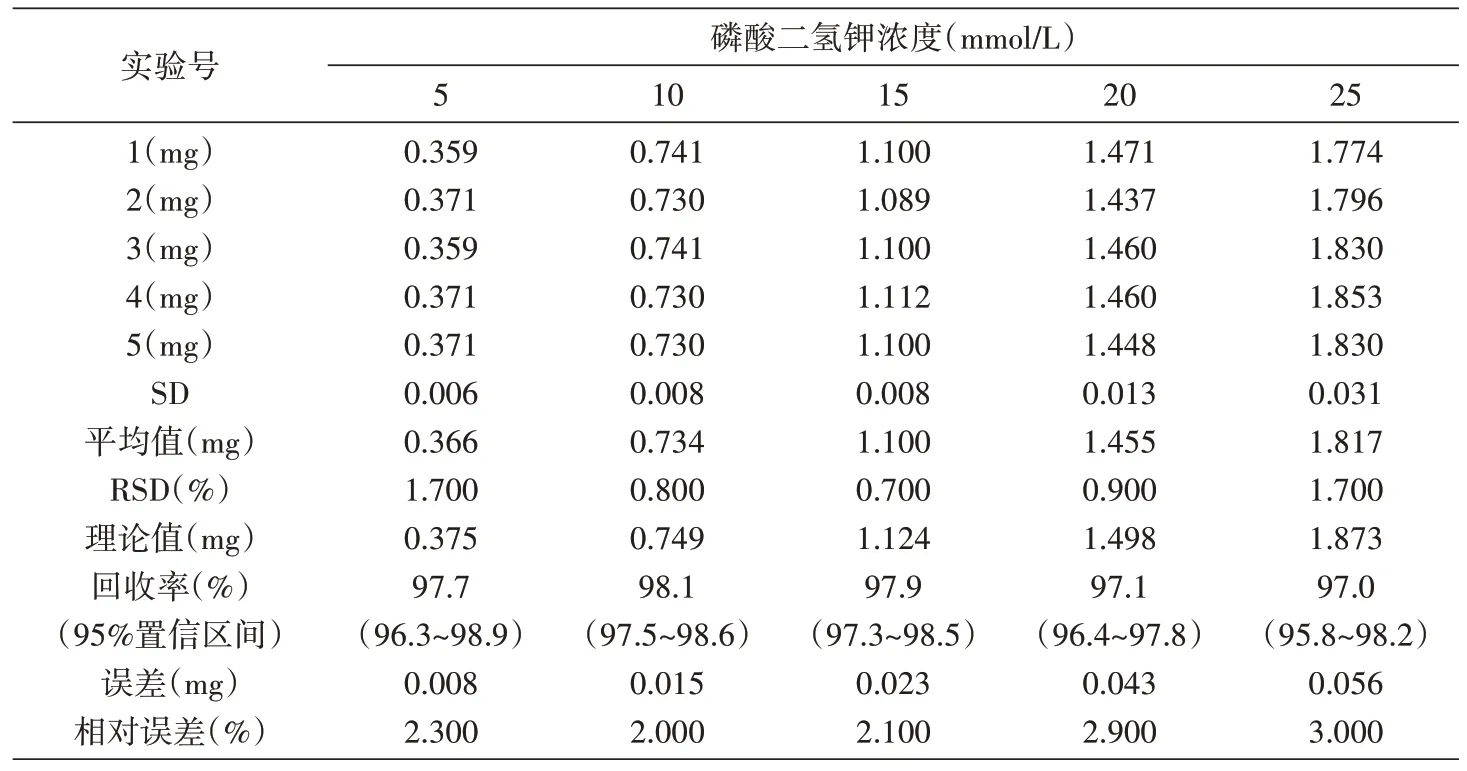
表2 31P-NMR法的精密度和精准度

表3 化学法的精密度和精准度
3 讨论
磷含量是Hib 荚膜多糖质量控制的一项重要检测指标。传统化学法操作步骤多,人为操作及测量误差不可避免;而31P-NMR 法只对磷原子有吸收峰,无其他元素的干扰,不破坏样品,操作简单、快速,相应地减少了测量过程中误差出现的几率。本实验中化学法所得结果与实际理论值的相对误差控制在10% 以内,但普遍高于31PNMR 法的相对误差,因此,在精密度方面,31PNMR 法要优于传统化学法。在重复性上,31PNMR 法的RSD 值远小于传统化学法,表明31PNMR 法较化学法更稳定。
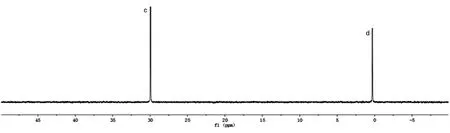
图3 Hib 多糖加入六甲基磷酰三胺31P-NMR 谱
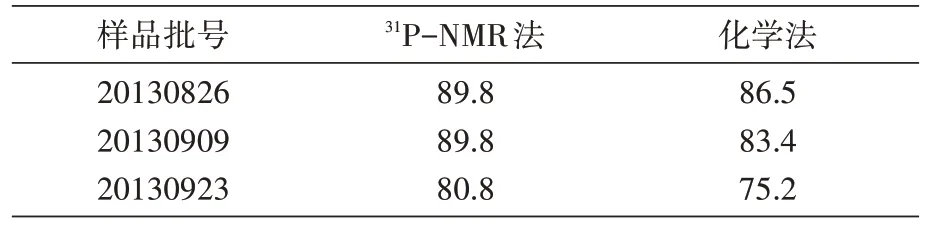
表4 31P-NMR法和化学法测定Hib多糖中的磷含量(mg/g)
在QNMR 中,当磷酸二氢钾浓度为15 mmol/L时,磷酸氢二钾定量峰面积与内标定量峰面积接近1∶1,其RSD 值(0.7%)最小,即精密度最好。综合以上因素,采用核磁法测量Hib 荚膜多糖中的核糖含量时,应选择与内标定量峰面积相近的浓度进行。
本研究建立了31P-NMR 法测定Hib 荚膜多糖中磷含量的方法,该方法精密度高、重复性好、精确度高,各方面均优于化学法,且检测快速准确,不破坏原物质的化学结构,不依赖被测物的标准品即可进行定量分析,可作为检测细菌多糖中磷含量的一个简单、准确、快捷的方法。
