甲酸提取酿酒酵母中S-腺苷-甲硫氨酸工艺研究
2018-04-10张爱君杜瑾张晓青姜天翔王树勋曹军瑞
张爱君,杜瑾,张晓青,姜天翔,王树勋,曹军瑞
国家海洋局 天津海水淡化与综合利用研究所,天津300192
S-腺苷-甲硫氨酸(S-adenosyl-L-methionine,SAM)被称为“活性甲硫氨酸”,是一种广泛存在于动植物、微生物体内的重要中间代谢物质[1-2]。同时,作为一种重要的生理活性物质存在于人体内,主要具有转甲基、转氨丙基和转硫基的作用,是人体内100 多种甲基转移酶催化反应的甲基供体,是谷胱甘肽和多胺的合成前体,充足的SAM是维持这些代谢途径正常运转的前提。SAM 的临床应用极为广泛,较常见的是用于治疗肝病、骨关节炎、抗抑郁等常见疾病[3-5]。随着市场需求日益增加,亟待开发高效、环保的SAM 规模化制备工艺。SAM 的制备方法主要有化学合成法、酶促合成法、发酵法。其中,微生物发酵技术制备SAM 具有成本低廉、易于操作等优点,是目前SAM 工业化生产的主要方法[6]。在发酵过程中,通过添加L-甲硫氨酸,与细胞内腺嘌呤核苷三磷酸(ATP)催化合成高浓度的SAM。常用的生产菌株为酿酒酵母[7]、毕赤酵母[8]等。
酵母发酵法生产SAM 虽然产量较高,但由于SAM 是胞内产物,在分离纯化过程中首先要破碎较厚的酵母细胞壁。有研究者试图通过基因工程手段改造大肠杆菌、谷氨酸棒状杆菌等易破壁的微生物合成SAM[9-10],但产量均显著低于酵母菌,因此酵母菌仍是生产SAM 的最主要菌株。目前文献报道破碎酵母释放SAM 的方法主要有挤压式细胞破碎法、超声波法、液氮研磨法、反复冻融法和化学试剂法等,其中应用较多的是化学试剂法。应用最广的提取剂是高氯酸和乙酸乙酯-硫酸[11-12]。高氯酸法的提取效果近乎100%,是早期提取SAM 的主要方法,但由于高氯酸的危险性较高,目前仅用于提取标准[13]。乙酸乙酯-硫酸法的提取率可达90%,但有机溶剂用量大,提取成本和污染性均较高。因此,开发提取酵母细胞内SAM 的新工艺是非常必要的。
在此,我们从6 种不同提取剂中筛选出能够高效提取酵母细胞胞内SAM 的提取剂,并通过比较提取剂浓度、料液比、提取时间、提取温度等因素对SAM 回收量的影响,确定了最佳提取条件,建立了一种胞内SAM 提取的新工艺。
1 材料与方法
1.1 材料
SAM 标准品购于Sigma 公司;超高效液相色谱(UPLC)所需试剂甲醇和甲酸铵为色谱纯;浓硫酸、盐酸、甲酸、高氯酸、磷酸、氯化钠等试剂为分析纯。
超高效液相色谱仪为Waters ACQUITY 型;pH 计为ORION 3 STAR 型;千分之一天平为梅特勒ME104E 型;恒温振荡器为上海智城ZHWY-2102C 型。
种子培养基:酵母粉10 g/L,蛋白胨20 g/L,葡萄糖20 g/L,115℃灭菌20 min。
发酵培养基:酵母粉10 g/L,蛋白胨20 g/L,磷酸盐缓冲液0.1 mol/L(pH7.0),YNP 13.4 g/L,生物素4×10-5g/L,甘油20 g/L,L-蛋氨酸50 mmol/L,115℃灭菌20 min(L-蛋氨酸须过滤除菌)。
1.2 含SAM菌体的制备
挑取酿酒酵母菌于种子培养基,28℃、160 r/min 振荡培养24 h;按10%的接种量接种至发酵培养基中,28℃、160 r/min 振荡培养120 h 后结束发酵。将发酵液于4℃、10 000 r/min 离心15 min,去除上清液,用无菌水冲洗3 次,去除培养基残留液,收集含SAM 的酿酒酵母细胞。
1.3 不同提取剂对SAM提取率的影响
取1 g 酿酒酵母湿细胞,选用6 种提取剂(高氯酸、甲酸、盐酸、硫酸、硫酸+20% 氯化钠、磷酸),提取剂浓度均为1.5 mol/L,用量为6 mL,常温振荡处理90 min 后,于4℃、10 000 r/min 离心15 min,取上清液作为分析样品,测定不同提取剂处理后SAM 的提取率。
1.4 甲酸浓度和料液比对SAM回收量的影响
称取1 g 酿酒酵母湿细胞,加入甲酸溶液提取,分别采用不同提取剂浓度(0.4、0.8、1.2、1.6 mol/L)和不同料液比(1∶1、1∶3、1∶5、1∶7 g/mL),常温振荡处理90 min 后,于4℃、10 000 r/min 离心15 min,取上清液作为分析样品,测定甲酸不同浓度和料液比下SAM 的回收量。
1.5 提取温度和提取时间对SAM回收量影响的实验
称取1 g 酿酒酵母湿细胞,加入浓度为1.2 mol/L 的甲酸溶液25 mL,料液比为1∶5 g/mL,分别在不同提取温度(15、20、25、30℃)下,振荡处理不同时间(1、2、3、4 h),于4℃、10 000 r/min 离心15 min,取上清液作为分析样品,测定不同提取温度和提取时间下SAM 的回收量。
1.6 SAM浓度测定
采用超高效液相色谱法测定SAM 的浓度,色谱柱为C18反向柱(ACQUITY UPLC BEH C18,1.7 μm,2.1 mm×50 mm),流动相为0.01 mol/L 甲酸铵∶甲醇(98∶2),pH3.5~4.0,流速0.3 mL/min,柱温30℃,PDA 检测器检测波长254 nm。SAM 标准品及分析样品经0.22 μm 微孔滤膜过滤后进样。
1.7 SAM提取率、回收量计算
按下式计算SAM 提取率(q)、回收量(R):

式中,q为SAM 的提取率(%),c1为从细胞内提取的SAM 的浓度(mg/L),c0为高氯酸作为提取剂从细胞内提取的SAM 的浓度(mg/L),R为回收量(mg/g),v1为提取剂用量(L),m1为细胞湿重(g)。
2 结果
2.1 提取剂的筛选
选用1.5 mol/L 的高氯酸、甲酸、盐酸、硫酸、硫酸+20%氯化钠、磷酸作为提取剂,分别加入事先装有1 g 湿重酵母细胞的试管中,提取率结果见图1。以1.5 mol/L 高氯酸为提取剂振荡提取90 min 后胞内SAM 的提取率为100%。以1.5 mol/L 的甲酸、盐酸、硫酸、硫酸+20%氯化钠、磷酸作为提取剂时,在相同操作条件下,磷酸的提取效果较差,低于10%;盐酸、硫酸、硫酸+氯化钠的提取效果较好,提取率均达到70%以上;甲酸的提取效果最佳,提取率达85.6%。结果表明,在相同的提取剂浓度下,甲酸对细胞内SAM 的提取效果明显高于其他提取剂,选取甲酸为提取剂进行条件优化研究。
2.2 甲酸浓度和料液比对SAM回收量的影响
以甲酸为提取剂,分别采用不同浓度(0.4、0.8、1.2、1.6 mol/L)和不同料液比(1∶1、1∶3、1∶5、1∶7 g/mL),在常温条件下对酿酒酵母细胞内SAM 提取90 min,其回收量结果见图2。当料液比为1∶1 g/mL 时,4 个浓度梯度的回收量均低于6 mg/g;当料液比提高到1∶7 g/mL 时,回收量均超过了10 mg/g。表明SAM 的回收量随料液比的提高而增加。而当料液比一定时,SAM 的回收量则随着甲酸浓度的提高而增加。其中,料液比为1∶5 与1∶7 g/mL,甲酸浓度为1.2 或1.6 mol/L 时,SAM 回收量均可达到11 mg/g 以上,提取效果相当,继续提高料液比或甲酸浓度不能进一步提高SAM 的回收量。因此,综合考虑甲酸溶液用量及其成本,选择最适提取剂浓度为1.2 mol/L,料液比为1∶5 g/mL。
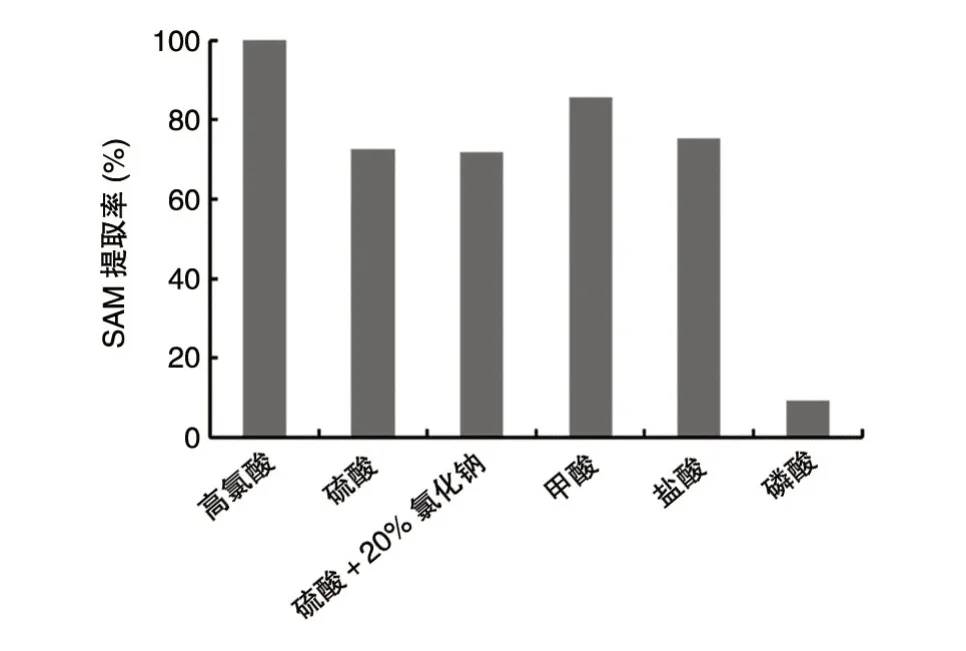
图1 不同提取剂对SAM 提取率的影响
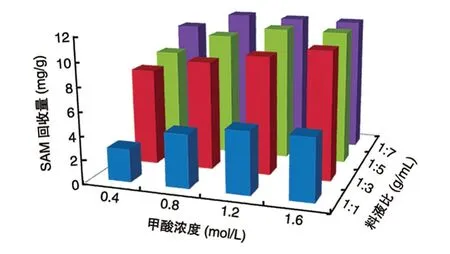
图2 甲酸浓度和料液比对SAM 回收量的影响
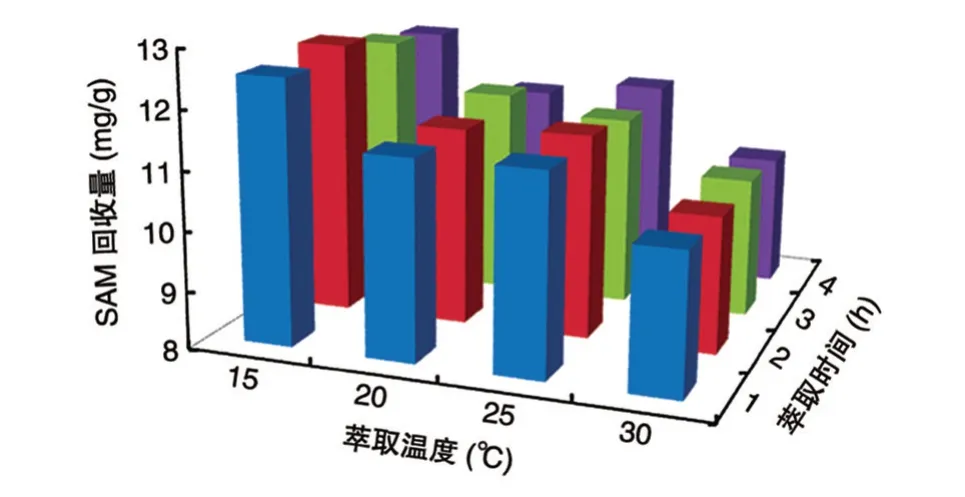
图3 提取温度和提取时间对SAM 回收量的影响
2.3 提取温度和提取时间对SAM回收量的影响
以甲酸为提取剂,料液比为1∶5 g/ml、甲酸浓度为1.2 mol/L 时,在不同提取温度(15、20、25、30℃)下进行不同时间(1、2、3、4 h)的提取,获得胞内SAM 的回收量如图3。可以看出,对酿酒酵母细胞进行不同时间的处理,均是15℃条件下SAM 回收量高于其他温度条件,胞内SAM 回收量随提取温度升高而降低。这是由于SAM 作为一种生物活性分子,在较高温度下不稳定、易降解。当提取温度为15℃、提取时间为2 h 时,SAM 回收量达到最高,为12.68 mg/g;该温度下,提取时间延长至3 h 时,SAM 回收量下降至12.36 mg/g,4 h 时为12.18 mg/g。这也与SAM 随时间延长而降解有关,造成SAM 回收量逐步降低。因此,选取最适提取温度为15℃、提取时间为2 h。
2.4 最适甲酸提取条件下SAM提取效果
根据上述优化条件,确定甲酸提取酿酒酵母胞内SAM 的最佳条件为:甲酸浓度1.2 mol/L,料液比1∶5 g/mL,15℃振荡破碎2 h。此时,胞内SAM 的回收量达12.68 mg/g。对胞内提取物进行UPLC 分析,结果如图4。可以看出,与SAM 标准品相比,酿酒酵母甲酸提取物在SAM 出峰位置有显著的尖峰,但在SAM 出峰位置之后仍有不显著的杂峰。这说明SAM 为甲酸提取物中的主要成分,但仍有少量杂质,需要进一步的分离纯化以获得纯度更高的SAM 产物。

图4 酿酒酵母胞内SAM 提取物及SAM 标准品UPLC 图谱
3 讨论
近年来,开发安全、高效、环保的SAM 提取工艺受到关注。谭天伟等以硫酸溶液为提取剂,分别在70℃的热水[14]和4℃的冷水[15]条件下提取酿酒酵母胞内SAM。李继安等[16]以无机强酸水溶液为提取液,同时辅以冻融手段破碎细胞,提取胞内SAM。李勇等[17]采用高压氮气挤压式细胞破碎法破碎酵母细胞,释放胞内SAM。这些工艺均避免了使用危险性较高的高氯酸溶液,但也都采用了物理方法辅助破碎细胞,增大了操作复杂性、增加了能耗。本研究中采用甲酸溶液提取酵母胞内SAM,提取率可以达到95%。有文献报道,甲酸对微藻细胞有较好的破碎效果[18]。本研究将甲酸用于酿酒酵母细胞破碎和抽提胞内SAM,具有创新性。经过对提取剂浓度、料液比、提取时间、提取温度等4 个因素的条件优化,在最优条件下,SAM 回收量可达12.68 mg/g,为SAM 提取工艺的进一步规模放大提供了基础。
经甲酸溶液破碎细胞和提取后,提取液中主要成分为SAM,但仍然会有蛋白质、多糖、核酸等杂质,需要进一步分离纯化。本课题组已在大孔弱酸树脂纯化SAM 的工艺方面取得进展[19-20],可作为本研究中甲酸提取工艺的下游工艺,形成SAM 提取、纯化的完整工艺流程,为SAM 的高效制备提供理论依据。
