miR-27a-3p对膀胱癌细胞EJ和5637生长的影响及其分子机制
2018-04-10毛万里张好春胡攀攀
毛万里,赵 英,王 彬,张好春,王 斌,胡攀攀
(1重庆市永川区人民医院急诊科,重庆 402160;2重庆市永川区人民医院检验科;3重庆钢铁集团总医院神经外科;4重庆市永川区人民医院泌尿外科;5重庆市大坪医院肿瘤中心;*通讯作者,E-mail:cqycmjx@sina.com)
膀胱癌约占癌症相关死亡的3%,是男性癌症相关死亡的第九大常见原因[1]。尽管针对膀胱癌的治疗有手术治疗、放射治疗和化疗等多种疗法,但膀胱癌的5年生存率仍较低[2]。微小RNA(miRNA)是一类长度约为22个核苷酸的非编码单链小RNA分子,miRNA表达异常与多种肿瘤的发生发展相关[3]。miRNA为靶点的基因治疗日益成为膀胱癌治疗研究的重点[4]。miR-27a-3p是近年来研究发现的具有抑制肝癌、鼻咽癌、骨肉瘤等多种肿瘤生物学行为的小分子RNA[5-7],但其在膀胱癌细胞中的作用尚不明了。本研究观察过表达miR-27a-3p对膀胱癌细胞生长的影响,探讨其可能的分子机制,为以miR-27a-3p为靶点的基因治疗提供实验和理论基础。
1 材料与方法
1.1 细胞株及主要试剂
膀胱癌细胞株EJ和5637购于中国典型培养物保藏中心;miR-27a-3p mimics、miR-NC购于广州市锐博生物科技有限公司;RPMI-1640培养基、胎牛血清购于美国Gibco公司;lipofectamine 2000、细胞周期试剂盒购于美国Invitrogen公司;噻唑蓝(MTT)试剂盒购于上海碧云天生物技术有限公司;荧光定量PCR试剂盒购于日本TaKaRa公司;一抗KRAS、p-Raf-1、p-MEK、p-ERK和β-Actin均购于美国BD公司。
1.2 细胞培养及转染
用含10% FBS的RPMI-1640培养基培养膀胱癌细胞EJ和5637,培养条件为37 ℃、5%CO2饱和湿度,取对数生长期细胞进行后续实验。实验分为两组:miR-NC组(转染miR-NC)和miR-27a-3p组(转染miR-27a-3p),根据lipofectamine 3000说明书进行转染。
1.3 MTT检测细胞增殖活性
将转染后24 h的EJ和5637细胞按3 000个/孔接种于96孔板,每组设3个复孔。分别于第1,2,3,4,5天,使用MTT试剂盒检测细胞增殖活性。具体操作如下:在检测前每孔先加入20 μl 5 g/L的MTT溶液,培养箱中继续培养4 h,吸去培养液,每孔加入150 μl二甲基亚砜,振荡15 min,酶标仪读取各孔在490 nm波长处所对应的吸光度A值。
1.4 集落形成实验检测细胞增殖能力
转染后24 h,消化收集EJ和5637细胞,按1 000个/孔接种于6孔板。连续培养10 d,甲醇10 min,0.5%的结晶紫溶液染色30 min,清水缓慢吸去多余染液,晾干后每孔取4个视野计数集落数取平均值,实验重复4次。
1.5 流式细胞术检测细胞周期分布
转染后48 h,消化收集EJ和5637细胞,使用细胞周期试剂盒检测细胞周期分布。具体操作如下:预冷的PBS溶液洗3次,离心后用预冷的70%乙醇溶液重悬细胞,4 ℃固定3 h,PBS溶液洗3次,加入100 mg/L RNase A在37 ℃水浴30 min,加入含50 mg/L碘化丙啶溶液的PBS溶液500 μl,4 ℃避光孵育30 min,流式细胞仪检测细胞周期分布。
1.6 miR-27a-3p靶基因预测
参考文献[8]及使用miRNA靶基因预测网站TargetScanHuman 6.2(http://www.targetscan.org/vert-61/)预测miR-27a-3p的靶基因为KRAS,miR-27a-3p与KRAS序列互补结合区域见图1。
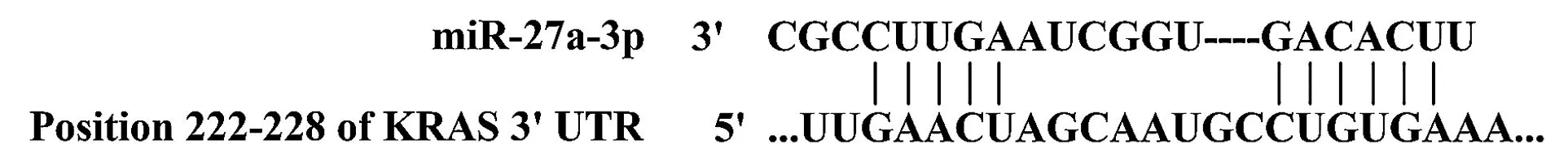
图1TargetScanHuman 6.2基因预测网站预测miR-27a-3p靶基因
Figure 1TargetScanHuman 6.2 gene prediction website predicts miR-27a-3p target gene
1.7 qRT-PCR检测KRAS mRNA表达
提取转染后48 h细胞总RNA,并逆转录为cDNA,以GAPDH为内参,使用荧光定量PCR试剂盒进行qRT-PCR检测,PCR扩增条件为:95 ℃ 60 s;95 ℃ 5 s,60 ℃ 30 s,72 ℃ 30 s,40个循环。最终Ct值均以2-ΔΔCt分析。GAPDH引物序列:上游5′-GGAGCGAGATCCCTCCAAAAT-3′,下游5′-GGCTGTTGTCATACTTCTCATGG-3′。KRAS引物序列:上游5′-ACAGAGAGTGGAGGATGCTTT-3′,下游5′-TTTCACACAGCCAGGAGTCTT-3′。
1.8 Western blot检测KRAS蛋白及下游靶蛋白表达
收集转染后48 h EJ和5637细胞,提取细胞总蛋白,每组分别取30 μg蛋白样品进行聚丙烯酰氨凝胶电泳,转至NC膜,脱脂牛奶封闭,一抗、二抗孵育,滴加显影剂显影。
1.9 统计学分析
2 结果
2.1 过表达miR-27a-3p对膀胱癌细胞增殖能力的影响
MTT法检测细胞增殖能力结果显示,在第5天,miR-NC组和miR-27a-3p组EJ细胞的吸光度A值分别为1.53±0.13和1.00±0.09(t=3.32,P=0.03),5637细胞的吸光度A值分别为1.42±0.09和0.93±0.09(t=3.999,P=0.016),转染miR-27a-3p组的膀胱癌细胞吸光度明显低于miR-NC组,差异有统计学意义(P<0.05,见图2)。该结果显示,过表达miR-27a-3p的EJ和5637细胞的增殖能力受到明显抑制。
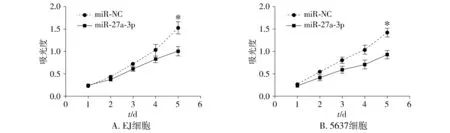
与miR-NC比较,*P<0.05图2 MTT法检测miR-27a-3p对膀胱癌细胞增殖能力的影响Figure 2 Effect of miR-27a-3p on the proliferation of bladder cancer cells by MTT assay
2.2 过表达miR-27a-3p对膀胱癌细胞集落形成能力的影响
集落形成实验显示,miR-NC组和miR-27a-3p组EJ细胞形成的集落数分别为159.20±16.83和53.56±10.92(t=5.267,P=0.002),5637细胞形成的集落数分别为194.90±11.52和114.10±18.88(t=3.653,P=0.011)。与miR-NC组相比,过表达miR-27a-3p的膀胱癌细胞形成的集落数显著减少(P<0.05,见图3),提示过表达miR-27a-3p后膀胱癌细胞增殖能力被抑制。
2.3 过表达miR-27a-3p对膀胱癌细胞周期分布的影响
流式细胞术显示,miR-27a-3p组中G0/G1期细胞比例明显高于miR-NC组(P<0.01),S期和G2/M期细胞比例明显低于对照组(P<0.05,见表1,图4),表明miR-27a-3p可显著抑制膀胱癌细胞周期的进展。
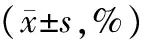
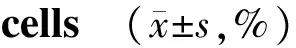

细胞 分组 G0/G1 S G2/MEJmiR⁃NC4004±3243330±3992667±085miR⁃27a⁃3p6329±798∗∗2404±360∗1267±466∗∗5637miR⁃NC4924±5792634±3902442±220miR⁃27a⁃3p6843±721∗∗1802±289∗1356±510∗∗
与miR-NC比较,*P<0.05,**P<0.01
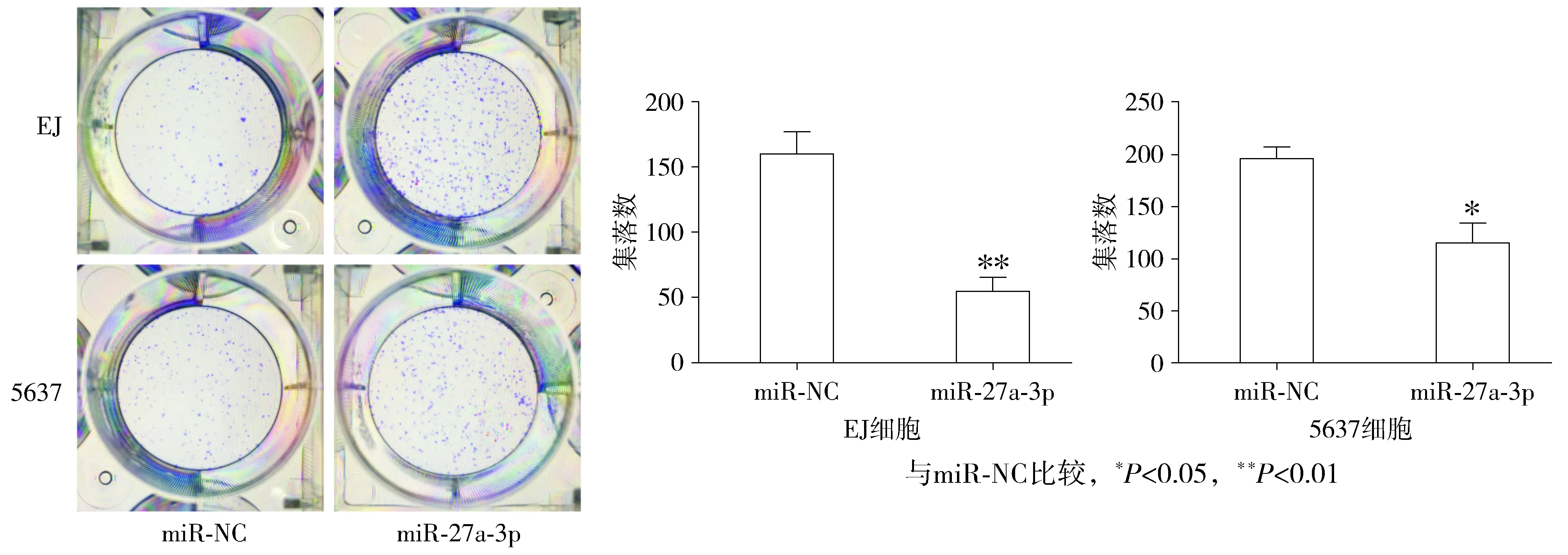
图3 miR-27a-3p对膀胱癌细胞集落形成能力的影响Figure 3 Effect of miR-27a-3p on colony forming ability of bladder cancer cells
图4 miR-27a-3p对膀胱癌细胞周期的影响Figure 4 Effect of miR-27a-3p on cell cycle of bladder cancer cells
2.4 过表达miR-27a-3p对膀胱癌细胞中KRAS mRNA表达的影响
qRT-PCR结果显示,miR-NC组和miR-27a-3p组EJ细胞中KRAS mRNA相对表达量分别为1.02±0.11和0.32±0.09(t=4.812,P=0.003),5637细胞中KRAS mRNA相对表达量分别为1.00±0.03和0.18±0.02(t=24.160,P<0.001)。miR-27a-3p中KRAS mRNA相对表达量明显低于miR-NC组(P<0.01,见图5),表明miR-27a-3p具有抑制KRAS mRNA表达的作用。
2.5 过表达miR-27a-3p对膀胱癌细胞KRAS蛋白及下游蛋白表达的影响
Western blot结果显示,与miR-NC组相比,miR-27a-3p组中KRAS及下游蛋白p-Raf-1、p-MEK、p-ERK的表达明显降低(见图6),表明miR-27a-3p具有抑制KRAS蛋白及下游蛋白表达的作用。
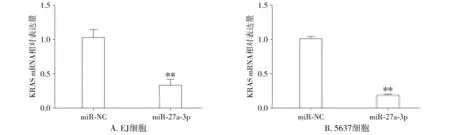
与miR-NC比较,**P<0.01图5 qRT-PCR检测KRAS mRNA表达情况Figure 5 KRAS mRNA expression in bladder cancer cells after miR-27a-3p overexpression by qRT-PCR
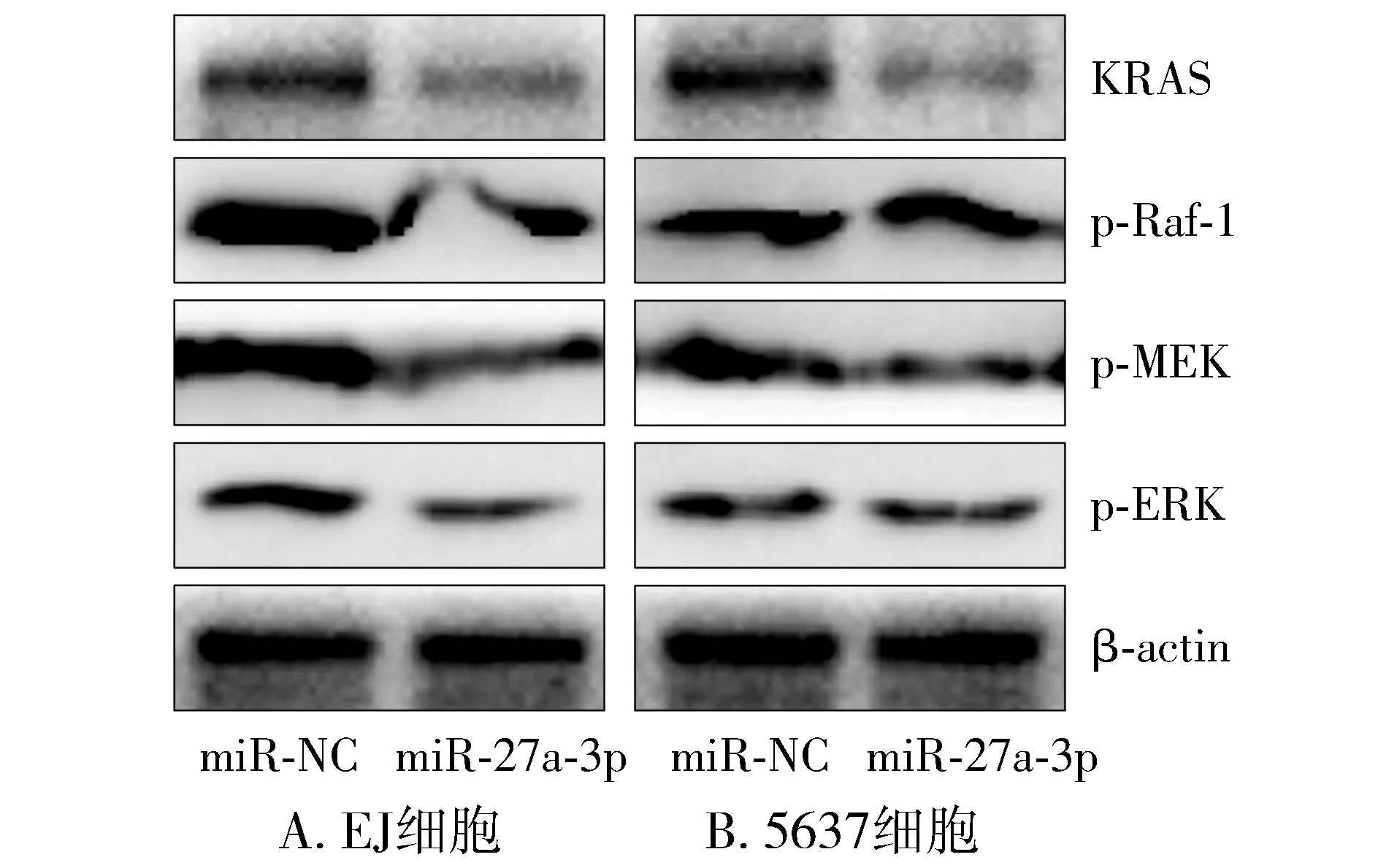
图6 Western blot检测KRAS及下游蛋白表达情况Figure 6 Expression of KRAS and downstream proteins in bladder cancer cells after miR-27a-3p overexpression by Western blot
3 讨论
miRNA是一类内源性的非编码RNA,通过特异性结合于基因mRNA的3′UTR区域发挥干扰基因表达的作用[4,9]。miR-27a-3p参与多种疾病包括肿瘤的发生、发展。miR-27a-3p可通过干扰SFRP1基因的表达调控Wnt/beta-catenin信号通路,抑制神经胶质瘤细胞的生物学行为[10]。miR-27a-3p能抑制人成胶质细胞瘤中BTS2基因的表达,并显著抑制其生长和迁移[11]。也有研究表明,miR-27a-3p促进肿瘤的生长,miR-27a-3p可通过抑制PPAR-γ基因的表达促进肝癌细胞的增殖[12]。miR-27a-3p也可促进靶基因的表达,如miR-27a-3p可导致宫颈癌中B4GALT3基因的表达增加,促进EMT过程的发生,提升宫颈癌细胞的转移能力[3]。然而,miR-27a-3p在膀胱癌中的作用研究尚未明了。
本实验证实,转染miR-27a-3p后的膀胱癌细胞的增殖能力降低,细胞周期进展阻滞,提示过表达miR-27a-3p具有抑制膀胱癌细胞增殖的作用。本研究参考文献[8]及miRNA-mRNA基因预测网站TargetScanHuman 6.2认为miR-27a-3p可能通过抑制KRAS发挥作用。膀胱癌的发生、发展受多种基因的调控,KRAS是被普遍认为的一种癌基因,与膀胱癌的增殖、分化、凋亡等生物学行为密切相关[13]。因而,通过阻断KRAS基因的表达,可能会抑制膀胱癌细胞的生长。本研究证实,过表达miR-27a-3p可明显抑制KRAS基因的表达。KRAS参与调控MAPK信号通路的传导,MAPK信号通路与肿瘤的增殖、分化、凋亡和衰老等生物学行为密切相关,参与肿瘤的发生、发展,在多数肿瘤中均发现该信号通路的异常[14]。本研究结果表明,过表达miR-27a-3p下调KRAS基因的表达后,p-Raf-1、p-MEK、p-ERK蛋白的表达均明显下调,表明MAPK信号通路的异常传导被抑制。由此可知,miR-27a-3p抑制膀胱癌细胞的增殖可能是通过抑制KRAS基因的表达,进一步干扰MAPK信号通路的转导实现。有研究表明,MAPK信号通路与肿瘤的转移密切相关[15],miR-27a-3p是否可通过阻断MAPK信号通路抑制膀胱癌细胞的迁移和侵袭能力是本研究下一步研究的重点。
综上所述,本研究证实miR-27a-3p可明显抑制膀胱癌细胞的增殖能力,其可能的分子机制为miR-27a-3p抑制KRAS蛋白的表达,进而阻断MAPK信号通路的传导,为未来miRNA靶向治疗膀胱癌提供了有力的实验基础。
参考文献:
[1]Sankin A, Narasimhulu D, John P,etal. The expanding repertoire of targets for immune checkpoint inhibition in bladder cancer: What lies beneath the tip of the iceberg, PD-L1[J].Urol Oncol,2017,pii:S1078-1439(17)30176-X.
[2]Pinto IG. Systemic therapy in bladder cancer[J]. Indian J Urol, 2017, 33(2):118-126.
[3]Sun Y, Yang X, Liu M,etal. B4GALT3 up-regulation by miR-27a contributes to the oncogenic activity in human cervical cancer cells[J]. Cancer Lett, 2016, 375(2):284-292.
[4]Mitash N, Tiwari S, Agnihotri S,etal. Bladder cancer: Micro RNAs as biomolecules for prognostication and surveillance[J]. Indian J Urol, 2017, 33(2):127-133.
[5]Zhao N, Sun H, Sun B,etal. miR-27a-3p suppresses tumor metastasis and VM by down-regulating VE-cadherin expression and inhibiting EMT: an essential role for Twist-1 in HCC[J]. Sci Rep, 2016, 6:23091.
[6]Li L, Luo Z. Dysregulated miR-27a-3p promotes nasopharyngeal carcinoma cell proliferation and migration by targeting Mapk10[J]. Oncol Rep, 2017, 37(5):2679-2687.
[7]Salah Z, Arafeh R, Maximov V,etal. miR-27a and miR-27a* contribute to metastatic properties of osteosarcoma cells[J]. Oncotarget, 2015, 6(7):4920-4935.
[8]Zhu L, Wang Z, Fan Q,etal. microRNA-27a functions as a tumor suppressor in esophageal squamous cell carcinoma by targeting KRAS[J]. Oncol Rep, 2014, 31(1):280-286.
[9]Keklikoglou I, Hosaka K, Bender C,etal. MicroRNA-206 functions as a pleiotropic modulator of cell proliferation, invasion and lymphangiogenesis in pancreatic adenocarcinoma by targeting ANXA2 and KRAS genes[J]. Oncogene,2015,34(37):4867-4878.
[10]Wang K, Xie D, Xie J,etal. MiR-27a regulates Wnt/beta-catenin signaling through targeting SFRP1 in glioma[J]. Neuroreport, 2015, 26(12):695-702.
[11]Li WQ, Yu HY, Zhong NZ,etal. miR27a suppresses the clonogenic growth and migration of human glioblastoma multiforme cells by targeting BTG2[J]. Int J Oncol, 2015, 46(4):1601-1608.
[12]Li S, Li J, Fei BY,etal. MiR-27a promotes hepatocellular carcinoma cell proliferation through suppression of its target gene peroxisome proliferator-activated receptor gamma[J]. Chin Med J (Engl), 2015, 128(7):941-947.
[13]Ouerhani S, Bougatef K, Soltani I,etal. The prevalence and prognostic significance of KRAS mutation in bladder cancer, chronic myeloid leukemia and colorectal cancer[J]. Mol Biol Rep, 2013, 40(6):4109-4114.
[14]Burotto M, Chiou VL, Lee JM,etal. The MAPK pathway across different malignancies: a new perspective[J]. Cancer, 2014, 120(22):3446-3456.
[15]Sun Y, Liu WZ, Liu T,etal. Signaling pathway of MAPK/ERK in cell proliferation, differentiation, migration, senescence and apoptosis[J]. J Recept Signal Transduct Res, 2015, 35(6):600-604.
