salen-Mn通过LKB1/AMPK信号通路抑制膀胱癌T24细胞的上皮间质转化
2018-04-10寇青山
寇 博,刘 伟,寇青山
(1西安交通大学医学部第一附属医院心血管外科,西安 710061;2西安交通大学医学部第一附属医院泌尿外科;3咸阳市第一人民医院体检中心;*通讯作者,E-mail:821957325@qq.com)
膀胱癌是泌尿系统最为常见的恶性肿瘤之一。一般将膀胱癌分为非肌层浸润性膀胱癌和肌层浸润性膀胱癌两种。据报道,10%-20%的非肌层浸润性膀胱癌会进展为肌层浸润性膀胱癌,而肌层浸润性膀胱癌的特点是进展快,且生存率低,易发生转移[1,2]。当膀胱癌发生远处转移时,其5年存活率不超过10%[3]。上皮间质转化(epithelial-mesenchymal transition, EMT)是指上皮细胞变为间质细胞,并具备间质细胞特性的一种生物学现象,也是肿瘤细胞能够局部浸润和远处迁移的重要机制。肿瘤细胞可以通过EMT来获取间质细胞的侵袭性,并浸润至邻近组织,随后远处种植形成转移病灶[4]。由此可知,抑制EMT是抗肿瘤侵袭转移的研究方向之一。
Schiff碱是一类含有碳氮双键的化合物,根据碳氮双键的数目将其分为三类:希夫碱,双希夫碱(salen)以及大环希夫碱[5]。由于希夫碱含有碳氮双键,其可以和多种金属离子配合,并形成金属配合物。这些金属配合物具有抑菌、抑癌、抗炎等多种作用[6]。salen是一类含有两个碳氮双键的希夫碱化合物,于1889年首次被Combers等学者合成。目前,关于金属salen配合体在肿瘤内的研究较少,且尚无其对膀胱癌细胞作用的报道。本研究旨在探究salen-Mn(锰-双希夫碱复合物)对膀胱癌侵袭转移的作用及其机制,以期为salen-Mn的临床应用提供一定的理论依据。
1 材料与方法
1.1 细胞培养和主要试剂
人膀胱癌T24细胞为西安交通大学第一附属医院公共平台实验室所保有,salen-Mn由西安交通大学药学院合成。DMEM培养基、胎牛血清均购自美国Gibco公司,Transwell小室购于美国Millcell公司,X-tremeGene siRNA转染试剂购自Roche公司,单克隆抗体E-cadherin、N-cadherin、Vimentin、p-LKB1、LKB1、p-AMPK、AMPK、β-actin购自美国CST公司,PCR引物、反转录试剂盒均由日本Takara公司合成。
细胞常规用含10%胎牛血清的DMEM培养基培养,培养基预先加入青霉素(100 U/ml)和链霉素(100 U/ml),置于37℃、含5% CO2的细胞孵育箱内培养。细胞需要定期换液,待细胞密度长至80%-90%可传代。
1.2 MTT实验检测细胞增殖能力
膀胱癌T24细胞经消化重悬后以每孔1×104个接种到96孔板内,设置5个平行孔。待细胞密度长至90%时给予不同浓度的salen-Mn处理(1.25,2.5,5.0,10,20,30 μmol/L),在37 ℃培养箱继续培养24 h,每孔加入含20 μl MTT和180 μl培养基的混液并继续培养4 h,弃废液后每孔加入150 μl DMSO,漩涡振荡器振荡10 min,在490 nm波长下检测细胞的OD值。
1.3 细胞划痕实验检测细胞迁移能力
细胞经胰酶消化重悬后接种至6孔板内,待细胞密度长至90%,用灭菌PBS缓冲液清洗,并用200 μl枪头沿直线划痕,加入2 ml无血清培养基并作相应处理,显微镜下观察并拍照。
1.4 Transwell迁移实验检测细胞迁移能力
细胞经胰酶消化,用无血清DMEM培养基重悬,并用计数板计数。将Transwell小室置于24孔板内,其上室加入200 μl含3×104的T24细胞,并加入salen-Mn处理,而24孔板内则加入800 μl含10%胎牛血清的培养基。随后在37 ℃细胞培养箱内培养24 h,取出后用4%多聚甲醛固定10 min,0.1%结晶紫染液染色10 min,PBS缓冲液清洗后,用棉签擦拭Transwell上室以及侧壁,最后用倒置显微镜下观察,选择5个随机视野拍照计数,统计分析。
1.5 Transwell侵袭实验检测细胞侵袭能力
在Transwell上室预先加入60 μl的Matrigel混液(Matrigel ∶无血清培养基=1 ∶5),后续处理同Transwell迁移实验。最后也需用倒置显微镜观察,选择5个随机视野拍照计数,统计分析。
1.6 实时定量PCR检测基因转录水平的表达变化
细胞经处理后用Trizol法提取总RNA,定量后按照Takara反转录试剂盒说明书合成cDNA。PCR所需引物由日本Takara公司合成。引物序列为E-cadherin正义5′-CGAGAGCTACACGTTCACGG-3′,反义5′-GGGTGTCGAGGGAAAAATAGG-3′;N-cadherin正义5′-TCAGGCGTCTGTAGAGGCTT-3′,反义5′-ATGCACATCCTTCGATAAGACTG-3′;Vimentin正义5′-GACGCCATCAACACCGAGTT-3′,反义5′-CTTTGTCGTTGGTTAGCTGGT-3′;β-actin正义5′-CATGTACGTTGCTATCCAGGC-3′,反义5′-CTCCTTAATGTCACGCACGAT-3′。随后通过实时定量PCR进行扩增,并利用BioRad CFX Manager软件进行定量分析。
1.7 Western检测蛋白水平的表达变化
细胞经处理后用PBS缓冲液清洗,弃废液,用RIPA裂解液裂解细胞。离心后提取上清蛋白,并行蛋白定量。取15 μg变性后的蛋白样品行聚丙烯酰胺凝胶电泳,用PVDF膜转膜2 h,5%脱脂奶粉封闭1 h,随后加入一抗(稀释比例均为1 ∶1 000)4 ℃孵育过夜。TBST液洗膜3次,每次5 min,再室温孵育二抗(稀释比例1 ∶1 000)1 h。TBST液洗膜3次,每次5 min,滴加显影液(美国Bio-Rad公司)显影,用凝胶成像软件Image Lab(美国Bio-Rad公司)分析。
1.8 siRNA转染用于靶基因的表达沉默
取两个1.5 ml无酶离心管,各加入100 μl无血清培养基,随后1个离心管内加入2 μl LKB1的siRNA试剂,另1个离心管内加入10 μl X-treme GENE siRNA转染试剂,吹打混匀后均静置5 min,随后两离心管内混液混匀再静置15 min,加入至6孔板内,补足培养基至2 ml,在培养箱内培养48 h,再做后续的细胞划痕、Transwell侵袭迁移以及Western blot等实验。
1.9 统计学分析
数据通过GraphPad 5.2软件进行分析,并用均值±标准差来表示。组间差异采用t检验,P<0.05视为差异有统计学意义。
2 结果
2.1 salen-Mn对膀胱癌细胞增殖的影响
首先通过MTT检测salen-Mn对膀胱癌细胞的增殖能力以排除增殖对salen-Mn的抗侵袭迁移能力影响。结果显示salen-Mn可以剂量依赖性地抑制膀胱癌细胞的增殖(见图1)。且在浓度≤10 μmol/L时salen-Mn对膀胱癌细胞的抑制率小于10%,因此选取10 μmol/L作为salen-Mn在膀胱癌侵袭迁移作用的用药浓度。
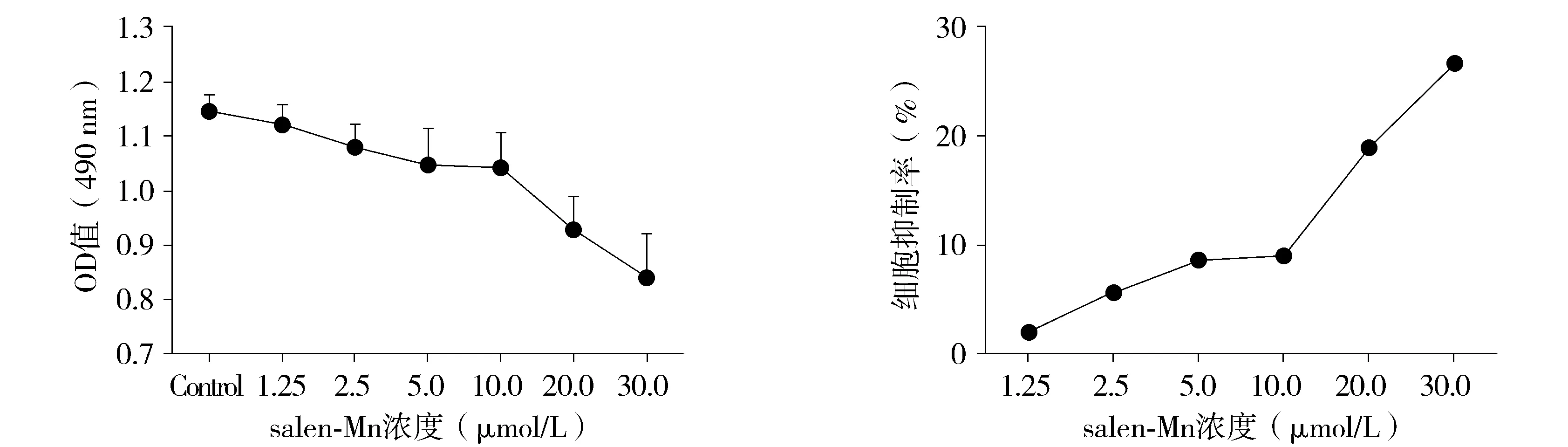
A.细胞的活性变化 B.生长抑制率 图1 MTT法检测salen-Mn对膀胱癌T24细胞增殖的影响Figure 1 Effect of salen-Mn on the proliferation of human bladder cancer T24 cells by MTT
2.2 salen-Mn对膀胱癌细胞侵袭迁移的影响
细胞划痕实验提示,salen-Mn处理组的划痕间距明显宽于未处理组(见图2A)。而随后的Transwell迁移实验则显示salen-Mn处理组的迁移细胞数少于其对照组,这充分提示salen-Mn可以抑制膀胱癌T24细胞的迁移能力(见图2B)。而Transwell侵袭实验则显示salen-Mn处理组的侵袭细胞数少于其对照组,且差异具有统计学意义(P<0.05,见图2B)。说明salen-Mn也能够抑制膀胱癌T24细胞的侵袭能力。
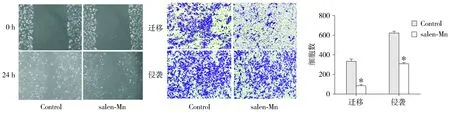
A.细胞划痕实验 B.Transwell迁移和侵袭实验(与对照比较,*P<0.000 1)图2 salen-Mn作用24 h对膀胱癌T24细胞侵袭迁移的影响Figure 2 Effect of salen-Mn on migration and invasion of human bladder cancer cells
2.3 salen-Mn对膀胱癌细胞EMT的影响
实时定量PCR显示,salen-Mn可以上调E-cadherin的mRNA水平,同时下调N-Cadherin和Vimentin的mRNA水平(P<0.05,见图3A)。随后通过Western blot进一步检测salen-Mn处理后的EMT指标蛋白水平的变化。结果显示,膀胱癌T24细胞经salen-Mn处理后,细胞内的E-cadherin蛋白表达上调,而N-Cadherin和Vimentin蛋白水平则呈剂量依赖性的下调(见图3B)。这表明salen-Mn能抑制膀胱癌T24细胞的上皮间质转化。
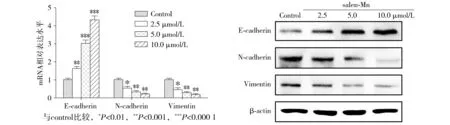
A. PCR结果 B. Western blot结果图3 salen-Mn对膀胱癌T24细胞上皮间质转化的影响Figure 3 Effect of salen-Mn on epithelial-mesenchymal transition of human bladder cancer cells
2.4 LKB1/AMPK信号通路参与了salen-Mn对膀胱癌EMT和侵袭迁移的调控
通过Western blot实验检测LKB1/AMPK信号通路蛋白在salen-Mn处理的T24细胞内的表达,结果显示p-LKB1和p-AMPK蛋白水平呈逐渐升高,而总LKB1和AMPK并无变化(见图4A)。随后用siRNA转染技术敲低LKB1,结果显示salen-Mn所引起的E-cadherin上调会被抑制,而N-cadherin的下调会有所回复(见图4B)。随后通过细胞划痕实验和Transwell实验我们进一步得知LKB1的敲低可以一定程度上逆转salen-Mn对膀胱癌T24细胞的抗侵袭迁移作用(见图4C和D)。这提示salen-Mn通过LKB1/AMPK信号通路抑制膀胱癌T24细胞的上皮间质转化和侵袭迁移。
3 讨论
文献报道salen-Mn衍生物对癌细胞的细胞毒作用强于正常细胞[7],这说明salen-Mn对癌细胞的高选择性。salen-Mn可以诱导乳腺癌MCF7细胞的凋亡[7]。而在结肠癌CCL228细胞中salen-Mn可以促进线粒体内的细胞色素转位至胞质内,并增加caspase3/7的活性[8]。在本研究中salen-Mn可以显著抑制膀胱癌T24细胞的增殖,以及侵袭转移。多项研究证实EMT在膀胱癌的侵袭转移中扮演着重要的角色[9]。有学者通过免疫组织化学以及PCR检测了膀胱癌组织中EMT指标的变化,结果显示膀胱癌组织中E-cadherin表达水平下调,而Snail、Slug等间质性指标则表达升高,且与肿瘤的复发和转移呈正相关关系[10,11]。而本研究则通过Western blot和实时定量PCR证实salen-Mn可以抑制膀胱癌细胞T24的上皮间质转化,这进一步表明salen-Mn具有抗侵袭转移作用。
关于金属-salen抗癌机制尚不十分明确。研究显示金属-salen复合物合可以下调Wnt-1的表达,进而降解细胞内的β-catenin,从而导致肝癌细胞的增殖受到抑制[12]。同时金属-salen复合物也可以诱导DNA损伤,使癌细胞增殖受限[13,14]。而在本研究中salen-Mn可以上调p-LKB1和p-AMPK蛋白的表达。LKB1是一种抑癌基因,大量文献表明LKB1可以诱导肿瘤细胞的凋亡和周期阻滞[15,16]。也有文献报道LKB1/AMPK可以参与肿瘤的侵袭转移过程[17]。LKB1的敲低可以上调EMT指标snail的表达[18]。在本研究中LKB1的敲低可以逆转salen-Mn所引起的E-cadherin的上调,以及N-cadherin的下调。salen-Mn对膀胱癌T24细胞侵袭迁移的抑制作用一定程度上被LKB1的敲低所逆转。这说明salen-Mn对膀胱癌上皮间质转化以及侵袭迁移的调控是由LKB1介导。
总之,salen-Mn能够抑制膀胱癌T24细胞的侵袭迁移,也能够逆转膀胱癌上皮间质转化,且salen-Mn极有可能是通过上调LKB1/AMPK信号通路来发挥其抗侵袭转移作用。

图4 LKB1/AMPK信号通路参与了salen-Mn对EMT和侵袭迁移的调控Figure 4 LKB1/AMPK signaling is involved in the regulation of salen-Mn on epithelial-mesenchymal transition, migration and invasion of human bladder cancer cells
参考文献:
[1]Kurth KH, Bouffioux C, Sylvester R,etal. Treatment of superficial bladder tumors: achievements and needs[J]. Eur Urol, 2000, 37(3):1-9.
[2]Shelley MD, Mason MD, Kynaston H. Intravesical therapy for superficial bladder cancer: a systematic review of randomised trials and meta-analyses[J].Cancer Treat Rev,2010,36(3):195-205.
[3]Abdollah F, Gandaglia G, Thuret R,etal. Incidence, survival and mortality rates of stage-specific bladder cancer in United States: a trend analysis[J]. Cancer Epidemiol, 2013, 37(3):219-225.
[4]Bhatia S, Monkman J, Toh A,etal. Targeting epithelial-mesenchymal plasticity in cancer: clinical and preclinical advances in therapy and monitoring[J].Biochem J,2017,474(19):3269-3306.
[5]Kang JS,Meier JL,Dervan PB.Design of sequence-specific DNA binding molecules for DNA methyltransferase inhibition[J]. J Am Chem Soc, 2014, 136(9):3687-3694.
[6]杨频,郭茂林.金属抗癌剂研究进展与两极互补理论[J].化学通报,1996,(1):6-11.
[7]Ansari KI, Grant JD, Kasiri S,etal. Manganese(III)-salens induce tumor selective apoptosis in human cells[J]. J Inorg Biochem, 2009, 103(5):818-826.
[8]Ansari KI, Kasiri S, Grant JD,etal. Apoptosis and anti-tumour activities of manganese(III)-salen and-salphen complexes[J]. Dalton Trans, 2009, (40):8525-8531.
[9]McConkey DJ, Choi W, Marquis L,etal. Role of epithelial-to-mesenchymal transition (EMT) in drug sensitivity and metastasis in bladder cancer[J]. Cancer Metastasis Rev, 2009, 28(3-4):335-344.
[10]Wu K, Zeng J, Zhou J,etal. Slug contributes to cadherin switch and malignant progression in muscle-invasive bladder cancer development[J].Urol Oncol,2013,31(8):1751-1760.
[11]Baumgart E, Cohen MS, Silva NB,etal. Identification and prognostic significance of an epithelial-mesenchymal transition expression profile in human bladder tumors[J]. Clin Cancer Res, 2007, 13(6):1685-1694.
[12]Azam M, Hussain Z, Warad I,etal. Novel Pd(II)-salen complexes showing high in vitro anti-proliferative effects against human hepatoma cancer by modulating specific regulatory genes[J]. Dalton Trans, 2012, 41(35):10854-10864.
[13]Mandal SS. Metallo-salen complexes show promise towards treatment of leukemia[J]. Leuk Res, 2011, 35(5):571-572.
[14]Ansari KI, Grant JD, Woldemariam GA,etal. Iron(III)-salen complexes with less DNA cleavage activity exhibit more efficient apoptosis in MCF7 cells[J]. Org Biomol Chem, 2009, 7(5):926-932.
[15]Liang X, Wang P, Gao Q,etal. Exogenous activation of LKB1/AMPK signaling induces G1arrest in cells with endogenous LKB1 expression[J]. Mol Med Rep, 2014, 9(3):1019-1024.
[16]Luo L, Huang W, Tao R,etal. ATM and LKB1 dependent activation of AMPK sensitizes cancer cells to etoposide-induced apoptosis[J]. Cancer Lett, 2013, 328(1):114-119.
[17]Kan JY, Yen MC, Wang JY,etal. Nesfatin-1/Nucleobindin-2 enhances cell migration, invasion, and epithelial-mesenchymal transition via LKB1/AMPK/TORC1/ZEB1 pathways in colon cancer[J]. Oncotarget, 2016, 7(21): 31336-31349.
[18]Roy BC, Kohno T, Iwakawa R,etal. Involvement of LKB1 in epithelial-mesenchymal transition (EMT) of human lung cancer cells[J]. Lung Cancer, 2010, 70(2):136-145.
