循环C1q/TNF相关蛋白1的水平与男性冠心病的关系
2018-04-10钟节雄杨宏华
钟节雄,杨宏华
(1武汉商职医院心血管内科,武汉 430000;2武汉大学人民医院儿科)
流行病学研究显示,肥胖症的发病率在世界范围内有所增加,已成为重要的社会问题[1]。肥胖症的发生能够引起一系列代谢紊乱,包括2型糖尿病、血脂异常和高血压,最终导致动脉粥样硬化性疾病的发展,如冠状动脉硬化心脏病(简称冠心病,coronary heart disease,CHD)[2-5]。近年来,冠心病的发病率持续增加,且有年轻化趋势,已成为威胁人类健康的疾病之一[6]。越来越多的证据表明,肥胖已成为冠心病、糖尿病和高血压等疾病的独立危险因素之一[7]。肥胖条件下脂肪细胞能够分泌多种脂肪因子,这些脂肪因子的含量失调对于各种肥胖并发症(如CHD)的发生具有极大的促进作用[8]。C1q和肿瘤坏死因子相关蛋白1(C1q and tumor necrosis factor related protein 1,CTRP1)作为一种脂肪因子,在脂肪组织中大量表达[9-11]。临床研究证实,循环系统高水平的CTRP1与代谢综合征有关[12]。尽管如此,循环系统中CTRP1含量与心血管疾病之间的关系研究仍较少。因研究过程中纳入研究的冠心病患者多为男性,且已有研究认为冠心病患者的危险因素存在性别差异[13]。因此,受研究对象等因素影响,本研究以男性冠心病为研究对象,旨在探讨血浆中CTRP1的水平与男性冠心病之间的相关性,为临床上冠心病的诊断和初步筛查指标提供理论依据。
1 资料与方法
1.1 临床资料
选取2013-07~2015-02首次在我院心内科经由冠状动脉造影术确诊的男性冠心病患者81例,年龄在35-81岁,平均年龄为(63.15±11.34)岁。冠心病的诊断标准[14]:在冠状动脉造影下至少有一支主要的冠状动脉发生器质性狭窄75%及以上。排除急性心肌梗死、充血性心力衰竭、血液透析及恶性肿瘤等肝、肺、肾疾病的患者。另外选取同期在本医院体检中心进行健康体检的健康男性55例作为对照,年龄39-79岁,平均年龄为(60.47±10.24)岁。对照组人群均无冠心病和冠心病病史以及服用相关药物史。糖尿病是依据世界卫生组织的标准[15]和/或正在进行糖尿病治疗来确定的。本研究经由医院伦理委员会批准,且所有患者及健康受试者均对本研究知情并签署知情同意书。
1.2 实验方法
收集冠心病患者和对照组人群的空腹静脉血液样本,分离血清,存入-80 ℃保存待测。采用酶联免疫吸附法(ELISA)检测血清CTRP1、脂联素含量水平。采用标准检测法测定总胆固醇(TG)、高密度脂蛋白胆固醇(HDL-C)、低密度脂蛋白胆固醇(LDL-C)、甘油三酯(TG)、空腹血糖(FPG)和肌酐(Scr)水平。受检者静坐10 min后测量血压(BP)、身高和体质量,并计算出受检者的体质量指数(BMI),计算公式为BMI=体质量(kg)/身高2(m2)。依据肾脏病饮食调整改良公式,并采用临床资料中血清循环肌酐水平、年龄和性别来评估肾小球滤过率预计值(eGFR)。男性的eGFR精确计算公式[16]:175×Scr(mg/dl)-1.234×年龄(岁)-0.179。
1.3 统计学方法

2 结果
2.1 两组受检者的临床参数比较
CHD患者和健康受试者的临床参数指标统计结果显示,两组受试者的年龄、吸烟史、舒张压、TG、HDL-C、Scr以及eGFR均无显著性差异。但男性CHD患者收缩压和BMI值明显高于健康男性,且FBG含量和糖尿病患病比率均要高于健康男性,且差异均具有统计学意义(P<0.05)。此外,与健康男性比较,CHD患者TC和LDL-C含量明显升高,CTRP1水平也显著增加,脂联素水平明显降低(均P<0.05,见表1)。结果提示,血脂水平、脂联素和CTRP1含量与男性冠心病之间也可能存在关系。
表1冠心病患者与对照人群的临床参数比较
Table1ComparisonofclinicaldatabetweenCHDpatientsandcontrols

临床特征冠心病组(n=81)对照组(n=55)t/χ2P年龄(岁)6315±11346047±102404450741BMI(kg/m2)2478±209 2275±199 6741<0001吸烟史(%)3704309105440461收缩压(mmHg)13024±1014 11572±1084 42990037舒张压(mmHg)8524±962 8047±975 22150248FBG(mmol/L)535±057476±06440570046糖尿病(%)222290940200045TC(mmol/L)498±062411±06745990033TG(mmol/L)175±071149±06911730342HDL⁃C(mmol/L)139±043141±04406190637LDL⁃C(mmol/L)284±048214±05040610045Scr(mg/dl)092±035089±04109470411eGFR(ml/min/173m2)7304±715 7088±783 29470075脂联素(μg/ml)503±075657±07157700018CTRP1(ng/ml)44784±4122 31027±3957 76190007
2.2 CTRP1与冠心病患者临床参数之间的相关性
将CTRP1与CHD临床参数(BMI、收缩压、FBG、TC、LDL-C和脂联素)进行相关性分析,结果显示,CTRP1与BMI呈正相关(P<0.05),与收缩压、空腹血糖FBG以及血脂(TC和LDL-C)水平也呈正相关性(均P<0.05),CTRP1与同为脂肪因子的脂联素呈负相关关系(P<0.05,见表2和图1)。
表2CTRP1与临床参数之间的相关性
Table2CorrelationbetweenCTRP1andclinicalparametersinCHDpatients
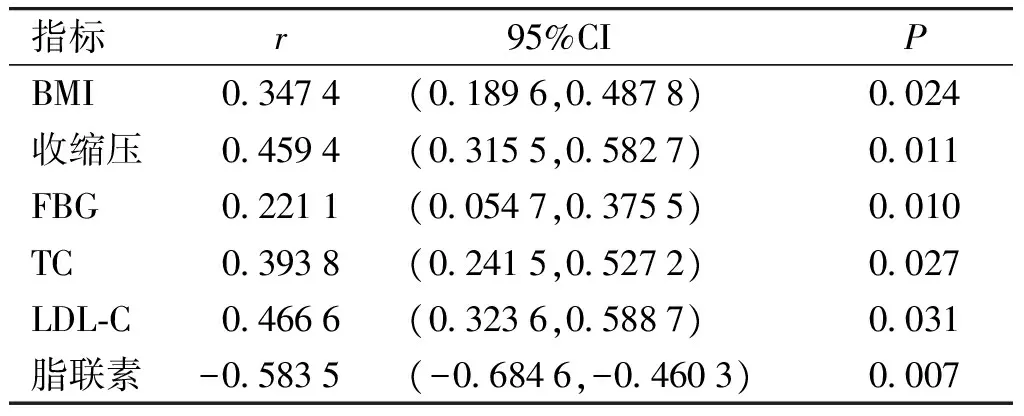
指标r 95%CIPBMI03474(01896,04878)0024收缩压04594(03155,05827)0011FBG02211(00547,03755)0010TC03938(02415,05272)0027LDL⁃C04666(03236,05887)0031脂联素-05835(-06846,-04603)0007
2.3 CTRP1与CHD疾病发生风险的关系
为研究血浆CTRP1水平与CHD疾病发生之间的关系,选取两组受检者临床参数中存在差异的指标(BMI、收缩压、FBG、TC、LDL-C和脂联素以及CTRP1)进行二元Logistic回归分析。结果显示,BMI、收缩压、FBG、TC、LDL-C均为冠心病的风险因子(均P<0.05,见表3),脂肪因子脂联素为冠心病的保护因子(P<0.05)。血浆中CTRP1含量同样为冠心病的风险因子(OR=1.347,P=0.009)。
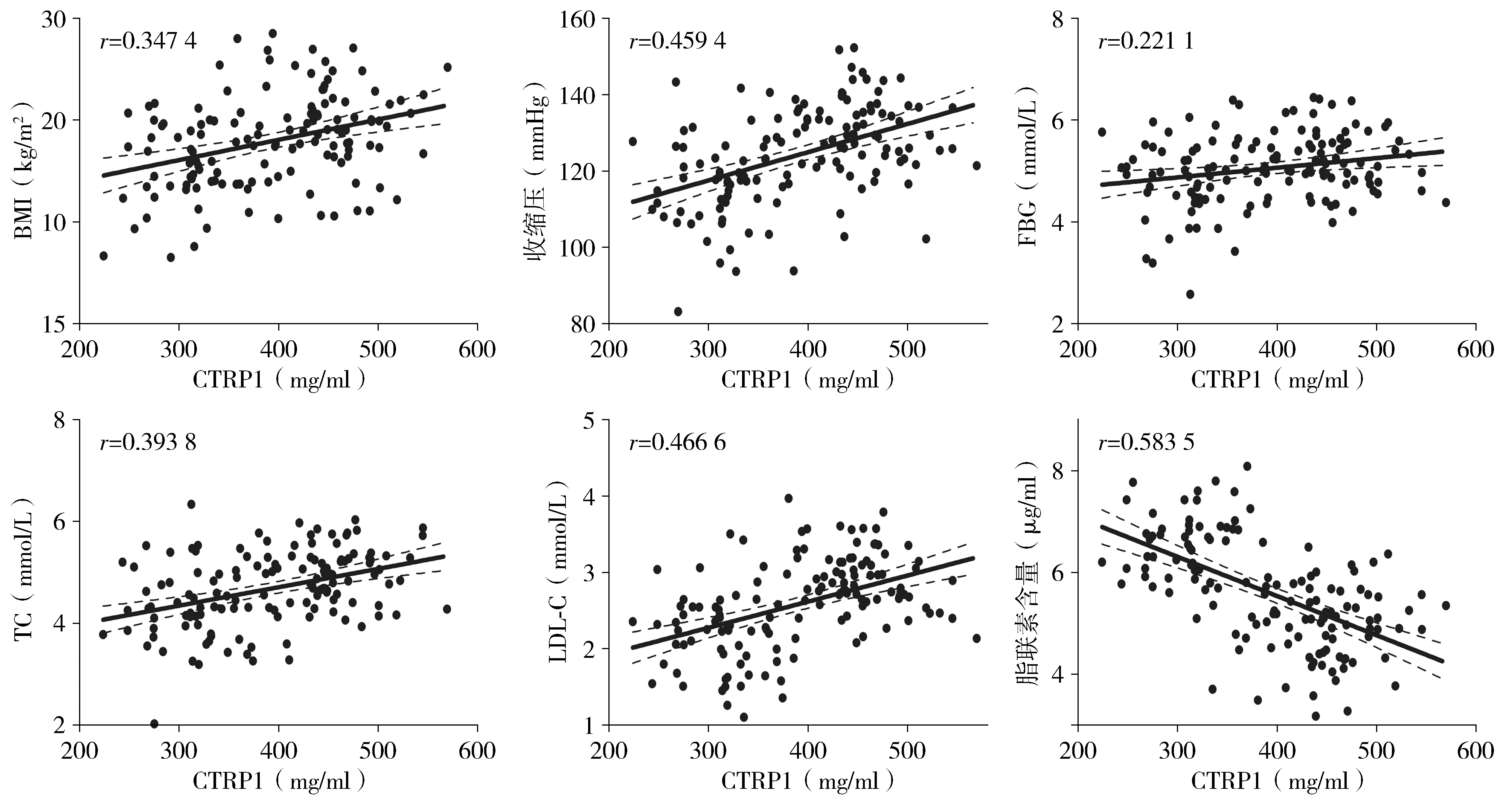
图1 血浆CTRP1水平与临床参数水平的关系Figure 1 Correlation between plasma CTRP1 and clinical parameters in CHD patients
表3冠心病的风险因子Logistic回归分析
Table3LogisticregressionanalysisofriskfactorsofCHDinmalepatients
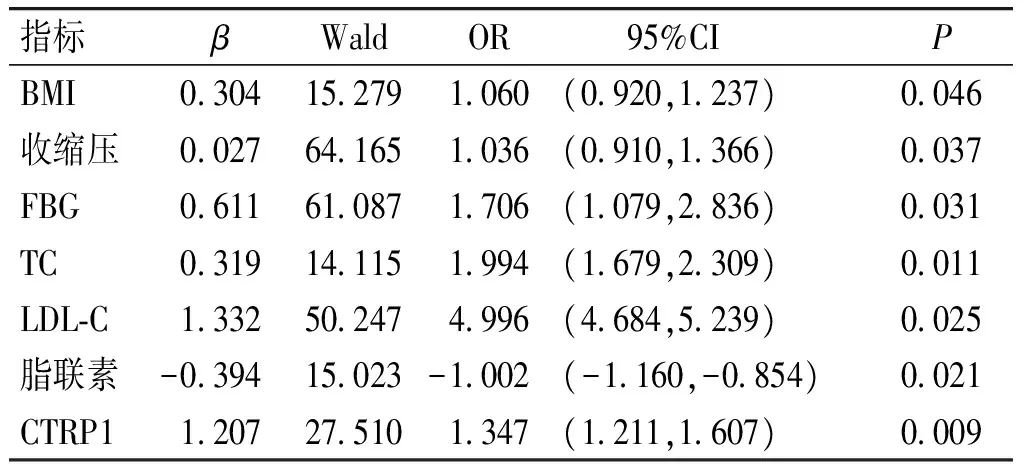
指标βWaldOR 95%CIPBMI0304152791060(0920,1237)0046收缩压0027641651036(0910,1366)0037FBG0611610871706(1079,2836)0031TC0319141151994(1679,2309)0011LDL⁃C1332502474996(4684,5239)0025脂联素-039415023-1002(-1160,-0854)0021CTRP11207275101347(1211,1607)0009
3 讨论
肥胖是体内脂肪组织过度积累引起体质量增加的一种病理状态,可导致高血压、糖尿病和冠心病(CHD)等疾病的发生,已成为CHD、糖尿病和高血压等疾病的独立危险因素之一[7]。脂肪组织不仅仅是机体最大的能量贮备器官,同时也是机体最大的内分泌器官,可分泌多种脂肪因子,如脂联素、瘦素等。越来越多的研究证实,脂联素、瘦素等脂肪因子与动脉粥样硬化有关,在CHD的发生发展过程中发挥重要的作用,可作为CHD疾病严重程度及预后的重要指标[17]。C1q/肿瘤坏死因子相关蛋白1(CTRP1)属于CTRP超家族,为近年来发现的由脂肪细胞分泌的新型细胞因子,与脂联素的空间结构类似[18]。本研究发现血浆CTRP1水平与另一脂肪因子脂联素水平呈负相关关系,这与既往研究发现代谢综合征患者血清CTRP1与脂联素的负相关性结论趋于一致[19]。
临床研究已经证实,CTRP1与心血管疾病的发生具有关系,高血压患者体内循环的CTRP1水平较正常人显著增加,且高水平CTRP1与代谢综合征疾病的发生有关[12,20]。本实验结果也证实,在男性CHD患者体内循环的CTRP1水平较健康男性显著升高。
众所周知,肥胖、高血压、高血脂和糖尿病等均为动脉粥样硬化的风险因素,同时也是CHD发生的重要危险因子。在肥胖或营养过剩条件下,CTRP1能够降低脂肪堆积,调节血脂水平,缓解肥胖[21,22];CTRP1也可能通过诱导醛固酮的分泌进而激活肾素-血管紧张素-醛固酮信号系统,引发高血压的发生[19]。本研究结果显示,与健康男性相比,CHD患者体内的血脂水平(如TC和LDL-C)和FBG含量明显升高,收缩压也明显增加;且血浆CTRP1水平与血压、TC、LDL-C、FBG含量呈正相关。这表明,CTRP与CHD患者的血脂、血糖和血压均具有一定的相关性。此外,有研究认为,CTRP1能够降低动物体内血糖含量[22]。但本研究数据显示,CTRP1与血糖FBG含量正相关,这可能是由于血糖水平的升高能够诱导CTRP1表达的升高,以此来发挥和实现对血糖水平的控制作用。
尽管CTRP1水平与代谢综合征、心血管疾病的发生密切相关,但CTRP1与CHD之间的关系研究鲜有报道。为研究CTRP1水平与冠心病发生风险的关系,本研究对CTRP1水平及其各临床参数与CHD发生风险之间进行回归分析,结果发现,TC、LDL-C、血压、FBG均为CHD发生的风险因子,与以往的研究较为一致[23,24]。有所不同的是,本研究还发现,高水平CTRP1同样是CHD发生的风险因子。
综上所述,本研究认为,新型的脂肪细胞因子CTRP1的含量升高有望成为男性冠心病患病的新型评估指标,测量血液循环中的CTRP1浓度对于评估男性心血管疾病的风险具有一定的价值,这将为临床寻求心血管疾病诊断的生物指标提供理论依据。
参考文献:
[1]Bastien M, Poirier P, Lemieux I,etal. Overview of epidemiology and contribution of obesity to cardiovascular disease[J]. Prog Cardiovasc Dis, 2014, 56(4): 369-381.
[2]Despres JP, Lemieux I. Abdominal obesity and metabolic syndrome[J]. Nature, 2006, 444(7121): 881-887.
[3]Long Y, Gracely EJ, Newschaffer CJ,etal. Analysis of the prevalence of cardiovascular disease and associated risk factors for European-American and African-American populations in the state of Pennsylvania 2005-2009[J]. Am J Cardiol, 2013, 111(1): 68-72.
[4]Kastorini CM, Georgousopoulou E, Vemmos KN,etal. Comparative analysis of cardiovascular disease risk factors influencing nonfatal acute coronary syndrome and ischemic stroke[J]. Am J Cardiol, 2013, 112(3): 349-354.
[5]Liu L, Miura K, Fujiyoshi A,etal. Impact of metabolic syndrome on the risk of cardiovascular disease mortality in the United States and in Japan[J].Am J Cardiol,2014,113(1):84-89.
[6]殷佳,宋彦奇,潘晔,等.基于临床文献探讨冠心病气阴两虚证动物模型的评价标准[J].中草药,2017,48(4):798-802.
[7]Ades PA,Savage PD.Obesity in coronary heart disease:An unaddressed behavioral risk factor[J].Prev Med,2017,2(1):1-15.
[8]Ouchi N, Parker JL, Lugus JJ,etal. Adipokines in inflammation and metabolic disease[J]. Nat Rev Immunol, 2011, 11(2): 85-97.
[9]Wong GW, Wang J, Hug C,etal. A family of Acrp30/adiponectin structural and functional paralogs[J]. Proc Natl Acad Sci USA, 2004, 101(28): 10302-10307.
[10]Wong GW, Krawczyk SA, Kitidis-Mitrokostas C,etal. Molecular, biochemical and functional characterizations of C1q/TNF family members: adipose-tissue-selective expression patterns, regulation by PPAR-gamma agonist, cysteine-mediated oligomerizations, combinatorial associations and metabolic functions[J]. Biochem J, 2008, 416(2): 161-177.
[11]Kim KY, Kim HY, Kim JH,etal. Tumor necrosis factor-alpha and interleukin-1beta increases CTRP1 expression in adipose tissue[J]. FEBS Lett, 2006, 580(16): 3953-3960.
[12]Chalupova L, Zakovska A, Adamcova K. Development of a novel enzyme-linked immunosorbent assay (ELISA) for measurement of serum CTRP1: a pilot study: measurement of serum CTRP1 in healthy donors and patients with metabolic syndrome[J]. Clin Biochem, 2013, 46(1-2): 73-78.
[13]王小凤.冠心病患者危险因素性别差异的分析研究[D].石家庄:河北医科大学,2011:1-30.
[14]樊永旺,马骏,邱健,等.不同肥胖指标对冠心病、高血压及其合并糖尿病患者患病风险的评估作用[J].山东医药,2017,57(1):11-14.
[15]钱荣立.关于糖尿病的新诊断标准与分型[J].中国糖尿病杂志,2000,8(1):5-6.
[16]潘玉静,张路霞.估算肾小球滤过率的评价方法[J].中华内科杂志,2016,55(3):237-240.
[17]王佳丽,朱慧娟,曾勇.脂肪因子与冠状动脉粥样硬化关系的研究进展[J].中国心血管杂志,2013,18(3):227-229.
[18]Schaffler A, Buechler C. CTRP family: linking immunity to metabolism[J].Trends Endocrinol Metab,2012,23(4):194-204.
[19]梁伟,田书雅,任妍,等.老年男性代谢综合征患者血清CTRP1水平及其与血清脂联素水平的关系[J].上海交通大学学报(医学版),2017,37(2):218-220.
[20]Jeon JH, Kim KY, Kim JH,etal. A novel adipokine CTRP1 stimulates aldosterone production[J]. FASEB J, 2008, 22(5): 1502-1511.
[21]Peterson JM, Aja S, Wei Z,etal. CTRP1 protein enhances fatty acid oxidation via AMP-activated protein kinase (AMPK) activation and acetyl-CoA carboxylase (ACC) inhibition[J]. J Biol Chem, 2012, 287(2): 1576-1587.
[22]辛雅萍,付艳芹,张东铭,等.补体C1q肿瘤坏死因子相关蛋白1与脂联素水平的关系[J].中国老年学,2014,34(14):3833-3835.
[23]吴自强,叶龙英,于辉月.炎症因子、脂质水平与2型糖尿病并发冠心病发病风险分析[J].实验与检验医学,2016,34(2):163-165.
[24]李霞,李艳,王昌富,等.冠心病患者空腹血糖、血脂、尿酸和白细胞检测的结果分析[J].中国误诊学杂志,2011,11(20):4791-4793.
