hsa-miR-150-5p抑制序列慢病毒载体的构建、转染和表达
2018-04-10叶文广王景杰张明鑫周苏娜
叶文广,王景杰,张明鑫,周苏娜
(1第四军医大学唐都医院消化内科,西安 710038;2第四军医大学唐都医院放疗科;*通讯作者,E-mail:annyzhou0913@163.com)
炎症性肠病(inflammatory bowel disease,IBD)的发病率正在世界范围内明显上升,IBD已成为一种全球性疾病,主要包括克罗恩病(Crohn’s disease,CD)和溃疡性结肠炎(ulcerative colitis,UC)[1]。目前,IBD发病率在我国乃至亚洲地区呈增高趋势,主要治疗方法是抗炎和调节免疫反应。hsa-miR-150(内源性非编码小分子RNA)已被证明与免疫系统的发生相关,且它在IBD患者的组织及全血标本中的表达量均显著上调[2,3]。HT29细胞能表达正常人肠细胞的形态和某些生理特性,常被作为研究小肠药物、营养物质吸收和代谢的体外模型。因此,本研究旨在通过构建抑制hsa-miR-150-5p表达的慢病毒载体并转染HT29细胞,筛选稳定转染的细胞株,为将来研究hsa-miR-150-5p对IBD肠上皮免疫屏障功能的调控研究奠定基础。
1 材料与方法
1.1 细胞系
人结肠腺癌细胞株HT29、人胚肾上皮细胞株293T购于中国科学院上海细胞库。
1.2 主要试剂和载体
DMEM、胎牛血清、胰酶Trypsin-EDTA Solution和链霉素(10 000 μg/ml)/青霉素(10 000 U/ml)购自美国GIBCO公司;大肠杆菌菌株DH5α为唐都医院中心实验室保存;质粒抽提试剂盒购自日本Takara公司;BamHⅠ、EcoRⅠ内切酶、T4 DNA连接酶、Marker购自加拿大Fermentas公司;Lipofectamine 2000、Trizol购自美国Invitrogen公司;LB培养基购自美国ATCC公司。Eni.S(Enhanced Infection Solution),包装质粒pHelper1.0和pHelper 2.0质粒,及含有绿色荧光蛋白(GFP)和嘌呤霉素Puro(puromycin)抗性的GV280载体质粒,均购自上海吉凯基因有限公司。
1.3 细胞分组
根据转染情况,分为HT29组(空白HT29细胞)、HT29-150-NC组(转染阴性LV-NC病毒)、HT29-150-5p-down组(转染过表达LV-hsa-miR-150-5p-down病毒)。
1.4 细胞培养
293T细胞及HT29细胞均以含100 IU/ml青霉素和100 μg/ml链霉素的DMEM加入10% FBS培养,置入5% CO2、37 ℃恒温细胞培养箱内培养。
1.5 hsa-miR-150-5p-down序列设计和重组慢病毒载体的构建及鉴定
参照miRBase数据库人源-miR-150-5p基因序列(MIMAT000451)设计反义互补序列为5′-CACTGGTACAAGGGTTGGGAGA-3′,以此为模板进行PCR扩增。进行PCR鉴定和DNA测序。阳性克隆序列进行3次测序,测序结果通过Chromas软件分析。
1.6 慢病毒的包装及滴度检测
转染前24 h,用胰蛋白酶消化对数生长期的293T细胞,以含10%胎牛血清的培养基调整细胞密度约5×106细胞/15 ml,新接种于10 cm细胞培养皿,待细胞密度达70%-80%时用于转染;转染前2 h更换为无血清培养基;将构建成功的重组质粒(20 μg)与pHelper1.0(15 μg)、pHelper2.0(10 μg)、Lipofectamine2000(100 μl)共转染293T细胞。转染48-72 h采用荧光法测定病毒滴度。
1.7 慢病毒转染HT29细胞
将对数生长期的HT29细胞,按1×105个/孔接种至12孔板中,于37 ℃、5% CO2培养24 h,细胞长至密度约为20%时侵染病毒。将侵染HT29细胞的慢病毒原液用含10% FBS的DMEM培养液按梯度1 ∶10稀释3个梯度(1 ∶10,1 ∶100,1 ∶1 000)。吸去12孔板中的原培养液,加入上述稀释的病毒液,感染时加入Eni.S+polybrene以提高转染率,同时设立空白对照组。转染12 h更换成正常培养基,然后继续培养72 h,倒置荧光显微镜观察绿色荧光表达并拍照。对成功感染病毒的细胞根据药物筛选实验以嘌呤霉素筛选稳定细胞株。
1.8 实时qPCR检测HT29细胞miR-150-5p的表达水平
严格按照产品说明书进行实时qPCR检测转染后的HT29组、HT29-N组和HT29-150-5pdown组细胞中miR-150-5p的表达水平。细胞中加入1 ml Trizol,按说明提取细胞总RNA并测定其纯度和浓度。按照PrimeScript RT试剂盒的操作说明,以RNA为模板通过逆转录合成cDNA。在SYBR酶的作用下进行PCR反应。实时qPCR循环95 ℃变性3 min,95 ℃ 10 s、62 ℃ 20 s、72 ℃ 30 s,循环40次。
1.9 统计学分析
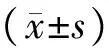
2 结果
2.1 重组LV-hsa-miR-150-down质粒构建情况
DNA测序结果证实重组质粒LV-hsa-miR-150-5p-down中的目的片段序列与预期的序列一致(见图1,2),说明目的片段已成功克隆入慢病毒表达载体中。
2.2 重组慢病毒的的测定
将构建成功的质粒载体与pHelper1.0载体、pHelper2.0载体、Lipofectamine 2000共转染293T细胞,转染72 h通过倒置荧光显微镜观察293T细胞可以看见大量绿色荧光蛋白的表达。用病毒原液按1 ∶10稀释2个梯度(1 ∶10,1 ∶100)感染293T细胞,转染72 h观察GFP蛋白的表达,实验组病毒滴度为5×108TU/ml,阴性对照组病毒滴度为8×108TU/ml(见图3)。

斜体字母为目的片段序列图1 LV-hsa-miR-150-down测序结果Figure 1 The sequencing of LV-hsa-miR-150-down
2.3 HT29细胞转染结果
HT29-150组感染LV-hsa-miR-150-5p-down病毒,HT29-NC组感染阴性对照慢病毒LV-NC,感染72 h后进行荧光拍照。各组细胞荧光拍照结果可见病毒感染成功(见图4)。
2.4 PCR验证HT29细胞中转染LV-hsa-miR-150-5p-down病毒效率的结果
以U6为内参,HT29组为基准,校正计算各组2-ΔΔCt值。HT29组为1.05±0.05,HT29-NC组为1.04±0.03,HT29-150-5p-down组为0.45±0.04。上述结果显示HT29-150-5p-down组细胞与HT29组、HT29-NC组细胞相比,miR-150-5p的含量明显降低(P<0.05,见图5)。
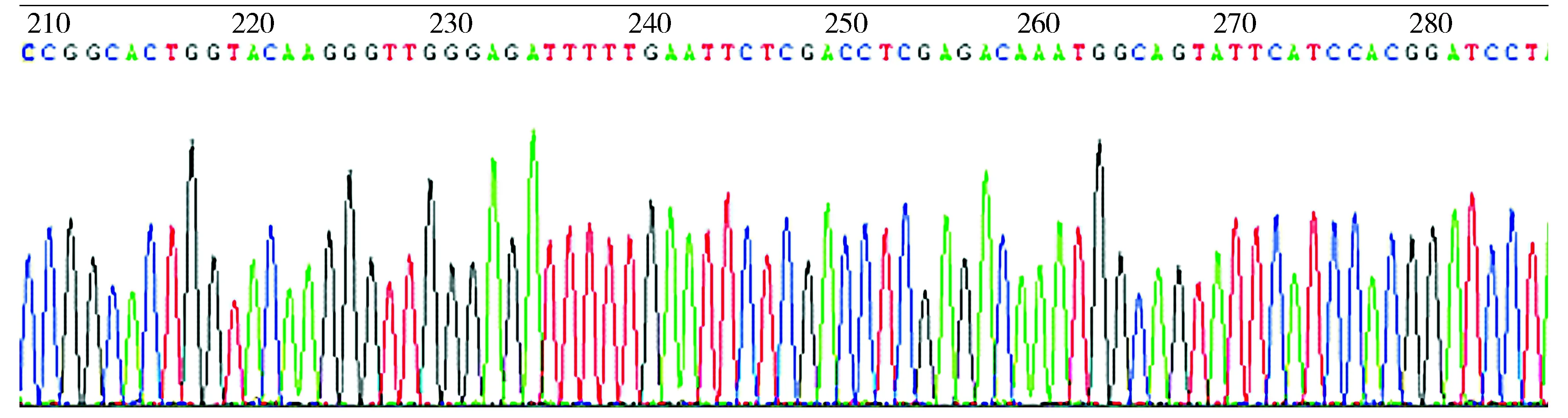
重组慢病毒表达载体中已插入目的序列图2 LV-hsa-miR-150-down测序波峰图Figure 2 DNA sequencing of LV-hsa-miR-150-down
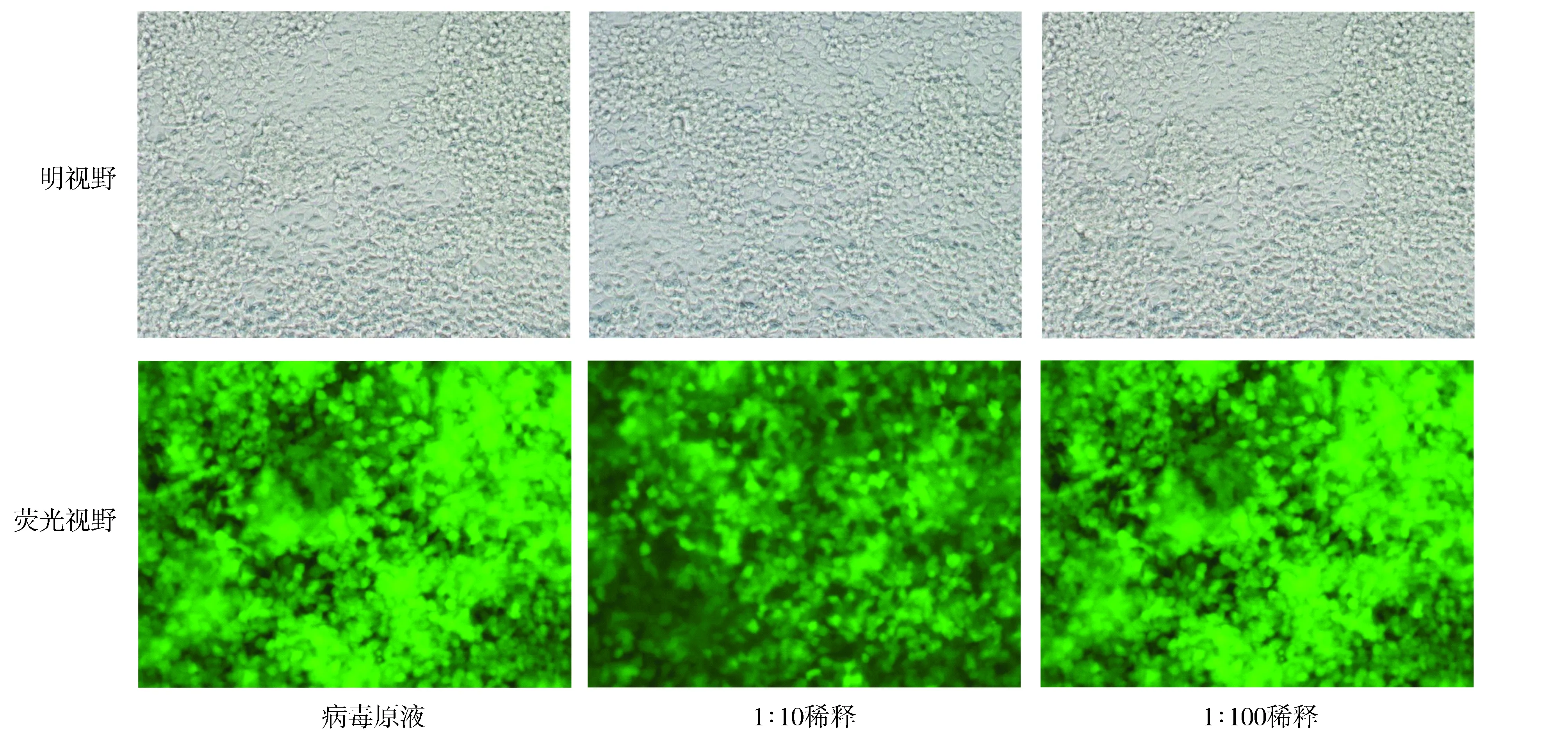
图3 转染后荧光蛋白表达情况 (×100)Figure 3 Expression of green fluorescent protein after transfection (×100)

图4 转染后荧光蛋白表达情况 (×100)Figure 4 Expression of green fluorescent protein after transfection (×100)

与其他两组相比,*P<0.05图5 实时qPCR检测miR-150-5p表达结果Figure 5 The qRT-PCR expression of miR-150-5p
3 讨论
IBD的病因及发病机制目前尚未完全清楚,通常认为由环境、遗传、微生物感染及免疫等多种因素共同作用导致包括T细胞、B细胞、NK细胞、树突状细胞、巨噬细胞、粒细胞、肥大细胞的免疫细胞活化引发的肠上皮免疫屏障异常[4]。miRNA在调控IBD肠上皮免疫屏障功能方面的作用是当前新的研究方向[5,6]。研究显示活动期及非活动期的IBD患者,甚至不同类型的IBD都存在着微小RNA(MicroRNA,miRNA)表达差异[7-11]。目前,关于miRNA在IBD中的研究多着重于其对肠道上皮细胞的增殖、凋亡等的影响。研究证实miRNA作为调节器可通过调控细胞因子表达参与免疫反应来应对不同病原或刺激,根据其在炎症因子表达调节中的作用,miRNA可分为前炎症miRNA和负反馈调节因子两种类型[12,13]。miRNA通过与靶mRNA特异结合在转录后水平上对基因表达进行调控,研究发现部分miRNA与免疫细胞的存活或迁移及炎症因子的表达相关[12-14]。因此,寻找通过调控细胞因子表达参与调节肠上皮免疫屏障功能的miRNAs在IBD的研究中意义重大。miR-150已被证明与免疫系统的发生相关[14],但目前miR-150在IBD中的致病机制研究尚局限于其对结肠上皮细胞凋亡的影响[2],而miR-150作为一个免疫相关的miRNA,是否在IBD中参与调控肠上皮免疫屏障功能及可能的分子调控机制尚缺乏报道。在后续的实验中需要构建不同miR-150表达水平的肠上皮细胞模型,来进一步研究其在IBD中肠上皮免疫屏障调控相关的功能及机制。
常用的慢病毒载体是在人类免疫缺陷病毒1型基础上修饰改造而得到的一种多用途、安全的转基因载体[15]。为进一步阐明mir-150在调控IBD肠上皮免疫屏障功能方面的可能分子机制,本研究选择应用重组慢病毒载体技术构建了能够稳定而持久低表达mir-150的重组质粒,经PCR扩增测序,显示其基因序列与miR-150反义互补序列匹配,说明miR-150-down序列正确地插入到了载体中;重组低表达慢病毒转染HT29细胞,通过荧光显微镜观察荧光蛋白的表达情况,显示重组的低表达慢病毒质粒能够高效地感染目的细胞;实时qPCR检测结果显示转染后的HT29细胞中miR-150的表达显著降低。这为进一步研究miR-150调控IBD肠上皮免疫屏障的功能及作用机制奠定了基础。
参考文献:
[1]刘凡.炎症性肠病药物治疗现状与进展[J].沈阳医学院学报,2006,8(4):241-242.
[2]Bian Z, Li L, Cui J,etal. Role of miR-150-targeting c-Myb in colonic epithelial disruption during dextran sulphate sodium-induced murine experimental colitis and human ulcerative colitis[J]. J Pathol, 2011, 225(4):544-553.
[3]Fourie NH, Peace RM, Abey SK,etal. Elevated circulating miR-150 and miR-342-3p in patients with irritable bowel syndrome[J]. Exp Mol Pathol, 2014, 96(3):422-425.
[4]Xavier RJ, Podolsky DK. Unravelling the pathogenesis of inflammatory bowel disease[J]. Nature, 2007, 448(7152):427-434.
[5]Xu Xiao-Min, Zhang Hong-Jie. miRNAs as new molecular insights into inflammatory bowel disease: Crucial regulators in autoimmunity and inflammation[J]. World J Gastroenterol, 2016, 22(7): 2206-2218.
[6]Park EJ, Shimaoka M, Kiyono H. MicroRNA-mediated dynamic control of mucosal immunity[J]. Int Immunol, 2017, 29(4):SI157-163.
[7]Wu F, Zikusoka M, Trindade A,etal. MicroRNAs are differentially expressed in ulcerative colitis and alter expression of macrophage inflammatory peptide-2 alpha[J]. Gastroenterology, 2008, 135(5): 1624-1635.e24.
[8]Wu F, Zhang S, Dassopoulos T,etal. Identification of microRNAs associated with ileal and colonic Crohn's disease[J]. Inflamm Bowel Dis, 2010, 16(10):1729-1738.
[9]Fasseu M, Tr?ton X, Guichard C,etal. Identification of restricted subsets of mature microRNA abnormally expressed in inactive colonic mucosa of patients with inflammatory bowel disease[J]. PLoS One, 2010, 5(10) e13160.
[10]Orazio P, Teresa MC, Fabrizio B,etal. Functional Implications of MicroRNAs in Crohn’s Disease Revealed by Integrating MicroRNA and Messenger RNA Expression Profiling[J]. Int J Mol Sci, 2017, 18(7): 1580.
[11]Beres NJ, Kiss Z, Sztupinszki Z,etal. Altered mucosal expression of microRNAs in pediatric patients with inflammatory bowel disease[J]. Digest Liver Dis, 2017, 49(4):378-387.
[12]Tili E, Michaille JJ, Cimino A,etal. Modulation of miR-155 and miR-125b levels following lipopolysaccharide/TNF-alpha stimulation and their possible roles in regulating the response to endotoxin shock[J]. J Immunol, 2007, 179(8):5082-5089.
[13]Ceppi M, Pereira PM, Dunand-Sauthier I,etal. MicroRNA-155 modulates the interleukin-1 signaling pathway in activated human monocyte-derived dendritic cells[J]. Proc Natl Acad Sci U S A, 2009, 106(8):2735-2740.
[14]Zhou B, Wang S, Mayr C,etal. miR-150, a microRNA expressed in mature B and T cells, blocks early B cell development when expressed prematurely[J]. Proc Natl Acad Sci U S A, 2007, 104(17): 7080-7085.
[15]Zufferey R, Dull T, Mandel RJ,etal. Self-inactivating lentivirus vector for safe and efficient in vivo gene delivery[J]. J Viral, 1998, 72(12):9873-9880.
