沉默SLC34A2基因对非小细胞肺癌CD166+干细胞生长的影响
2018-04-10郝登荣席俊峰张志斌霍龙伟任贺庄席云峰
郝登荣,席俊峰,张志斌,霍龙伟,任贺庄,席云峰
(陕西省榆林市第一医院胸心外科,榆林 719000;*通讯作者,E-mail:ylylwzd@163.com)
肺癌在全世界的发病率逐年上升,严重威胁人类的生活和生存,给患者和患者家属带来很大的烦恼。肺癌可分为小细胞肺癌(small cell lung cancer,SCLC)和非小细胞肺癌(non-small cell lung cancer,NSCLC),在治疗的过程中发现,SCLC的化疗效果较好,但NSCLC对化疗并不敏感,治疗效果不好。因此,越来越多的学者将研究目光锁定到了NSCLC,本课题组已经从NSCLC中成功筛选出CD166+细胞[1],并验证了其具有肿瘤干细胞的生物学特性。有研究显示SLC34A2基因可能与肺癌细胞的生长有着密切的关系[2,3]。为研究SLC34A2基因是否对CD166+肿瘤干细胞的生长有调控作用,本实验首先检测了CD166+和CD166-细胞中的SLC34A2含量,然后沉默了CD166+细胞中SLC34A2基因,检测沉默前后细胞的生长和增殖能力的变化,从而证实SLC34A2基因在肺癌细胞生长过程中所起的作用。
1 材料与方法
1.1 试验细胞
在2015-09~2016-03期间,收集陕西省榆林市第一医院胸心外科收治的两位非小细胞癌患者的LCSCs,命名为LT1和LT7,并用流式细胞筛选出CD166+细胞和CD166-细胞,筛选完的所有细胞均由本实验收集和保存,详细方法见非小细胞肺癌CD166+干细胞的分离和鉴定[1]。临床样本中成功筛选出具有肿瘤干细胞特征的非小细胞肺癌CD166+细胞和CD166-细胞。
1.2 主要试剂和材料
Balb/c小鼠购于第四军医大学,胰酶购自Sigma公司,TRIzol和LipofectamineTM2000购自Invitrogen公司,培养基购买于美国Gibco公司;胎牛血清购买于美国Hyclone公司;胰蛋白酶购买于美国Amersham公司;SLC34A2单克隆抗体购自Abcam。
1.3 测定CD166阳性细胞中SLC34A2的表达
针对登录号为NG-021185.1的SLC34A2基因设计引物:上游引物为GAGAAACATCGCCAAATGC,下游引物为GCAACCACAGAGGACCAG。使用Trizol提取两组细胞总的RNA,用逆转录酶合成为cDNA。然后用SYBR进行real-time PCR,观察结果。然后利用Western-blot检测其蛋白的表达情况,收集两组细胞提取膜蛋白,蛋白样品采用Bradford法测定总蛋白含量。根据蛋白样品的浓度,计算出每孔中蛋白质样品的体积。SDS-PAGE电泳,转膜,5%脱脂奶粉的TBST封闭1 h,加入小鼠抗人SLC34A2抗体(1 ∶1 000稀释),4 ℃孵育过夜,TBST漂洗10 min,共3次,用HRP标记的羊抗鼠二抗(1 ∶10 000稀释),室温孵育2 h,用ECL发光试剂盒曝光,观察结果。
1.4 筛选沉默SLC34A2基因的细胞
上海吉玛生物有限公司化学合成3条针对SLC34A2序列的siRNA,本实验从中筛选出一条有效的siRNA序列,正义链:5′-CTCCCTGGATATTCTTAGTT-3′,Free-Rnase将浓度稀释为20 μmol/L,随后将生长对数期的两组细胞用胰蛋白酶消化,把细胞浓度调整为1.5×105个/孔,接种在6孔板,参照LipofectamineTM2000说明书进行瞬时转染。筛选出转染成功的细胞株。试验共分三组,一组为未转染的细胞组(LCSCs),一组为转染空载体的细胞组(si-NC-LCSCs),一组为实验组(si-SLC34A2-LCSCs)。
1.5 细胞成球实验
将三组细胞在相同的条件下进行培养,等待细胞生长到对数期取出细胞,准备实验,用胰酶消化,将细胞悬液转入离心管中,低速(1 000 r/min)离心3 min后去上清。然后向离心管内加入5 ml的PBS,轻轻吹打细胞使之重悬,再次离心;重悬离心操作需要重复3次,然后用培养基将细胞浓度调整为1 000个/ml,然后细胞接种在6孔板上,进行肿瘤成球培养。需要3 d更换培养液1次,接种后14 d观察实验结果。
1.6 集落形成能力检测
将三组细胞的浓度调整为250个/ml,并将细胞接种在6孔板上,每组细胞需要做两个重复孔,加入2 ml Defined K-SFM培养基,3 d更换培养液1次,两周后用2 %的结晶紫染色,冲洗后计数每孔中细胞集落的数目。
1.7 裸鼠体内移植瘤试验
将8-9周的Balb/c小鼠平均分为3组(每组6只),取沉默SLC34A2基因的CD166+细胞的悬液(1×104/ml)0.5 ml,腹腔注射到小鼠体内,在相同的条件进行饲养,以便获得真实可靠的数据,注射后持续对小鼠腹腔内的肿瘤情况进行追踪,从接种第10天开始测量裸鼠腹腔内肿瘤的生长情况,直到第35天处死小鼠,并对肿瘤的体积进行记录和比较。
1.8 统计学分析
2 结果
2.1 real-time PCR和Western-blot的检测结果
检测临床病例分离出的CD166+细胞和CD166-细胞的SLC34A2基因表达量,real-time PCR检测结果表明:CD166+细胞的SLC34A2的含量显著高于CD166-细胞(P<0.01,见图1);Western blot结果显示CD166+细胞的SLC34A2的表达高于CD166-(P<0.05,见图2)。

与CD166+比较,**P<0.01图1 real-time PCR检测SLC34A2在CD166+和CD166-的表达Figure 1 Relative expression of SLC34A2 in CD166+and CD166-cells by real-time PCR
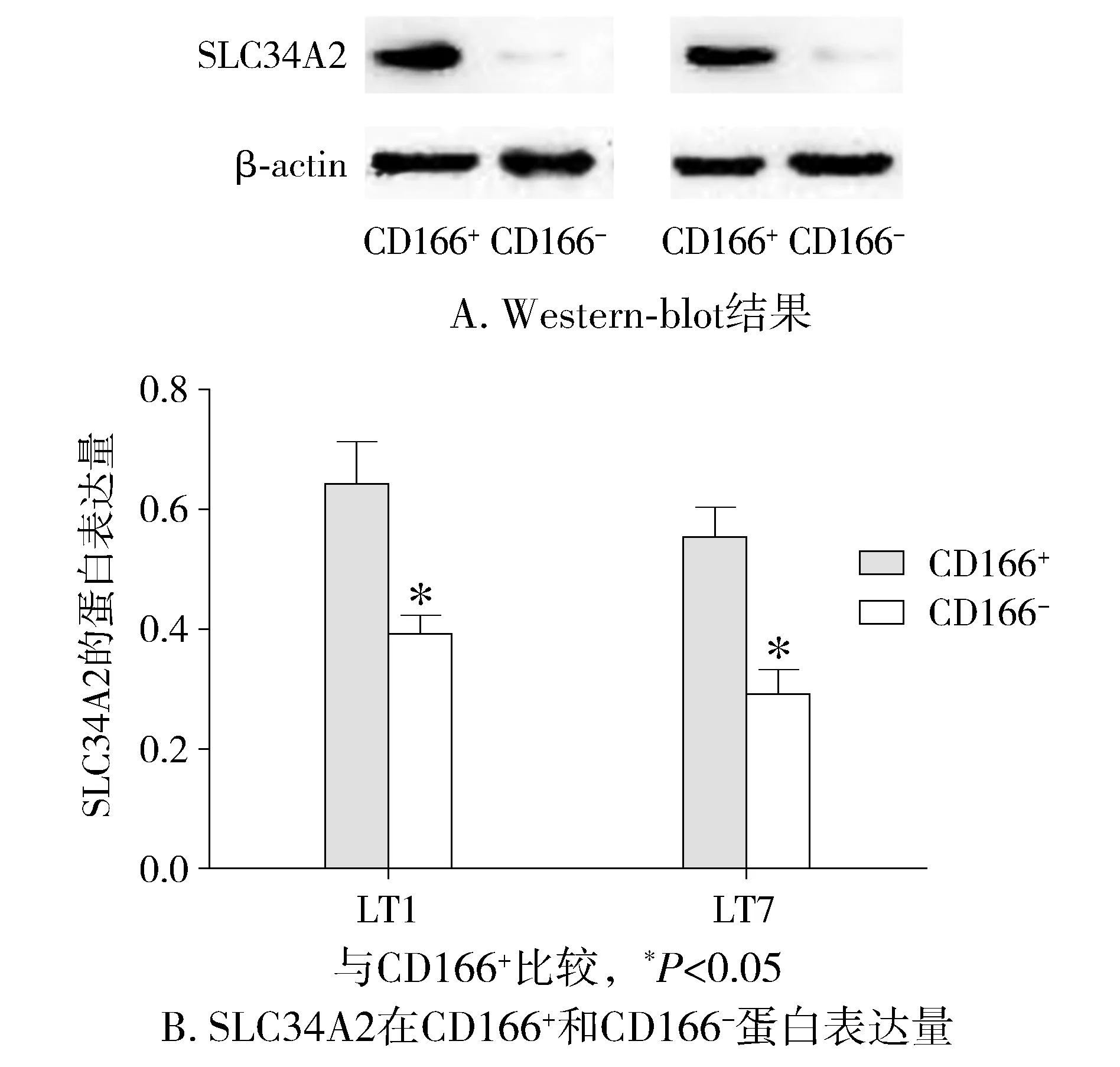
图2 SLC34A2在CD166+和CD166-蛋白水平的表达Figure 2 Protein expression of SLC34A2 in CD166+and CD166-cells
2.2 沉默SLC34A2基因的变化
沉默LT1和LT7两组CD166+细胞中SLC34A2基因后,检测每一组细胞中SLC34A2基因的表达量,结果表明与空白对照(未进行转染的LCSCs)和阴性对照组(转染空载体的LCSCs)相比,CD166+细胞中SLC34A2表达显著降低(P<0.05,见图3)。另外,细胞成球实验结果显示,CD166+细胞球形成的个数19.4±1.8,转染空载体的CD166+细胞球形成的个数16.4±2.1,沉默SLC34A2基因的CD166+细胞成球形成的个数为4.2±1.5,结果显示沉默SLC34A2基因的CD166+细胞成球显著能力低于其他两组细胞(P<0.05,见图4)。
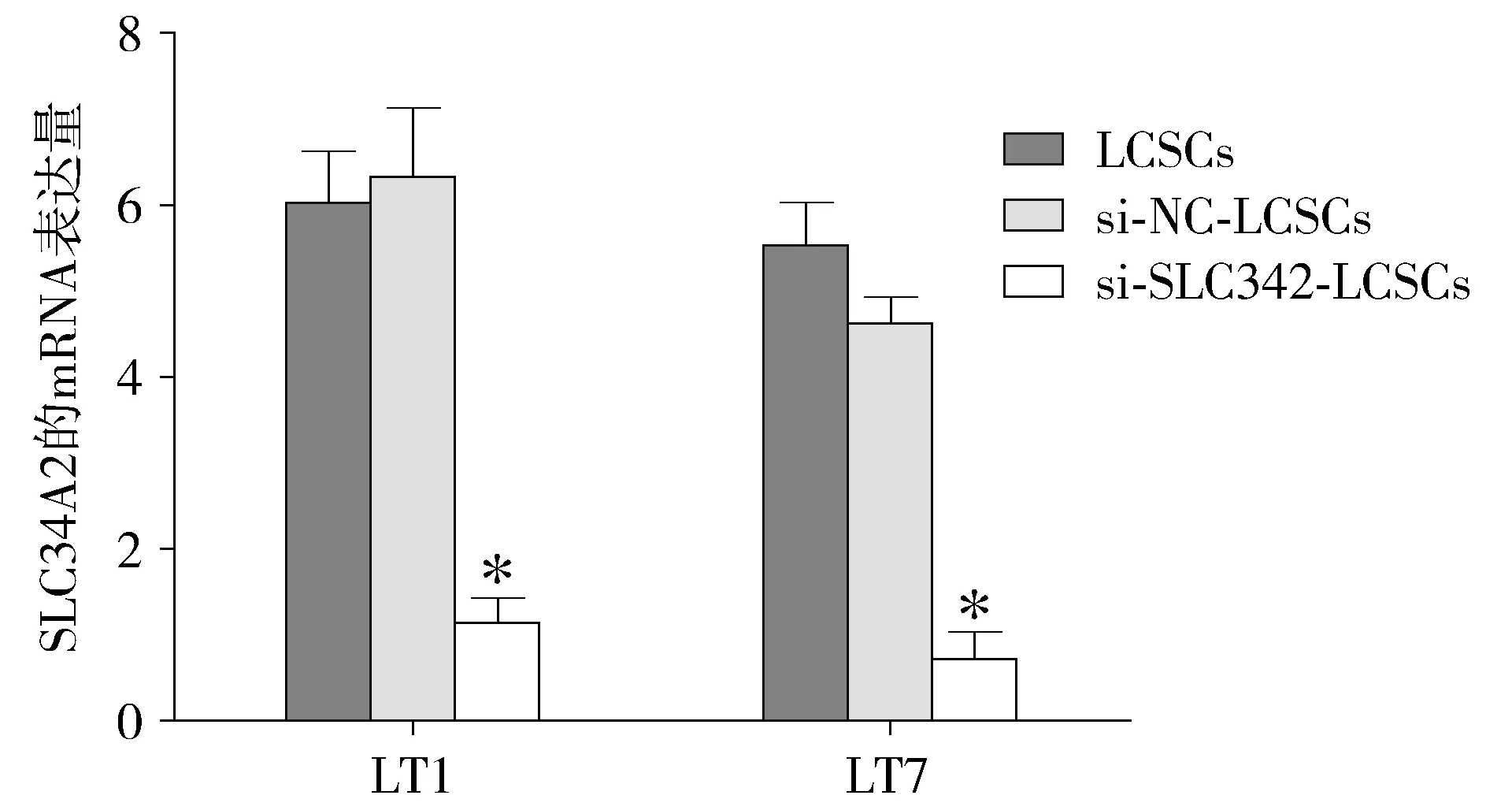
与其他两组比较,*P<0.05图3 real-time PCR检测沉默SLC34A2的变化 Figure 3 The change of SLC34A2 in CD166+ cells after transfection by real-time PCR
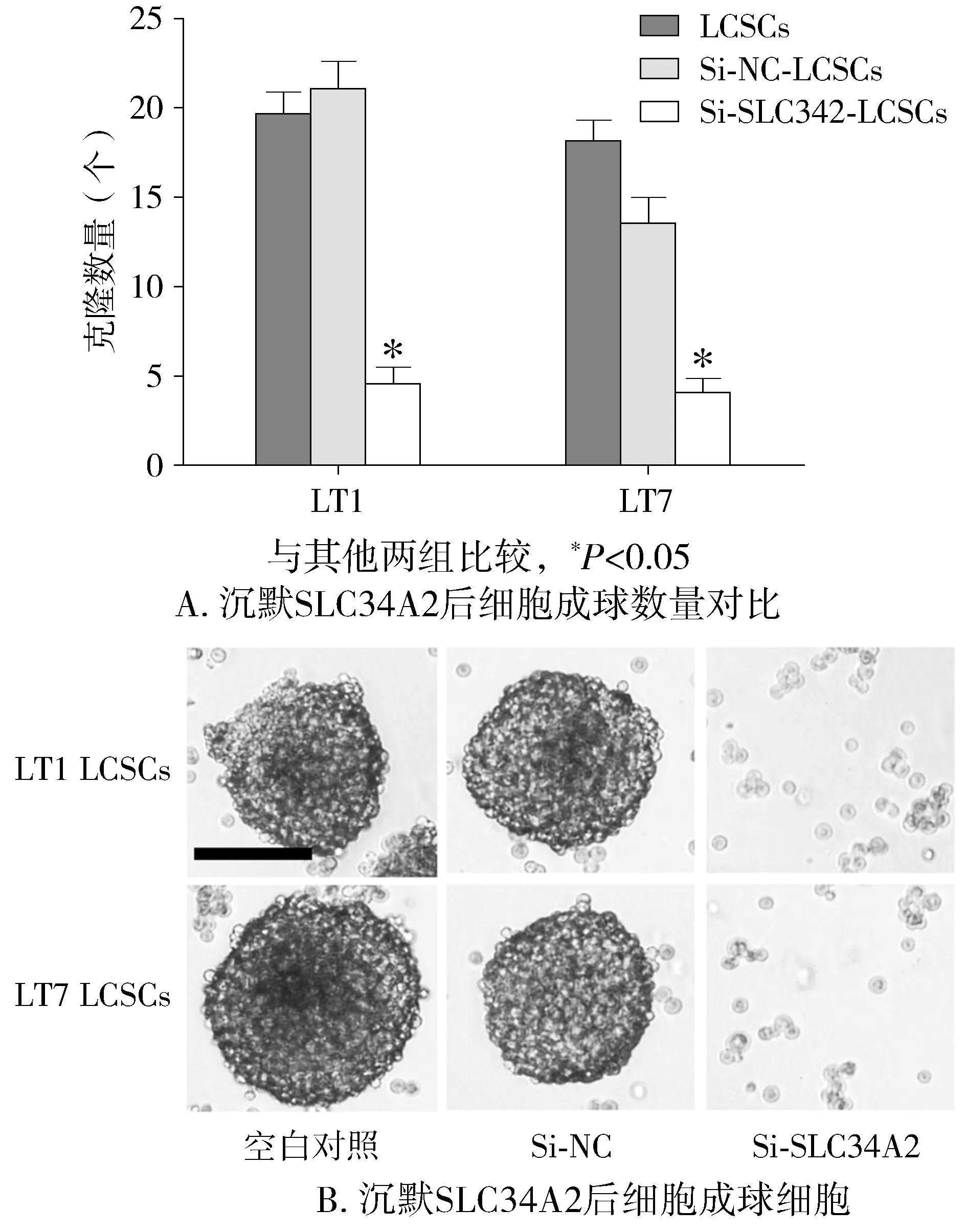
图4 沉默SLC34A2后肿瘤细胞成球能力的变化Figure 4 The proliferation ability of tumor cells after silencing SLC34A2
2.3 沉默SLC34A2对集落形成能力的影响
集落形成实验表明,CD166+细胞形成的集落数为104±9.2,转染空载体的CD166+细胞形成的集落数为113±10.4,沉默SLC34A2基因的CD166+细胞形成的集落数为40±9.8,结果显示空白对照(未进行转染的LCSCs)的细胞形成的集落直径较大,细胞排列紧密,而沉默SLC34A2基因的CD166+细胞集落形成能力显著低于空白对照(未进行转染的LCSCs)和阴性对照组(转染空载体的LCSCs)(P<0.05,见图5)。
2.4 沉默SLC34A2对体内移植瘤的影响
用三组细胞悬液接种小鼠,分别测量各个时间段的肿瘤大小。接种的前20 d,三组细胞形成的肿瘤较小,且肿瘤体积较为接近,在接种后25 d,未转染的细胞组和转染空载体的细胞组肿瘤的体积持续增加,而实验组(沉默SLC34A2基因)肿瘤的体积不再增加。接种后35 d,肿瘤大小出现明显差异,未转染细胞与转染空载体的CD166+细胞悬液接种后,产生的肿瘤没有明显差异,而接种沉默SLC34A2基因的CD166+细胞悬液后,小鼠体内产生的肿瘤体积显著小于其他两组小鼠肿瘤的体积(P<0.01,见图6)。

图5 集落形成实验结果Figure 5 The experiment results of colony formation

图6 体外肿瘤实验结果Figure 6 The changes of tumor size in in vitro expriments after silencing SLC34A2
3 讨论
SLC34A2广泛存在于各个组织器官中,但其在各个组织的表达略有不同,有学者[4]在1999年检测得出存在于小肠中的SLC34A2基因的cDNA长度为4 135 bp,编码689个氨基酸,其中包含11个跨膜区域;SLC34A2基因在肺和胎肺中高表达,而土耳其的学者则发现,存在于肺组织中的SLC34A2基因共有13个外显子,其中第一个外显子编码了一个大小为690 aa的蛋白质以及一个2 280 nt的mRNA[5-7]。日本的研究者在16个PAM临床样本中检测到了SLC34A2基因发生了突变,这更加验证了SLC34A2基因在疾病的发生和发展中的重要性。有数据显示[8,9],在甲状腺癌和正常人甲状腺的差异表达基因中发现了SLC34A2基因,且在乳头状甲状腺癌中该基因明显高表达。
此外,在卵巢癌血清中也有研究人员发现了SLC34A2基因的存在[10,11],而且SLC34A2参与钙、磷的协同转运。最初在恶性胶质瘤及非小细胞肺癌(NSCLC)中,ROS-SLC34A2融合基因发现其具有促进肿瘤的生长的作用[12-14],有学者认为这也许与CICs的增殖、侵袭能力有一定的关系[15,16],而且进行深入研究,沉默SLC34A2之后,发现NaPi-Ⅱ表达降低,也可抑制肺癌干细胞的增殖[17-19]。同时还有数据表明SLC34A2可能与肺癌的进展相关,可以在一定程度上抑制肺癌干细胞的增殖[20,21],故该次实验选取SLC34A2为研究对象,研究其对NSCLC的影响。
本课题组已经验证了CD166+肿瘤干细胞的生物学特性,及与NSCLC的发生发展密切相关,但其致病机制并不明确。结果表明CD166+细胞中的SLC34A2显著高于CD166-细胞;之后沉默SLC34A2基因后,通过细胞成球实验、细胞集落实验以及体外小鼠实验,这些实验都表明:沉默SLC34A2基因后,肿瘤细胞的生长和增殖能力显著下降,这些实验结果暗示着SLC34A2基因高表达可能促进肿瘤的生长。
综上所述,CD166及SLC34A2基因在NSCLC发生、发展过程中具有重要意义,检测CD166及SLC34A2基因有利于肿瘤的诊断,并可对患者的治疗提供新的依据,从而改善患者预后。本研究的结果希望能对NSCLC晚期患者的个体化治疗方案的选择有所帮助。SLC34A2在肺癌的发展过程中有着重要的地位,但是该基因在肺癌的发展过程中是通过哪条信号通路对其进行调控,以及在整个的过程中是否还有其他的基因进行调控还需要我们进行下一步的研究。
参考文献:
[1]张志斌,席云峰,霍龙伟,等.非小细胞肺癌CD166+干细胞的分离和鉴定[J].现代生物医学进展,2017,17(16):3035-3038.
[2]Siegel RL, Miller KD, Jemal A.Cancer statistics[J].CA Cancer J Clin, 2015, 65(1):5-29.
[3]Vismara MFM, Colao E, Fabiani F,etal.The sodium-phosphate co-transporter SLC34A2,and pulmonary alveolar microlithiasis: presentation of an inbred family and a novel truncating mutation in exon 3[J]. Respir Med Case Rep, 2015, 16(1):77-80.
[4]Boiko AD, Razorenova OV, van de Rijn M,etal. Human melanoma-initiating cells express neural crest nerve growth factor receptor CD271[J]. Nature, 2010, 466(7302):133-137.
[5]Riba J, Renz N, Niemöller C,etal. Molecular genetic characterization of individual cancer cells isolated via single-cell printing[J]. PLoS One, 2016, 11(9):89-93.
[6]Honing J, Pavlov KV, Mul VE,etal. CD44, SHH and SOX2 as novel biomarkers in esophageal cancer patients treated with neoadjuvant chemoradiotherapy[J]. Radiother Oncol, 2015, 117(1): 152-158.
[7]Chiou SH, Wang ML, Chou YT,etal. Coexpression of Oct4 and Nanog enhances malignancy in lung adenocarcinoma by inducing cancer stem cell-like properties and epithelial-mesenchymaltrans differentiation[J]. Cancer Res, 2010, 70(24):10433-10444.
[8]Desai TJ, Brownfield DG, Krasnow MA. Alveolar progenitor and stem cells in lung development, renewal and cancer[J]. Nature, 2014, 507(7491):190-194.
[9]Stokman L, Nossent E, Grunberg K,etal. A case of pulmonary alveolar microlithiasis associated with a homozygous 195 kb deletion encompassing the entire SLC34A2 gene[J]. Clin Case Rep, 2016, 4(4):412-415.
[10]Ye W, Chen C, Gao Y,etal. Overexpression of SLC34A2 is an independent prognostic indicator in bladder cancer and its depletion suppresses tumor growth via decreasing c-Myc expression and transcriptional activity[J]. Cell Death Dis, 2017, 8(2):2581.
[11]Wang Y, Yang W, Pu Q,etal. The effects and mechanisms of SLC34A2 in tumorigenesis and progression of human non-small cell lung cancer[J]. J Biomed Sci, 2015, 22(1):52.
[12]Hong SH, Minai-Tehrani A, Chang SH,etal. Knockdown of the sodium-dependent phosphate co-transporter 2b (NPT2b) suppresses lung tumorigenesis[J]. PLoS One, 2013, 8(10):77121.
[13]Le X, Freed JA, Vanderlaan PA,etal. Detection of crizotinib-sensitive lung adenocarcinomas with MET, ALK, and ROS1 genomic alterations via comprehensive genomic profiling[J]. Clin Lung Cancer, 2015, 16(5):105-109.
[14]Lin K, Rubinfeld B, Zhang C,etal. Preclinical development of an anti-NaPi2b(SLC34A2) antibody-dDrug conjugate as a therapeutic for non-small cell lung and ovarian cancers[J].Clin Cancer Res, 2015, 21(22):5139-5150.
[15]Treutlein B, Brownfield DG, Wu AR,etal. Reconstructing lineage hierarchies of the distal lung epithelium using single-cell RNA-seq[J]. Nature, 2014, 509(7500):371-375.
[16]Izumi H, Kurai J, Kodani M,etal. A novel SLC34A2 mutation in a patient with pulmonary alveolar microlithiasis[J]. Hum Genome Var, 2017, 4(1):S16047.
[17]Tachezy M, Zander H, Wolters-Eisfeld G,etal. Activated leukocyte cell adhesion molecule (CD166): an "inert" cancer stem cell marker for non-small cell lung cancer?[J]. Stem Cell, 2014, 32(6):1429-1436.
[18]Boyle TA, Masago K, Ellison KE,etal. ROS1 immunohistochemistry among major genotypes of non-small-cell lung cancer[J]. Clin Lung Cancer, 2015, 16(2):106-111.
[19]Ali SM, Hensing T, Schrock AB,etal. Comprehensive genomic profiling identifies a subset of crizotinib-responsive ALK-rearranged non-small cell lung cancer not detected by fluorescence in situ hybridization[J]. Oncologist, 2016, 21(6):762-770.
[20]Wan L, Pantel K, Kang Y. Tumor metastasis: moving new biological insights into the clinic[J]. Nature Med, 2013, 19(11):1450-1464.
[21]Lu C, Xu F, Gu J,etal. Clinical and biological significance of stem-like CD133+CXCR4+cellsin esophageal squamous cell carcinoma[J]. J Thorac Cardiovasc Surg, 2015, 150(2):386-395.
