BnA7HSP70分子伴侣结合蛋白超表达能够提高甘蓝型油菜耐旱性
2018-04-10万丽丽王转茸董发明洪登峰杨光圣武汉市农业科学院作物研究所湖北武汉430065华中农业大学作物遗传改良国家重点实验室湖北武汉430070
万丽丽 王转茸 辛 强 董发明 洪登峰 杨光圣 武汉市农业科学院作物研究所, 湖北武汉 430065; 华中农业大学作物遗传改良国家重点实验室, 湖北武汉 430070
分子伴侣能够帮助蛋白质正确地折叠或者迁移,从而起到稳定蛋白质的功能[1]。很多分子伴侣是热激蛋白(Heat shock proteins, HSPs)成员。HSP70是热激蛋白研究中最深入的家族, 它们普遍存在于高等植物的胞质、内质网、叶绿体和线粒体中[2]。HSP70参与新生肽的成熟与分拣, 分泌蛋白向细胞器或者胞外的转运, 并能恢复或清除细胞内已经变性的蛋白质, 从而保持细胞结构的稳定, 对生物体起到重要作用[3-4]。内质网是所有真核生物细胞中分泌蛋白合成中心, 内质网质控系统控制着分泌蛋白的加工、折叠和定位, 引导未折叠蛋白质降解, 最终保证只有正确折叠的蛋白在分泌途径中行使功能。内质网质控系统主要由分子伴侣来完成, 这类分子伴侣被称为结合蛋白(binding protein, BiP), 其主要功能是帮助分泌蛋白正确折叠组装成为具有活性的空间结构, 转运分泌蛋白到粗面内质网的网腔, 后引导其降解[5]。
前人研究发现, 当植株遭受干旱胁迫时, 水分大量而长久的缺失会破坏植物细胞稳态, 导致错误折叠和未折叠蛋白质积累在粗面内质网腔中, 被称为内质网胁迫(ER stress)[6-10]。应对内质网胁迫, 细胞会激活具有保护自身功能的信号级联反应, 即未折叠蛋白反应(unfolded protein response, UPR), 诱导分子伴侣的富集和参与分泌降解途径发生, 促进逆境胁迫下的内质网蛋白的折叠和加工能力。分子伴侣结合蛋白通过识别和定位异常折叠蛋白后直接参与内质网相关蛋白降解途径。UPR的发生分为两种途径, 一是IRE1-like介导的位于内质网上分子伴侣的上调表达; 二是ATF6-like介导的内质网相关蛋白质降解系统[9]。前人研究结果表明, 在逆境下植物的分子伴侣结合蛋白参与调控UPR途径[11-13]。当内质网受到胁迫后, 细胞中的细胞核和细胞质产生交流, 传递胁迫信号, 内质网上的特异基因启动相关途径及时处理异常蛋白质, 最终恢复细胞正常的分泌蛋白活性[3,14-16]。在烟草原生质体中, 超表达内质网胁迫应激相关分子伴侣结合蛋白能够协助内质网中蛋白质的折叠, 反之, 当这类分子伴侣的表达受到抑制, 会增强细胞对胁迫后氧化还原反应的敏感性; 在烟草中, 超表达分子伴侣结合蛋白, 能够增强对干旱胁迫的抗性; 在大豆中, 4个BiP基因受到逆境处理诱导表达, 当超表达4个基因时, 能够降低干旱和渗透胁迫后叶片的失水速率, 提高对逆境的耐受性[17-18]。此外, 内质网胁迫相关基因超表达能够增强植物种子萌发时对糖基化酶抑制剂衣霉素处理的耐受性, 并提高幼苗的存活率[7,17]。施加衣霉素等同于增加细胞中内质网胁迫, 为了获得细胞的稳态, 超表达内质网胁迫相关的分子伴侣能够迅速协助胁迫条件下异常蛋白质的正常折叠或者降解, 在这个过程中, UPR途径被激活, 提高内质网处理异常蛋白质的能力, 平衡细胞分泌的活性。如果内质网的胁迫反应持久存在, 会进一步激活细胞凋亡的途径。在拟南芥中, 与内质网膜有关的 Gβ-Gγ的异源二聚体蛋白质参与的信号途径能够激发UPR有关的细胞死亡; 在大豆中, 分子伴侣所诱导的 UPR途径中, 存在内质网胁迫后转导细胞程序性死亡(PCD)信号途径, 这个途径能够整合内质网胁迫和渗透胁迫的信号, 增强胁迫诱导细胞死亡的关键调控基因N-rich蛋白质和含有 NAC结构域蛋白质GmNAC6的表达。N-rich蛋白质相关基因的上调表达能够通过长期的内质网胁迫和渗透调节胁迫传递 PCD信号。
在豌豆中BiP基因受到水分、真菌侵染、昆虫啃食等外界胁迫环境上调表达[19]; 在高温、干旱等逆境胁迫条件下, 菠菜中 BiP蛋白会逐渐增加[20];水稻中BiP3基因所编码的蛋白可以通过调节XA21蛋白的加工来实现植株对白叶枯病的抗性[21]。从玉米抗旱自交系旱 21中分离得到的逆境胁迫的负调控因子ZmBiP2超表达后增加了拟南芥转基因植株对盐和甘露醇胁迫的敏感性, 而 HSP70可以提高干旱高温复合胁迫诱导下玉米叶片抗氧化防护能力[22]。对耐热叶用莴苣品种在高温胁迫下的分析发现,HSP70-3701基因在处理中保持较高的表达水平可能与耐热性相关[23]。大豆和烟草中超表达内质网胁迫相关的分子伴侣结合蛋白BiP基因能够显著增强逆境胁迫。综上所述, 超表达BiP基因能够减轻内质网胁迫以及渗透胁迫所诱导的细胞死亡, 从而维持细胞在逆境下的稳态。由于BiP基因的序列和功能在不同植物中具有保守性, 这为其他植物的抗旱研究提供了有利的基因资源。本研究克隆了与植物内质网胁迫相关的分子伴侣BiP基因同源的基因BnA7HSP70, 超表达BnA7HSP70基因的油菜在缺水、渗透胁迫以及衣霉素处理后表现较强的耐受性。
1 材料与方法
1.1 实验材料
选用甘蓝型油菜自交系7492由华中农业大学杨光圣教授团队提供。
1.2 甘蓝型油菜的BnA7HSP70基因的克隆与转化
依据大豆内质网胁迫相关基因BiPD(AF031241)的序列, 从甘蓝型油菜自交系7492中克隆出其同源基因BnA7HSP70(GenBank登录号为KP091457)。将2.01 kb的BnA7HSP70基因通过酶切连接插入到植物双元转化表达载体 PBI 121中, 通过农杆菌 GV 3101介导遗传转化到甘蓝型油菜中。
1.3 BnA7HSP70蛋白亚细胞定位
将BnA7HSP70基因克隆到PGY-EGFP亚细胞定位专用载体中, 利用 QIAGEN Plasmid Midi Kit(http://www.qiagen.com/)试剂盒提取高质量质粒DNA, 利用PEG-Ca2+介导的方法将亚细胞定位载体转化拟南芥原生质体细胞。在Leica激光共聚焦显微镜下观察GFP在细胞内的定位状况。
1.4 植物的生长、水分胁迫和衣霉素处理
将非转基因植物(WT)和35S启动子作用下的超表达转基因家系(OE)种植在温室中。用于水分胁迫处理的转基因家系是通过鉴定后选择的1个纯合家系。水分胁迫实验在可控制的环境下进行, 油菜在白天25℃ 14 h和黑暗22℃ 10 h的环境下种植, 光照为240 µmol m-2s-1, 相对湿度为60%~70%。经过4周正常生长后, 对转基因和非转基因材料实施 10 d的缺水处理。渗透胁迫实验中是将生长40 d的转基因和非转基因油菜转移到20% PEG (MW-6000)的液体培养基中处理 48 h。在衣霉素处理实验中, 采用2.5~10.0 µg mL-1衣霉素加入到油菜发芽(murashige and skoog, MS)培养基或者将三叶期正常生长的油菜苗转移到一定浓度衣霉素含量的营养液中生长。将胁迫实验不同阶段收获的叶片迅速冷冻于-80℃储存。设置各实验处理3次重复, 每次重复选用5个单株。
1.5 抗旱胁迫中的生理生化指标
抗旱胁迫实验中所选用的是转基因纯合家系的植株, 选用每个处理3~5个单株混合叶片6~8片, 每个处理3次重复。
1.5.1丙二醛测定用 20% PEG处理后的植株叶片的丙二醛(malondialdehyde, MDA)测定实验来评价脂过氧化反应。利用硫代巴比妥酸(2-thiobarbituric acid, TBA)反应测定MDA的含量。通过测定532、 600和450 nm下叶片提取物上清中的吸光度值来计算MDA的含量。MDA (µmol L-1) =6.45× (D532-D600) - 0.56×D450。
1.5.2超氧化物歧化酶测定取1 g 20% PEG处理植株的叶片, 用3 mL 200 mmol L-1磷酸缓冲液(2 mmol L-1磷酸二氢钠-磷酸氢二钠、2 mmol L-1EDTA和80 mmol L-1抗坏血酸维生素C, pH 7.8) 10 000×g离心25 min后, 通过Bradford法定量蛋白质。总超氧化物歧化酶(superoxide dismutase, SOD)的活性是通过 560 nm波长下与硝基蓝四氮唑(nitroblue tetrazolium, NBT)的显色反应来测定, 反应体系包含50 mmol L-1磷酸钠(pH 7.8)、13 mmol L-1甲硫氨酸、2 µmol L-1维生素 B2、0.1 µmol L-1EDTA 和 75µmol L-1NBT。单位酶活力定义为能够抑制NBT反应活力 50%所使用的酶量。利用邻苯三酚为底物测定过氧化物酶(peroxidase, POD)活性。1个单位的POD活性定义为在20 s中从邻苯三酚中获得1 mg红棓酚的酶活力, 测定波长为420 nm。
1.5.3植物相对含水量(relative water content, RWC)和叶绿素含量测定在干旱处理下, 油菜叶片的相对含水量RWC (%) = (鲜重-干重)/(饱和水叶片重量-干重)×100。用打孔器从每片叶子的不同位置截取直径为1 cm叶盘, 设3个重复, 将叶盘混合后在1 mL 80%丙酮中研磨, 将抽提物以 100%丙酮稀释10倍后, 在A645和A663波长下测定吸光度值。叶绿素a(µg mL-1) = 12.5A663-2.55A646; 叶绿素b(µg mL-1) = 18.29A646-4.58A663。
1.5.4Evans Blue染色分析用土钵种植油菜苗在正常灌溉条件下生长4周后断水10后取4片叶盘置0.25% (w/v) Evans blue溶液中, 100 r min-1震荡20~30 min。将叶盘取出在ddH2O中清洗至无蓝色液体从细胞中渗透出来, 之后在 96%乙醇溶液中浸泡以除去叶绿素。通过叶片上蓝色染色状态确定死亡的细胞。将叶盘转移到1.5 mL离心管中, 加0.5 mL ddH2O用细研棒研磨, 以10 000×g离心5 min, 结束后加入50% (v/v)乙醇和1% (w/v) SDS溶液在60℃处理30 min。最后在600 nm波长下测定溶液的吸光度值。
1.5.5Real-time PCR分析提取油菜叶片 RNA(RNeasy Plant MiniKit, Promega), 用NanoDrop 2000(Thermo Fisher, 美国)分光光度计检测浓度及纯度。取样品RNA 1 μg, 进行First-Strand cDNA Synthesis反应。取稀释后的反转录产物 2 μL, 在 CFX96 Real-time system (Bio-Rad)中进行 PCR反应, 参照GoTaqqPCR Master Mix (Promega, 美国)的操作来配制qRT-PCR体系, 设每个样品3次重复。PCR程序为95℃预变性3 min; 95℃变性10 s, 60℃复性30 s,72℃延伸15 s, 45个循环; 95℃, 10 s; 65℃至95℃, 5 s。依照 2-ΔΔCt方法计算 qRT-PCR 结果[24]。
2 结果与分析
2.1 油菜BnA7HSP70基因的蛋白质表达分析
将BnA7HSP70基因的编码区在CaMV 35S启动子作用下与GFP蛋白融合, 用所构建的载体转化拟南芥叶肉细胞原生质体。在激光共聚焦显微镜下观察亚细胞定位, 发现融合蛋白定位在细胞质中(图1)。
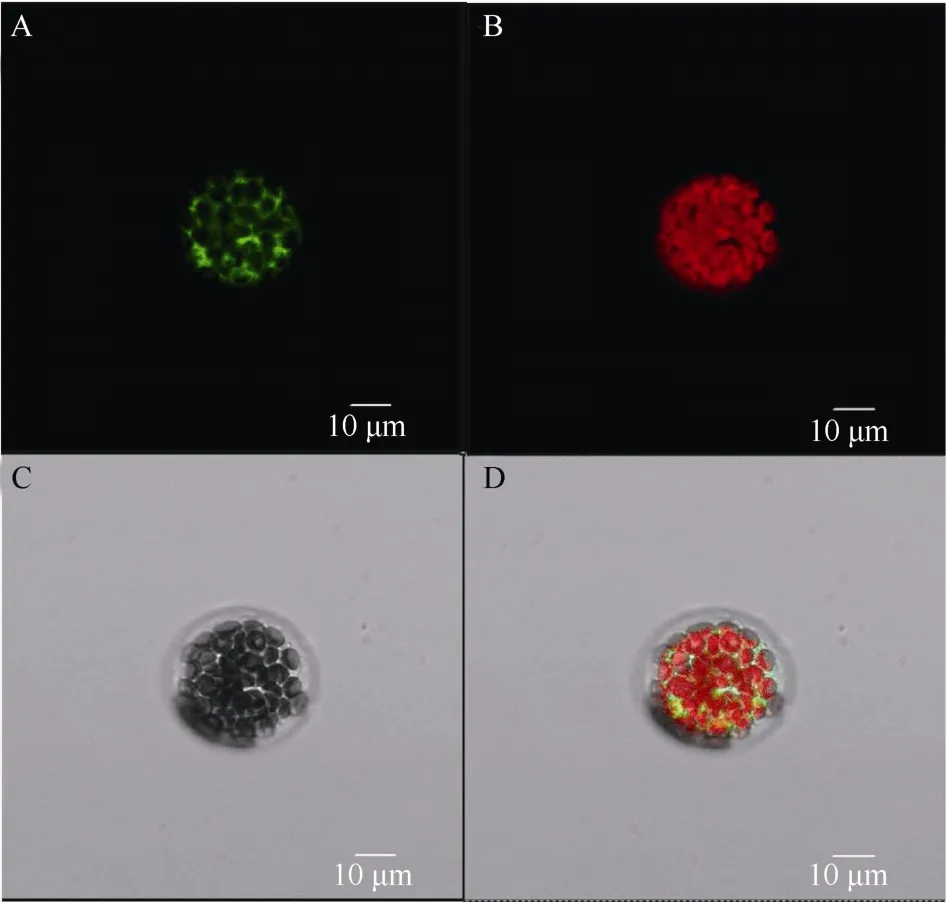
图1 BnA7HSP70-GFP融合蛋白在拟南芥原生质体中的定位Fig. 1 Subcellular localization of BnA7HSP70 and GFP fusion protein in Arabidopsis protoplasts.(A) BnA7HSP70和GFP融合后蛋白的亚细胞定位, 在488 nm下原生质体中细胞质显示绿色荧光; (B)在580 nm下同样原生质体中叶肉细胞显示红色荧光信号; (C)自然光照视野下细胞图; (D)自然光和荧光下的融合图片。(A) Subcellular localization of full-length GFP fused with green fluorescent protein (GFP), the cytoplasm showed a green fluorescent signal at 488 nm. (B) The mesophyll cells showed a red fluorescent signal at 580 nm. (C) A bright-field image of protoplast cell;(D) A bright-field image and the merged image are shown at the bottom. Scale bars, 10 µm.
2.2 BnA7HSP70超表达植株在干旱条件下表现出耐旱性
转基因植株和非转基因植株种植在温室中, 待生长到四至五叶期开始连续断水10 d。对照材料的叶片完全萎蔫, 而转基因植株表现出对干旱胁迫的耐受性。复水3 d后, 对照材料不能继续生长, 直至死亡。而大多数的超表达植株能够恢复正常生长,叶片相对含水量显著高于非转基因对照(图 2-A~C,F)。另外, 将在营养液中培养的非转基因对照和转基因超表达植株生长 40 d后, 转移到 20% (w/v)PEG-6000溶液中进行渗透胁迫处理48 h。超表达植株在渗透胁迫处理后叶片相对含水量显著高于非转基因植株(图2-D~E, G)。总结上述实验:BnA7HSP70超表达能够提高转基因植株对干旱和渗透胁迫的耐受性。
2.3 干旱条件下转基因植株的生理生化指标分析
当植物遇到干旱后光合作用发生紊乱, 光呼吸作用增强, 呼吸速率上升, 叶绿体和线粒体中积累大量过氧化氢。过氧化氢是氧化应激反应中的一种,大量积累会对细胞产生伤害。除此以外, 自由基诱导的脂质过氧化程度反映了干旱处理对植物细胞的胁迫程度。转基因植株和非转基因植株的20% PEG处理结果显示, 野生型植株的H2O2含量高于转基因植株(图3-A)。干旱胁迫导致的活性氧爆发会使得植物叶片衰老, 植株中丙二醛含量是衡量植株对逆境胁迫的耐受性指标。20% PEG处理后植株叶片中脂质过氧化程度在处理后第 3天会增加, 转基因植株叶片中丙二醛的含量显著低于非转基因植株, 表明转化BnA7HSP70基因能够提高油菜苗期逆境下抗过氧化能力(图3-B)。
2.4 转基因植株在干旱胁迫下的抗氧化相关酶活性测定
干旱胁迫会使得植株产生氧化应激反应, 导致抗氧化相关酶如超氧化物歧化酶(SOD)和过氧化物酶(POD)活性的变化。在正常条件下, 非转基因和转基因植株SOD活性差异不显著, 干旱胁迫处理后转基因和非转基因植株中SOD活性增加, 但是前者显著高于后者(图4-A)。同样, 在干旱胁迫下转基因植株中POD的含量也显著高于非转基因植株。SOD和POD酶活力的增加能够清除氧化应激反应对植株本身的伤害, 降低对细胞质膜的损伤(图4-B)。
2.5 干旱胁迫下转基因植株叶片相对含水量的变化以及衰老相关基因的表达分析
将正常灌溉条件下生长到六至八叶期的转基因和非转基因植株断水处理10 d后, 在4个转基因家系OE2、OE3、OE7和OE8中叶片的相对含水量为58%、62%、71%和55%, 高于非转基因植株44%的相对含水量(图5-A)。在继续7 d干旱后, 非转基因植株的叶片中叶绿素含量比转基因植株显著下降(图 5-B)。
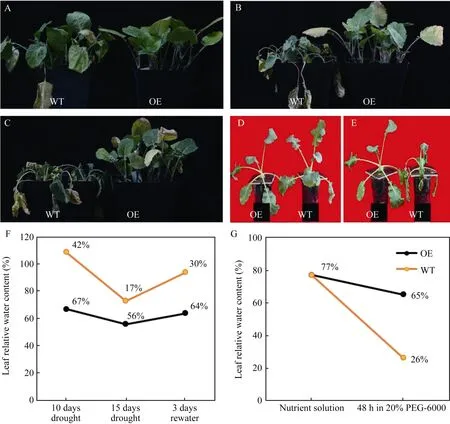
图2 BnA7HSP70基因超表达植株(OE)和非转基因对照(WT)在干旱和20% PEG渗透胁迫处理后表现出耐旱性Fig. 2 BnA7HSP70 overexpressed (OE) plants confer tolerance under a restricted water regime and 20% PEG treatment(A)对生长4~5周油菜苗进行断水10 d处理, 可见转基因植株表现出更好的耐受性; (B)对生长4~5周油菜苗进行断水15 d处理, 可见转基因植株表现出更好的耐受性; (C)干旱10 d后复水3 d, 大多数非转基因植株不能恢复正常生长, 而转基因植株能够恢复正常生长。(D)在营养液中生长40 d的非转基因和转基因植株; (E)将生长在营养液中40 d的非转基因和转基因植株转移到20% (w/v) PEG-6000的培养液中48 h。通过处理过程中每天更换新鲜的PEG溶液来保证处理时的浓度保持不变; (F)转基因和非转基因植株在干旱10 d、15 d和复水3 d后叶片的相对含水量测定; (G)转基因和非转基因植株从营养液中正常生长转移到20% PEG-6000渗透胁迫处理48 h后叶片的相对含水量。(A) For the fast soil drying treatment, wild type (WT) and BnA7HSP70 overexpressed (OE) lines were allowed to reach four to five weeks leaves stage of development when drought was rapidly induced by withholding irrigation for 10 days. The stress condition was prolonged until the leaves of wild type plants completely wilted. (B) For the fast soil drying treatment, wild type (WT) and BnA7HSP70 overexpressed(OE) lines were allowed to reach four to five weeks leaves stage of development when drought was rapidly induced by withholding irrigation for 15 days. The stress condition was prolonged until the leaves of wild type plants completely wilted. (C) After rewatering for 3 days, most wild type plants were unable to recover, while OE plants survived continued to grow. (D) 40-day-old WT and OE transgenic plants grown in nutrient solution. (E) For drought stress, 40-day-old WT and OE transgenic plants were transferred into nutrient solution containing 20% (w/v)PEG-6000 for 48 h. The concentration of PEG was maintained daily by changing the nutrient solution. (F) Leaf relative water content from WT and OE plants after 10 days, 15 days drought stress and 3 days rewater treatment. (G) Leaf relative water content from WT and OE plants after 20% PEG-6000 treatment for 48 h.
当植物遇到干旱胁迫时, 形态上、生理上以及分子生物学水平会发生变化, 如植株叶片会提前衰老来加速营养从老叶向幼叶转化, 最终保证自身的存活[26-27]。为探索BnA7HSP70基因超表达是否与叶片衰老相关, 在甘蓝型油菜中取距离心叶第 3片叶, 检测叶片衰老标识基因BnLSC54和BnLSC222基因的表达量。在正常灌溉条件下, 转基因和非转基因植株的叶片中BnLSC54和BnLSC222基因的表达量较低, 而在干旱条件下,BnLSC54和BnLSC222基因受到诱导表达, 并且在非转基因植株叶片中的表达量高于转基因植株(图6)。干旱胁迫能够显著提高油菜叶片衰老相关基因的表达, 从而表现出叶片快速变黄, 而在超表达的转基因家系中, 叶片衰老相关基因的表达量存在一定程度的提高, 但比非转基因植株表达量增加的程度要低。

图3 20% PEG处理下转基因植株和非转基因植株中的H2O2和MDA含量Fig. 3 Changes of H2O2 content and MDA levels in wild plant and transgenic plant line under 20% PEG treatment.(A) 20% PEG处理后第3天植株H2O2含量; (B) 20% PEG处理后第3天植株中MDA含量。每次实验重复3次。(A) H2O2 content of seedlings at these days of the 20% PEG treatment; (B) MDA levels of seedlings at these days of the 20% PEG treatment. Data are shown as mean±SD of three independent measurements.

图4 20% PEG胁迫条件下转基因和非转基因植株抗氧化酶活性Fig. 4 Antioxidant enzyme activities in wild plant and transgenic plants after treatment with 20% PEG(A) SOD酶活性; (B) POD酶活性。每次实验重复3次。(A) SOD activity; (B) POD activity. Data are shown as means ±SD of three independent measurements.
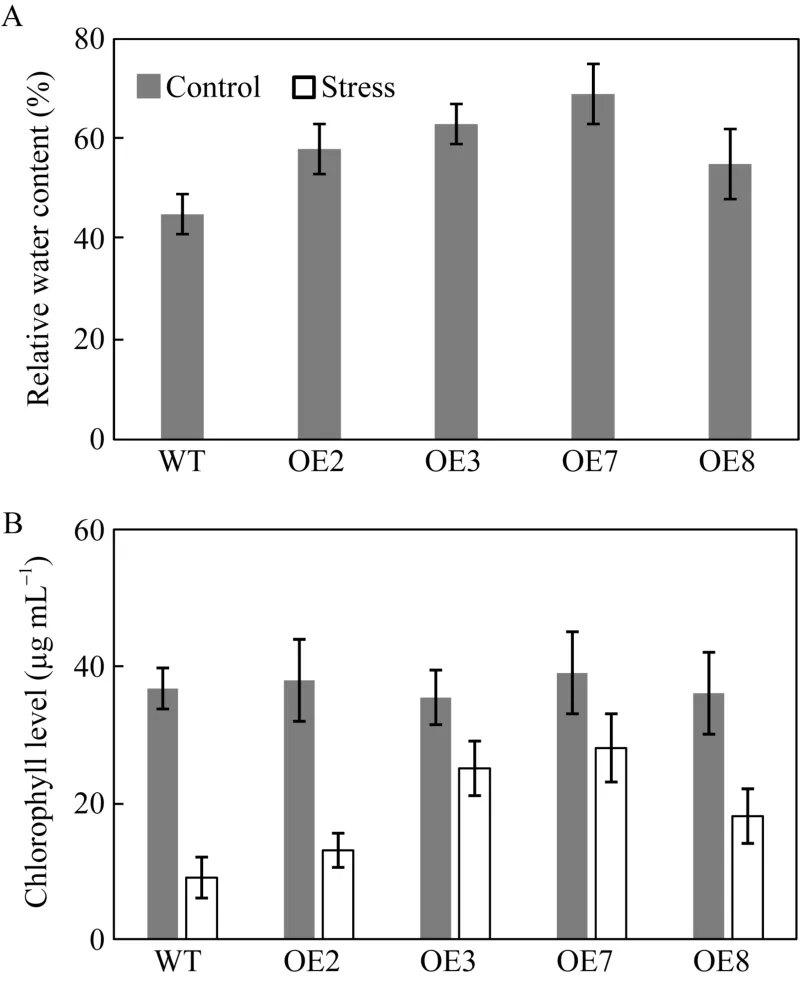
图5 超表达BnA7HSP70转基因油菜能够在断水10 d后具有较高持水能力Fig. 5 Overexpression of BnA7HSP70 makes Brassica napus hold more water in soil pot without irrigation for 10 days(A)转基因植株(OE2、OE3、OE7和OE8)与非转基因植株在干旱条件下的相对含水量; (B)对转基因和非转基因材料每个家系取样6~8片叶子, 测定叶绿素含量。Control: 正常生长条件下的野生型和超表达植株; Stress: 生长到4周的转基因和非转基因植株进行连续7 d干旱处理。(A) Relative water content (RWC) of wild type and BnA7HSP70 overexpressing seedling (OE2, OE3, OE7, and OE8) leaves under drought condition. (B) Chlorophyll a and b concentrations were calculated as described in the materials and methods 1.5.3 and combined to give the total chlorophyll concentration, each of which is a mean of the samples taken from 6-8 leaf disks in each pool.Control: the wild and OE plants grew in the irrigated condition;Stress: four-week old wild and OE plants were subjected to progressive drought for seven days.
2.6 BnA7HSP70超表达植株表现出对衣霉素的抗性
超表达BnA7HSP70基因能够减轻和延缓干旱胁迫对叶片细胞的损伤, 衣霉素是一种糖基化酶抑制剂, 能够抑制植物细胞生长令其死亡。为了验证转基因植株对衣霉素的耐受性, 对转基因和非转基因植株的种子用2.5 µg mL-1的衣霉素处理, 见到转基因植株能够正常发芽, 并且根系长度明显高于非转基因植株(图7-A)。在MS固体培养基上添加5.0µg mL-1衣霉素, 处理转基因材料2周, 发现其根系发育优于野生型。将非转基因植株和转基因T1代种子在含有10 µg mL-1衣霉素的MS固体培养基上发芽5~6 d, 之后转移到无衣霉素的固体培养基上生长,发现转基因种子能够继续生长为植株, 而非转基因种子不能萌发最后死亡。在非转基因油菜生长到四叶期时用5.0 µg mL-1衣霉素处理1周, 会诱导叶片发黄, 继而出现坏死斑; 而转基因植株在处理 1周后叶片受到胁迫程度低于非转基因植株(图7-B)。为进一步量化对衣霉素的耐受性, 利用Evans Blue染叶片, 在衣霉素处理1周后的转基因和非转基因材料中表现出差别, 随着处理时间的增加, 转基因植株叶片死细胞数目显著低于非转基因植株叶片(图7-C)。
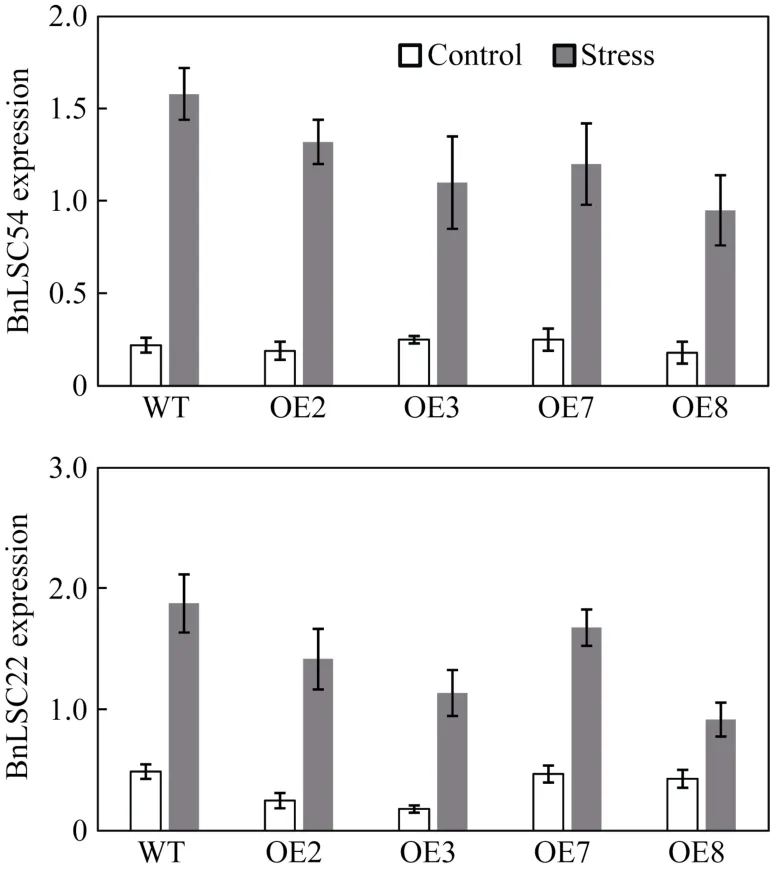
图6 BnA7HSP70超表达能够延迟逆境下转基因植株的叶片衰老相关基因表达Fig. 6 BnA7HSP70 overexpression delays drought-induced leaf senescence in OE lines confronted with stress野生型(WT)和超表达(OE)转基因家系(OE2、OE3、OE7和OE8)在生长4周后断水10 d, 取样检测油菜叶片衰老相关基因BnLSC45和BnLSC222的表达。Control: 正常灌溉条件下的植株。Stress: 受到干旱胁迫后的植株。每次实验3次重复。干旱条件下诱导衰老相关基因BnLSC45 和BnLSC222基因的表达。从正常灌溉和断水胁迫处理下的非转基因和转基因植株成熟叶片中提取RNA, 用qRT-PCR实验检测基因的表达量。Drought was induced in wild type (WT) and OE transgenic plants(OE2, OE3, OE7, and OE8) at four-week old stage by withholding irrigation for 10 days. Control: normally irrigated plants. Stress:drought-stressed plants. Values are given as mean SD from three replicates. The experiment of senescence-associated genes BnLSC45 and BnLSC222 was induced by drought treatment. Total RNA was isolated from irrigated and drought-stressed mature leaves of wild plants and OE lines, and gene induction was monitored by quantitative RT-PCR using gene-specific primers.
2.7 BnA7HSP70基因超表达后缓解内质网应激反应途径中相关基因表达
植物遭受逆境胁迫时, 细胞中内质网应激反应表现为网腔内错误蛋白的折叠与未折叠蛋白聚集和钙离子平衡紊乱。BnA7HSP70所介导途径能够抑制内质网未折叠蛋白的聚集, 从而减轻内质网的应激反应。对转基因植株进行衣霉素处理 72 h, 检测内质网胁迫相关的关键基因如帮助蛋白质折叠的分子伴侣基因BnBiP3, 内质网磷酸化的钙联接蛋白基因BnCNX1的表达量(图8)。在转基因家系中,BnCNX1在衣霉素处理24 h后诱导表达, 表达量在48 h后趋于平缓, 72 h后下降。BnBiP3基因的表达模式和BnCNX1的表达时空性相同。在内质网胁迫和渗透胁迫过程中, 编码天冬酰胺富集蛋白相关基因BnNRP所介导的途径传递来自内质网胁迫后细胞死亡信号, 反馈植物体对于胁迫后的反应。在非转基因植株中,BnNRP在处理24 h后诱导表达, 处理48 h其表达量达到最高水平, 而在转基因植株受到逆境胁迫后BnNRP基因并未被快速诱导表达, 其基因表达量明显低于非转基因植株。以上结果表明,BnA7HSP70基因超表达后延缓内质网胁迫后出现的细胞死亡相关基因的表达, 从而能够减轻逆境胁迫对植物体生长的影响。
3 讨论
3.1 油菜中超表达BnA7HSP70基因能够减轻干旱以及内质网胁迫
在甘蓝型油菜中, 超表达BnA7HSP70基因能够显著提高油菜在干旱胁迫处理下的耐受性。当植株受到干旱胁迫时, 在细胞水平上会出现细胞膜蛋白结构的损伤, 在防止细胞结构的进一步受损中, 植物产生应激反应调节逆境适应性。BnA7HSP70基因在植物面对逆境时起到以上作用。当BnA7HSP70基因超表达时, SOD酶活力的提高和细胞脂膜过氧化程度的下降能够反映出干旱胁迫后植物的抗氧化防御系统启动, 减轻了细胞结构受损程度; 油菜中超表达BnA7HSP70基因调控参与UPR和NPR途径中基因表达, 维持细胞稳态, 使得植物体适应性地对待逆境。内质网分子伴侣基因BiP3参与内质网和渗透胁迫中NRP介导的细胞死亡途径, 在转基因植株中BnBiP3基因的表达量比野生型降低, 表明BnA7HSP70超表达后负调控 NRP介导的细胞死亡相关基因的表达, 在转基因植株逆境胁迫后的表型上表现为延迟胁迫后的叶片衰老, 增强了胁迫后的适应性。
3.2 BnA7HSP70基因超表达后间接调控逆境胁迫途径
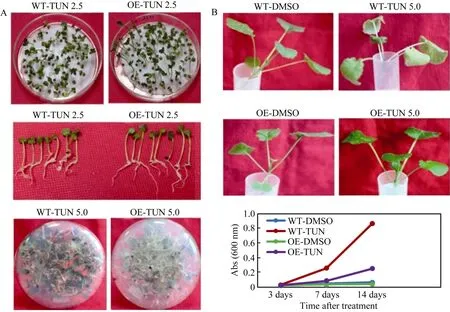
图7 BnA7HSP70超表达植株表现出对衣霉素诱导细胞死亡的耐受性Fig. 7 BnA7HSP70 overexpression increases resistance against tunicamycin (TUN)-induced cell death(A)转基因和非转基因植株种子和幼苗对2.5 µg mL-1或者5.0 µg mL-1衣霉素的敏感性实验。(B)~(C) Evans Blue染色方法测定转基因和非转基因植株在衣霉素处理后7 d、14 d的细胞死亡程度。Abs (600 nm)测定值反映死细胞含量, 每个实验重复3次。(A) Seeds and seedlings from overexpressed plants (OE) and untransformed wild-type (WT) plants were exposed to 2.5 µg mL-1 or 5.0 µg mL-1 tunicamycin. (B)-(C) Seedlings were monitored for the development of chlorosis and necrotic lesions, and cell viability were measured by the Evans blue dye method. Abs (600 nm) reflects the dead cell content. The values represent the average of three replicates (±SD).
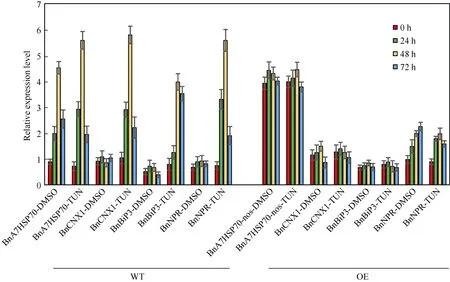
图8 衣霉素处理后转基因和非转基因植株内质网胁迫的标签基因的表达分析Fig. 8 Gene expression analysis of senescence and cell death-associated genes in wild type and OE plants under tunicamycin treatment取衣霉素处理0、24、48和72 h的非转基因和转基因植株的叶片, 分析内源BnA7HSP70、BnCNX1、BnNRP和BnBiP3基因的表达量。DMSO处理的植株为对照。BnCNX1、BnBiP3和BnNRP基因是内质网胁迫的标志基因。Total RNA were isolated from wild type and transgenic plant leaves at 0, 24, 48, and 72 h of treatment, and the endogenous BnA7HSP70,BnCNX1, BnBiP3, and BnNRP in wild type and OE transgenic plants treatment with tunicamycin and the control DMSO were monitored by qRT-PCR. The bars indicate the confidence interval (P < 0.05, n = 3). BnCNX1, BnBiP3, and BnNRP are ER stress markers.
动物系统保证逆境胁迫后细胞的稳态时, 内质网上的分子伴侣基因会结合ATF6基因, 阻止该基因的高尔基体定位信号, 从而导致其不能通过分泌系统转移。植物在逆境下, 内质网内未折叠的蛋白数量逐渐增多, 当超过内质网内稳态平衡后, 会引起内质网的胁迫应答反应。在拟南芥中, 分子伴侣基因与未折叠蛋白结合后, 使之前结合的 bZIP28从复合体中释放出来, 随着bZIP28基因激活表达,引发细胞核中胁迫相关的基因上调表达如编码含有BiP3、HSP90-like、钙联动蛋白、DNA J domain蛋白相关基因、二硫化物相关蛋白等表达[25-28]。本研究中超表达BnA7HSP70能够诱导一系列保护机制,如BnCNX1和BnBiP3基因的表达量比非转基因植株降低。分析BnCNX1和BnBiP3基因的启动子序列发现存在 ERSE-I (CCAAT-N10-CACG), ERSE-II(ATTGG-N2-CACG), XBP1-BS (GA-TGACGT-GK)和UPRE (TGACGT-GR)保守结构域, 这些组分在拟南芥中被认为是受衣霉素诱导上调表达基因的启动子中保守元件。在BnBiP3基因启动子中存在着2个ERSE-I结构域包含着CCAAT box和bZIP因子结合位点 CACG; 在BnCNX1基因的启动子中存在着ERSE和XBP1-BS结构域。bZIP转录因子是通过形成同源或者异源二聚体来行使功能的。根据前人研究结果推测在非转基因的材料中, 受到逆境胁迫后BnA7HSP70表达的蛋白与未折叠蛋白结合, 使其从 bZIP28转录因子上释放出来, bZIP28转录因子从内质网转移到高尔基体上, 被SIP和S2P类蛋白剪切后转运到细胞核中后结合到BnCNX1和BnBiP3基因的启动子区域, 从而使得这些基因上调表达。当BnA7HSP70基因超表达后, 有足够的蛋白质与内质网胁迫后未折叠蛋白结合, 协助未折叠蛋白行使正确功能, 而与bZIP28结合的BnA7HSP70蛋白不会释放, 从而阻止了bZIP28向高尔基体的转移, 进而不会上调下游BnCNX3和BnBiP3基因的表达(图9)。
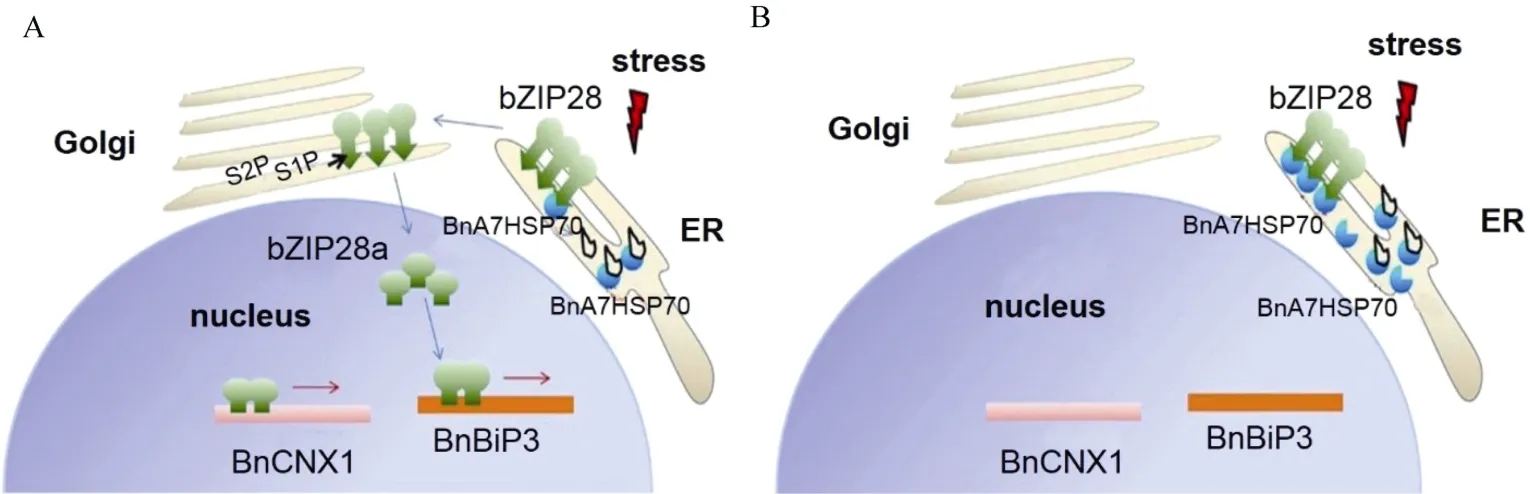
图9 BnA7HSP70调控bZIP 28基因介导的未折叠蛋白途径的模式Fig. 9 Model for BnA7HSP70 expression on the mobilization of bZIP28 and upregulation of UPR genes(A)在逆境胁迫下, BnA7HSP70蛋白与未折叠蛋白结合后从bZIP 28中释放下来, 定位于高尔基体的S1P和S2P将bZIP 28蛋白水解后释放得到bZIP 28n, 转录因子bZIP 28n定位到细胞核中上调BnBiP3和BnCNX1基因的表达; (B)当BnA7HSP70超表达后, 得到足够的BnA7HSP70蛋白质与bZIP28和胁迫下产生的未折叠蛋白结合, 使得bZIP28保留在内质网上, 从而不会上调细胞核中基因的表达。(A) In response to the stress, BnA7HSP70 is competed away by the accumulation of misfolded proteins and bZIP28 is proteolytically activated by Golgi-localized S1P or S2P to release bZIP28n, which relocates to the nucleus where it upregulates stress genes including BnBiP3 and BnCNX1; (B) When BnA7HSP70 is overexpressed, accumulated BnA7HSP70 is enough for association with bZIP28 and misfolded proteins. As a result, bZIP28 is detained in the ER even under stress conditions.
4 结论
从甘蓝型油菜中克隆干旱胁迫诱导表达的基因BnA7HSP70, 该基因超表达的植株在缺水条件下有着更高的相对含水量, 更强的渗透调节能力和较低的脂质膜过氧化性, 表现出对干旱胁迫的耐受性。此外, 转基因植株的幼苗在萌发期表现出对糖基化抑制剂衣霉素处理的耐受性。BnA7HSP70基因能够调控逆境胁迫下细胞中内质网未折叠蛋白途径(UPR Pathway)和N-rich protein途径(NRP pathway)中相关基因表达, 保持逆境胁迫后细胞的稳态, 缓解逆境下植株应激反应所产生的损伤。
[1] Hartl F U, Bracher A, Hayer-Hartl M. Molecular chaperones in protein folding and proteostasis.Nature, 2011, 475: 324-332
[2] Wang W, Vinocur B, Shoseyov O, Altman A. Role of plant heat-shock proteins and molecular chaperones in the abiotic stress response.TrendsPlant Sci, 2004, 9: 244-252
[3] Carvalho H H, Brustolini O J, Pimenta M R. The molecular chaperone binding protein BiP prevents leaf dehydration-induced cellular homeostasis disruption.PLoS One, 2014, 9: e86661
[4] Liu J X, Howell S H. Managing the protein folding demands in the endoplasmic reticulum of plants.New Phytol, 2016, 211: 418-428
[5] Valente M A, Faria J A, Soares-Ramos J R. The ER luminal binding protein (BiP) mediates an increase in drought tolerance in soybean and delays drought-induced leaf senescence in soybean and tobacco.J Exp Bot, 2009, 60: 533-546
[6] Liu J X, Howell S H. Endoplasmic reticulum protein quality control and its relationship to environmental stress responses in plants.Plant Cell, 2010, 22: 2930-2942
[7] Carvalho H H, Silva P A, Mendes G C. The endoplasmic reticulum binding protein BiP displays dual function in modulating cell death events.Plant Physiol, 2014, 164: 654-670
[8] Srivastava R, Deng Y, Howell S H. Stress sensing in plants by an ER stress sensor/transducer, bZIP28.Front Plant Sci, 2014, 5: 59
[9] Shen J, Chen X, Hendershot L, Prywes R. ER stress regulation of ATF6 localization by dissociation of BiP/GRP78 binding and unmasking of Golgi localization signals.Dev Cell, 2002, 3:99-111
[10] Ma Y, Hendershot L M. ER chaperone functions during normal and stress conditions.J Chem Neuroanat, 2004, 28: 51-65
[11] Srivastava R, Chen Y, Deng Y, Brandizzi F, Howell S H. Elements proximal to and within the transmembrane domain mediate the organelle-to-organelle movement of bZIP28 under ER stress conditions.Plant J, 2012, 70: 1033-1042
[12] Urano F, Wang X, Bertolotti A, Zhang Y, Chung P, Harding H P,Ron D. Coupling of stress in the ER to activation of JNK protein kinases by transmembrane protein kinase IRE1.Science,2000,287: 664-666
[13] Martinez I M, Chrispeels M J. Genomic analysis of the unfolded protein response in Arabidopsis shows its connection to important cellular processes.Plant Cell, 2003, 15: 561-576
[14] Costa M D, Reis P A, Valente M A. A new branch of endoplasmic reticulum stress signaling and the osmotic signal converge on plant-specific asparagine-rich proteins to promote cell death.J Biol Chem, 2008, 283: 20209-20219
[15] Liu J X, Howell S H. bZIP28 and NF-Y transcription factors are activated by ER stress and assemble into a transcriptional complex to regulate stress response genes inArabidopsis.Plant Cell,2010, 22: 782-796
[16] Gomer C J, Ferrario A, Rucker N, Wong S, Lee A S. Glucose regulated protein induction and cellular resistance to oxidative stress mediated by porphyrin photosensitization.Cancer Res,1991, 51: 6574-6579
[17] Alvim F C, Carolino S M, Cascardo J C. Enhanced accumulation of BiP in transgenic plants confers tolerance to water stress.Plant Physiol, 2001, 126: 1042-1054
[18] Cascardo J C, Almeida R S, Buzeli R A. The phosphorylation state and expression of soybean BiP isoforms are differentially regulated following abiotic stresses.J Biol Chem, 2000, 275:14494-14500
[19] Cascardo J C, Buzeli R A, Almeida R S, Otoni W C, Fontes E P.Differential expression of the soybeanBiPgene family.Plant Sci,2001, 160: 273-281
[20] Anderson J V, Li Q B, Haskell D W, Guy C L. Structural organizationofthespinachendoplasmicreticulum-luminal 70-kilodalton heat-shock cognate gene and expression of 70-kilodalton heat-shock genes during cold acclimation.Plant Physiol, 1994, 104: 1359-1370
[21] Park C J, Bart R, Chern M. Overexpression of the endoplasmic reticulum chaperone BiP3 regulates XA21-mediated innate immunity in rice.PLoS One, 2010, 5: e9262
[22] 宋仲戬, 张登峰, 李永祥. 石云素, 宋燕春, 王天宇, 黎裕. 玉米分子伴侣基因ZmBiP2在逆境下的功能分析. 作物学报,2015, 41: 708-716 Song Z J, Zhang D F, Li Y X, Shi Y S, Song Y C, Wang T Y, Li Y.Cloning of maize molecular chaperone geneZmBiP2and its functional analysis under abiotic stress.Acta Agron Sin, 2015, 41:708-716
[23] 赵真真, 韩莹琰, 范双喜, 刘超杰, 郝敬虹, 李婷, 李雅博. 叶用莴苣热激蛋白LsHsp70-3701基因的克隆及高温胁迫下的表达分析. 核农学报, 2016, 30: 1083-1090 Zhao Z Z, Han Y Y, Fan S X, Liu C J, Hao J H, Li T, Li Y B. The cloning and expression analysis of Heat-shock protein LsHsp70-3701 of Leaf lettuce.J Nucl Agric Sci, 2016, 30:1083-1090 (in Chinese with English abstract)
[24] Livak K J, Schmittgen T D. Analysis of relative gene expression data using real-time quantitative PCR and the 2(-delta delta C(T))method.Methods, 2001, 25: 402-408
[25] Hanfrey C, Fife M, Buchanan-Wollaston V. Leaf senescence inBrassica napus: expression of genes encoding pathogenesisrelated proteins.Plant Mol Biol, 1996, 30: 597-609
[26] Buchanan-Wollaston V. Isolation of cDNA clones for genes that are expressed during leaf senescence inBrassica napus: identification of a gene encoding a senescence-specific metallothioneinlike protein.Plant Physiol, 1994, 105: 839-846
[27] Srivastava R, Deng Y, Shah S, Rao A G, Howell S H. BINDING PROTEIN is a master regulator of the endoplasmic reticulum stress sensor/transducer bZIP28 in Arabidopsis.Plant Cell, 2013,25: 1416-1429
[28] Iwata Y, Fedoroff N V, Koizumi N. Arabidopsis bZIP60 is a proteolysis-activated transcription factor involved in the endoplasmic reticulum stress response.Plant Cell, 2008, 20: 3107-3121
