重金属镉通过DNA氧化损伤途径诱导细胞中心体扩增
2018-04-09张瑞凯张艳花刘琴琴杨华丽李少钦
张瑞凯,张艳花,刘琴琴,杨华丽,李少钦
山西大学 生命科学学院,山西 太原 030006
随着工业化和城市化的发展,重金属污染因其高毒性、普遍性和持久性的存在,成为影响生态系统中有机体代谢的重要环境问题[1]。通常密度超过5 g/cm3的金属被称为重金属,其中铅(Pb)、镉(Cd)、汞(Hg)、铬(Cr)和砷(As)广泛存在于环境中,是威胁人体健康的主要的有毒重金属[1]。镉是天然存在的重金属之一,在工业生产中经常使用,被国际癌症研究机构(IARC)归为Ⅰ类致癌物[2-4]。镉暴露的主要来源是食品、香烟烟雾及镉相关工业。镉具有很长的生物半衰期,容易导致毒性累积,产生致癌作用[5]。
癌症是最常见的无传染性疾病,其致死率处于领先地位。根据2017年2月世界卫生组织(WHO)更新的数据,2012年约有1400万新增癌症病例,2015年约有880万的死亡病例和癌症有关。已明确,长期暴露在镉环境下会增加癌症的发生率[6-7],但镉导致癌症的机制尚不清楚[8-9]。中心体扩增指的是在一个细胞中出现超过2个中心体。已有报道称中心体扩增在癌症发生过程中扮演重要角色[10-13],中心体扩增能把非肿瘤细胞转化为肿瘤细胞[10],转基因诱发中心体扩增的小鼠会自发产生肿瘤[14]。有研究证明重金属也会引起中心体扩增[15]。目前还不清楚镉是否会引起中心体扩增,如是,那么中心体扩增就可能是镉诱发肿瘤的生物学机理。
许多研究发现,重金属镉能够引发活性氧(reactive oxygen species,ROS)的产生[4,16-21]和细胞内的DNA损伤[22]。但是,并不清楚镉是否通过升高ROS而引起DNA的氧化损伤。由于ROS和DNA损伤都与中心体扩增有关[23],我们假设镉通过DNA氧化损伤途径诱发中心体扩增,并通过本研究验证这个假说,研究内容包括镉是否能诱发中心体扩增,以及镉是否通过诱发DNA氧化损伤而导致中心体扩增。
1 材料与方法
1.1 材料
结肠癌细胞HCT116为本实验室保存,在37℃、5%CO2培养箱中,用含10%胎牛血清、1%双抗(青、链霉素)的DMEM培养基培养,直到细胞贴壁生长,当细胞密度长至70%左右,细胞状态良好时即可进行实验处理。
DMEM培养基、胰酶购自Gibco公司;胎牛血清购自杭州四季青公司;活性氧检测试剂盒够自碧云天生物技术公司;彗星电泳试剂盒够自TER⁃VIGEN公司;抗体及其他试剂购自Sigma公司。
1.2 MTT实验检测细胞活性
收集对数生长期的细胞,在96孔板中每孔接种约5×103个,设置3个复孔,培养箱中培养24 h,然后用不同浓度的CdCl2处理48 h,对照组加入等量的ddH2O;CdCl2处理结束后每孔加入15 μL MTT试剂(5 mg/mL),在培养箱中培养3 h;弃掉每孔的培养基,加入 150 μL二甲基亚砜(DMSO),轻轻振荡混匀10 min使结晶充分溶解,用酶标仪测定每孔的D490nm值,进行数据处理。
1.3 免疫荧光实验
在6孔板的每孔各放入2~3个盖玻片,收集对数生长期的细胞,以5×103/孔的密度接种;爬片后的细胞用甲醛丙酮体积比为1∶1的混合液在-20℃冰箱中固定6 min;用PBS洗3次(每次10 min);细胞在0.1%Triton X-100和3%牛血清白蛋白(BSA)(PBS配制)中分别孵育15 min和1 h;细胞在用3%BSA稀释的一抗中孵育过夜,4℃下用PBS洗3次(每次10 min);细胞在用3% BSA稀释的二抗中室温避光孵育1 h;用PBS洗3次(每次10 min);用DAPI染细胞,封片;在荧光显微镜下用油镜观察每个细胞的中心体数目。
1.4 ROS检测
用ROS检测试剂盒检测细胞内ROS变化。收集对数生长期的细胞,以2.5×104/孔的密度铺24孔板,培养箱中培养24 h后CdCl2处理2 h;去除培养液,加入500 μL荧光探针DCFH-DA,培养箱中孵育20 min后用无血清培养基洗涤细胞3次;收集细胞,用PBS重悬,均匀离心,重复2次后用1 mL PBS重悬均匀;各吸200 μL于96孔板中,荧光酶标仪检测488 nm激发波长、525 nm发射波长处的荧光值,然后进行数据处理。
1.5 彗星电泳实验
裂解液在4℃预冷至少20 min;将低熔点琼脂糖放在沸水中直到融化并保持5 min;将融化的琼脂糖在37℃水浴中冷却20 min;将细胞与融化的琼脂糖(37℃)按体积比1∶10的比例混匀,并迅速滴50 μL到彗星玻璃片上;将玻片放入4℃黑暗保持10 min,使琼脂糖充分凝固;将玻片浸没在预冷的裂解液中30~60 min;将玻片浸没在碱性解旋液中,室温避光保持20 min或4℃保持1 h;电泳槽中加入4℃预冷的碱性电泳液,将玻片浸没在电泳液中,20 V电压下电泳30 min;将玻片用ddH2O轻轻冲洗2次,然后在70%的酒精中浸泡5 min,在37℃下将玻片干燥15 min;EB染料染片后在荧光显微镜下观察,DNA在紫外光激发下会放射出橙红色信号。
1.6 统计学分析
应用SPSS17.0统计软件检验实验所得数据的正态分布性,采用单因素方差分析分析各组间差异的显著性,结果以P<0.05表示差异显著,P<0.01表示差异极显著。
2 结果
2.1 CdCl2对HCT116细胞活性的影响
用不同浓度的CdCl2(0、10、20、40 μmol/L)处理HCT116细胞48 h,如图1所示,随着CdCl2浓度的增加,细胞活性逐渐降低(P<0.01),呈剂量依赖效应。重要的是,20 μmol/L以下浓度的CdCl2对细胞活性几乎没有影响。
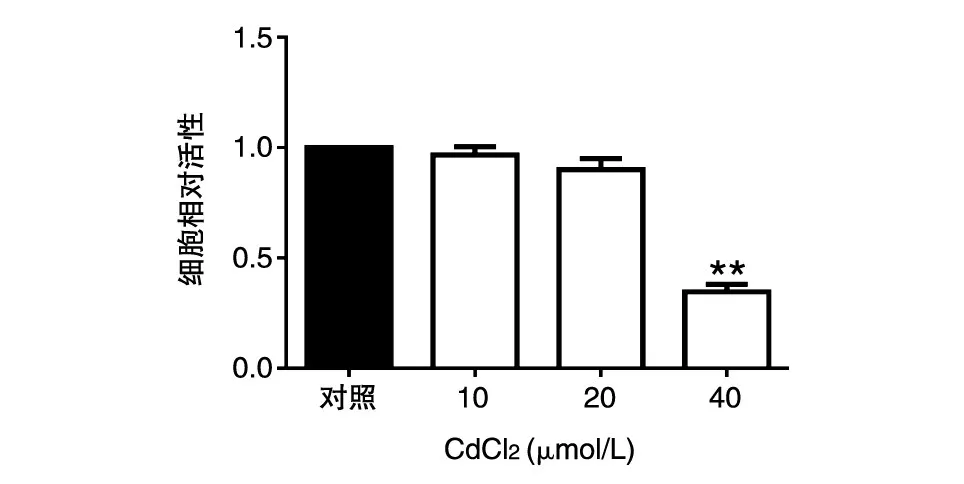
图1 CdCl2对HCT116细胞活性的影响**:与对照组相比P<0.01,差异极显著
2.2 CdCl2引起HCT116细胞中心体扩增
20 μmol/L及以下浓度的CdCl2对细胞活性没有明显的抑制作用。用20 μmol/L或以下浓度的CdCl2处理细胞,免疫荧光实验观察和计数中心体,细胞核由DAPI染色,呈现蓝色,中心体呈现绿色,实验处理诱发细胞产生中心体扩增,出现3个或以上的中心体形态(图2)。镉诱导中心体扩增并呈现剂量依赖效应(P<0.01)(图3)。

图2 CdCl2处理后免疫荧光实验观察细胞中心体蓝色荧光示细胞核,绿色荧光示中心体,箭头指向扩增的中心体
2.3 CdCl2引起细胞内ROS升高
用无毒剂量的CdCl2(20 μmol/L)处理细胞2 h,检测细胞内ROS水平,设置对照组、N-乙酰半胱氨酸(NAC)组、CdCl2组、CdCl2+NAC组。结果如图4,CdCl2处理组的ROS水平明显高于对照组(P<0.01);当同时有抗氧化剂NAC(提前1 h加)存在时,CdCl2升高细胞内ROS水平的活性被抑制(P<0.01)。
2.4 CdCl2引起细胞DNA损伤
用无毒剂量的CdCl2(20 μmol/L)处理细胞,彗星电泳实验检测细胞的DNA损伤水平,结果如图5,橙红色示DNA,CdCl2处理后的细胞核出现彗星状拖尾现象,彗星数量与对照组相比明显升高(P<0.01);当加入抗氧化剂NAC后,镉诱导产生彗星的能力受到抑制(P<0.01)(图6)。

图3 CdCl2处理后HCT116细胞中心体的扩增率**:与对照组相比P<0.01,差异极显著

图4 CdCl2处理对细胞内ROS水平的影响**:与对照组相比P<0.01,差异极显著

图5 彗星电泳图像

图6 CdCl2处理细胞引起DNA断裂**:与对照组相比P<0.01,差异极显著
2.5 NAC降低CdCl2引起的中心体扩增率
用无毒剂量的CdCl2(20 μmol/L)处理细胞后,细胞中心体扩增率明显升高(P<0.01),而当加入NAC(提前1 h加)后,CdCl2诱导的中心体扩增明显受到抑制(P<0.01)(图7)。
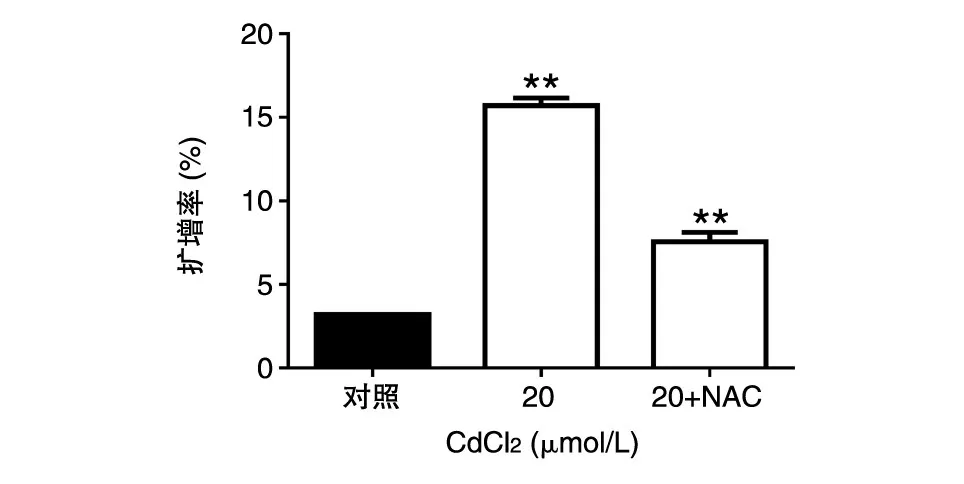
图7 NAC对CdCl2处理诱导中心体扩增的影响**:与对照组相比P<0.01,差异极显著
3 讨论
中心体扩增的机制比较复杂,几种潜在机制已被提出[11]:①在一个细胞周期中出现多次中心体的扩增;②胞质分裂失败,导致基因组及中心体数目增加1倍;③中心粒不受控制的分裂。随着研究的深入,发现越来越多的蛋白可能与之有关:肿瘤抑制因子p53在调控G1-S和G2-M检验点方面起着较为重要的作用,它的失活可导致中心体周期的失常[24];人乳头瘤病毒(HPV)E6和E7蛋白可能通过作用于不同的通路来阻碍中心体的自身平衡,E6可能通过使p53功能失活起作用,而E7可能通过灭活Rb导致中心体扩增[25]。Hol⁃mes等[15]报道称重金属能够诱导中心体发生扩增,并且目前只有4种重金属表现出诱导中心体扩增的能力,包括砷、六价铬、汞和纳米钛颗粒,每种金属通过不同的机制诱导中心体扩增。重金属诱导的中心体扩增及其在致癌性和细胞毒性中的作用尚未见研究报道。我们的实验表明,在低浓度的对细胞活性没有明显抑制的无毒性剂量下,镉会诱发明显的中心体扩增现象,这进一步证实了我们最近的报道[26]。
ROS在包括癌症在内的各种人类疾病的发生中发挥重要作用。已有报道[1,12]表明铅、镉、汞、铬和砷等重金属是ROS的常见外源诱导物,可直接或间接诱导ROS产生。Son等[5]研究发现ROS直接参与了镉诱导的癌变过程,并且提示AKT/ GSK-3β/β-catenin信号通路在此过程中的作用。我们的研究同样表明暴露在低浓度重金属镉下,细胞内的ROS水平急剧增加,而当加入抗氧化剂NAC之后,ROS水平会明显下降。
Filipic等[27]的研究表明,即使在低浓度的情况下,镉也能通过诱导DNA损伤和抑制DNA损伤修复来诱导突变。Yuan等[1]同样阐明重金属直接或间接诱导ROS产生并导致胃癌黏膜和DNA损伤,随后改变基因调控、信号转导和细胞生长,最终导致癌症的发生。Skipper等[2]采用彗星电泳检测到CdCl2能以浓度依赖的方式造成肝癌细胞HepG2的DNA损伤。我们的实验表明在低浓度镉处理下,ROS和DNA断裂水平都升高,加入抗氧化剂NAC后细胞内的ROS水平受到抑制,DNA损伤水平明显降低。这提示镉可以诱发DNA的氧化损伤。
我们的实验表明低浓度无毒剂量的镉处理会诱导细胞内中心体的扩增,同时会造成细胞内ROS水平的升高和DNA水平的损伤。因此,我们想探讨ROS和DNA损伤在镉诱导中心体扩增的过程中扮演什么角色。当加入抗氧化剂NAC后,ROS水平和DNA损伤水平均明显下降,并且对镉诱导的中心体扩增有明显的抑制。这提示镉通过DNA氧化损伤途径来诱导中心体扩增。
总之,以上研究结果提示镉通过DNA氧化损伤途径诱导中心体扩增。因为中心体扩增能使非肿瘤细胞演变为肿瘤细胞,所以中心体扩增可能是镉致癌的生物学机理。
[1] Yuan W,Yang N,Li X.Advances in understanding how heavymetalpollution triggerscastriccancer[J]. Biomed Res Int,2016,2016:7825432.
[2] Skipper A,Sims J N,Yedjou C G,et al.Cadmium chloride induces DNA damage and apoptosis of hu⁃man liver carcinoma cells via oxidative stress[J].Int J Environ Res Public Health,2016,13(1):E88.
[3] 李薇,谭业辉,李岩,等.氯化镉对肝癌细胞增殖的抑制作用[J].吉林大学学报(医学版),2009,35(4):616-619.
[4] Xie H,Wang J,Jiang L,et al.ROS-dependent HM⁃GA2 upregulation mediatesCd-induced proliferation in MRC-5 cells[J].Toxicol In Vitro,2016,34:146-152.
[5] Son Y O,Wang L,Poyil P,et al.Cadmium induces carcinogenesis in BEAS-2B cells through ROS-depen⁃dent activation of PI3K/AKT/GSK-3β/β-catenin signal⁃ing[J].Toxicol Appl Pharmacol,2012,264(2):153-160.
[6] Luevano J,Damodara C.A review ofmolecular events of cadmium-induced carcinogenesis[J].J Envi⁃ron Pathol Toxicol Oncol,2014,33(3):183-194.
[7] Feki-Tounsi M,Hamza-Chaffai A.Cadmium as a pos⁃sible cause of bladder cancer:a review of accumulat⁃ed evidence[J].Environ Sci Pollut Res Int,2014,21 (18):10561-10573.
[8] 肖春莲,刘胤,涂玮,等.镉致癌机制研究进展[J].中华预防医学杂志,2016,50(4):380-384.
[9] Wei Tianshu,Jia Jin,Wada Y,et al.Dose dependent effects of cadmium on tumor angiogenesis[J].Oncotar⁃get,2017,8(27):44944-44959.
[10]Anderhub S J,Kramer A,Maier B.Centrosome ampli⁃fication in tumorigenesis[J].Cancer Lett,2012,322(1):8-17.
[11]Fukasawa K.Centrosome amplification,chromosome in⁃stability and cancer development[J].Cancer Lett,2005, 230(1):6-19.
[12]SaundersW.Centrosomalamplification and spindle multipolarity in cancercells[J].Semin CancerBiol, 2005,15(1):25-32.
[13]张楠,李哲,郭农建.中心体扩增与肿瘤[J].国际肿瘤学杂志,2006,33(1):22-25.
[14]Levine M S,Bakker B,Boeckx B,et al.Centrosome amplification is sufficient to promote spontaneous tu⁃morigenesis in mammals[J].Dev Cell,2017,40:313-322.
[15]Holmes A L,Wise J P.Mechanisms of metal-induced centrosome amplification[J].Biochem Soc Trans,2010, 38(6):1687-1690.
[16]Wu X,Cobbina S J,Mao G,et al.A review of toxici⁃ty and mechanisms ofindividualand mixtures of heavy metals in the environment[J].Environ Sci Pollut Res Int,2016,23(9):8244-8259.
[17]Xu Chong,Huang Shile,Chen Long.An insight of ra⁃pamycin againstcadmium's neurotoxicity[J].Oncotar⁃get,2017,6:9013-9014.
[18]Lian S,Xia Y,Khoi P N,et al.Cadmium induces ma⁃trix metalloproteinase-9 expression via ROS-depen⁃dent EGFR,NF-κB,and AP-1 pathways in human endothelial cells[J].Toxicology,2015,338:104-116.
[19]Chen L,Xu B,Liu L,et al.Cadmium induction of re⁃ active oxygen speciesactivatesthe mTOR pathway, leading to neuronalcelldeath[J].Free Radic Biol Med,2011,50(5):624-632.
[20]Yuan Y,Wang Y,Hu F F,et al.Cadmium activates reactive oxygen species-dependent AKT/mTOR and mi⁃tochondrial apoptotic pathways in neuronal cells[J]. Biomed Environ Sci,2016,29(2):117-126.
[21]Wang J,Zhu H,Liu X,et al.N-acetylcysteine pro⁃tects against cadmium-induced oxidative stress in rat hepatocytes[J].J Vet Sci,2014,15(4):485.
[22]Person R J,Tokar E J,Xu Y,et al.Chronic cadmi⁃um exposure in vitro induces cancer cell characteris⁃tics in human lung cells[J].Toxicol Appl Pharmacol, 2013,273(2):281-288.
[23]Pannu V,Rida P C,Ogden A,et al.Induction of ro⁃bustde novo centrosome amplification,high-grade spindle multipolarity and metaphase catastrophe:a nov⁃el chemotherapeutic approach[J].Cell Death Dis,2012, 3:e346.
[24]Tarapore P,Fukasawa K.Loss of p53 and centrosome hyperamplification[J].Oncogene,2002,21(40):6234-6240.
[25]Patel D,Incassati A,Wang N,et al.Human papillo⁃mavirus type 16 E6 and E7 cause polyploidy in hu⁃man keratinocytes and up-regulation of G2-M-phase proteins[J].Cancer Res,2004,64(4):1299-1306.
[26]Zhang Ruikai,Wang Pu,Lu Yucheng,et al.Cadmium induces cell centrosome amplification via endoplasmic reticulum stress pathway:a functional proteomic study [J].Proteomics,2017,under revision.
[27]Filipic M,Fatur T,Vudrag M.Molecular mechanisms of cadmium induced mutagenicity[J].Hum Exp Toxi⁃col,2006,25(2):67-77.
