枸橼酸对内毒素刺激下单核细胞细胞因子分泌的影响
2018-04-09卢颖辉龚德华
周 蕾 卢颖辉 徐 斌 李 川 龚德华
局部枸橼酸抗凝(RCA)已成为连续性肾脏替代治疗(CRRT)的标准抗凝方式,尤其适用于存在活动性出血,肝素诱导的血小板减少症等系统性抗凝使用禁忌的患者中[1]。RCA通过在滤器前持续输入枸橼酸三钠(TSC)来螯合体外循环局部离子钙,达到阻断凝血瀑布目的从而发挥局部抗凝效应[2]。多项RCA与系统性肝素抗凝的临床随机对照试验证实,枸橼酸抗凝的有效性不亚于肝素或低分子肝素,且更安全,花费更少[3-4]。即使在肝脏衰竭的患者中,密切监测电解质和酸碱状态,使用局部枸橼酸抗凝也是安全可行的[5]。此外,我中心还提出了小剂量系统性抗凝结合枸橼酸抗凝的新方法,显示了更好的抗凝效果及安全性[6]。
目前已有研究报道RCA相比于肝素具有更好的生物相容性[7],除避免肝素相关的白细胞、血小板降低外,在体外循环局部可避免补体、白细胞、血小板等经过滤器时由于血膜反应导致的活化现象,从而改善生物相容性。这些优点可能与RCA改善重症患者的临床预后有关[3,8]。当然也有研究报道RCA与患者死亡风险增加相关[9]或并不降低死亡率[4,10]。在RCA中持续输入的枸橼酸根,除部分经体外循环清除外,其余进入体内,主要经肝脏及骨骼肌代谢为碳酸氢根[11]。根据稳态浓度(Css)公式Css=G/K(G为生成速率,K为清除率)可知,持续输入必然导致体内Css升高。有研究证实,RCA时外周血血浆中枸橼酸浓度升高至0.3~1.0 mmol/L[12],出现蓄积时更高。既往研究已证实体外循环局部枸橼酸浓度升高可明显影响免疫细胞功能,而体内浓度的升高,特别是长时CRRT时的持续升高对免疫细胞功能的影响,也是值得关注的问题。因此本研究通过体外细胞培养,模拟CRRT时体内枸橼酸环境,观察不同浓度枸橼酸对内毒素刺激的体外培养单核细胞分泌细胞因子功能的影响。
材料和方法
细胞培养人类单核细胞(白血病细胞系THP-1,由中国科学院上海细胞库提供), 10%胎牛血清,1%双抗(青霉素和链霉素)的1640培养基(美国GIBCO)培养(37℃恒温培养,5%CO2)。
在正常的培养条件下加入TSC至培养基中TSC浓度分别为0,0.5 mmol/L、1.0 mmol/L及2.5 mmol/L,通过血气分析仪(美国Radiometer)检测培养基中Ca2+离子浓度。给予细胞不同浓度内毒素(LPS,美国Sigma,L6529-1MG)0.05 μg/ml、0.1 μg/ml、1 μg/ml刺激,培养到预定时间(6h、12h、24h、48h)后,使用CCK-8试剂盒(中国 碧云天)测定细胞活性;并在培养基枸橼酸浓度为0,0.5 mmol/L、1.0 mmol/L条件下,用ELISA试剂盒(美国R&D System)测定分泌的细胞因子白细胞介素6(IL-6)和肿瘤坏死因子α(TNF-α)水平。
细胞活性实验在96孔板中加入100 μl(约1×104)的THP-1细胞悬液,将培养板置于培养箱中预培养24h。细胞培养液中含不同浓度的枸橼酸钠,并同时加入不同浓度的LPS刺激后,每孔加入培养基总体积10%的CCK 液。继续培养1~4h,用酶标仪测定450 nm处的吸光值,分析数据。
细胞因子测定待细胞生长状态良好,将细胞转至无血清培养基,种至96孔板中。按以下方法收集细胞:分别于 6h、12h、24h、48h四个时间点,收取不同浓度LPS刺激的不同TSC浓度培养液中的细胞,每组三个复孔。收得的细胞1 000 rpm/min离心5 mins,收取上清液。取得的上清按照ELISA试剂盒说明书分别测定IL-6,TNF-α浓度。
统计分析采用SPSS 21.0软件进行数据分析。数据采用均数±标准差表示,细胞因子浓度两组之间的差异用独立样本采用t检验分析,细胞活性及钙离子浓度的组间差异用单向方差分析,P<0.05为差异有统计学意义。
结 果
枸橼酸、LPS对单核细胞活性的影响将THP-1细胞置于TSC浓度分别为0、0.5 mmol/L、1.0 mmol/L和2.5 mmol/L的培养液中培养,对应的培养基钙浓度分别为0.465±0.013 mmol/L、0.245±0.017 mmol/L、0.21±0.017 mmol/L和0.18±0.014 mmol/L(P<0.01),细胞活性并未受到抑制,在24h时,TSC浓度为2.5 mmol/L的培养液中,细胞活性明显增强(图1A)。同时检测THP-1细胞在浓度0、0.05 μg/ml、0.1 μg/ml、1 μg/ml的LPS刺激下的细胞活性,结果显示,24h时,0.05 μg/ml浓度刺激组与其他组相比,细胞活性明显增强(图1B)。
枸橼酸对单核细胞分泌功能的影响在LPS浓度为0.05 μg/ml、0.1 μg/ml刺激时,THP-1细胞TNF-α的分泌量都较低,且不同TSC浓度组之间无差异;在LPS浓度为1 μg/ml培养6h,TNF-α的分泌量显著升高,随着培养时间延长,TNF-α的分泌呈现出下降的趋势。在时间点6h,所有加TSC培养细胞分泌量显著低于对照组(不含TSC);时间点12h,TSC浓度为0.5、1 mmol/L的培养细胞分泌量显著高于对照组(P<0.01);在时间点24h, TSC 1 mmol/L的培养细胞仍显著高于对照组(P<0.01),TSC 0.5 mmol/L组略高于对照组;在时间点48h,TSC 1 mmol/L的培养细胞明显高于对照组(P<0.05),TSC 0.5 mmol/L则与对照组无明显差异(图2A)。
含与不含TSC的培养THP-1细胞在受到不同浓度(0.05 μg/ml、0.1 μg/ml、1 μg/ml)LPS刺激时,IL-6的分泌表现出相同趋势,即在第6h开始升高,且随着培养时间的延长而增加;但TSC浓度不同,IL-6上升幅度存在显著差异。TSC浓度0.5 mmol/L时,在浓度分别为0.05 μg/ml、0.1 μg/ml的LPS刺激下,IL-6分泌在24h开始出现增高趋势,且48h分泌显著高于对照组(不含TSC),在1 μg/ml的LPS刺激下,IL-6的分泌自12h开始明显增高(P<0.05), 24h分泌量显著高于对照组(P<0.01);而TSC浓度为1 mmol/L时,在不同浓度LPS刺激下,除LPS 0.1 μg/ml组的6h时间点外,其他各时间点IL-6分泌量都显著低于对照组(P<0.01,图2B~D)。
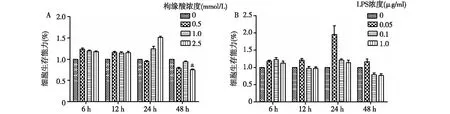
图1 A: 不同枸橼酸钠浓度的培养基对人类单核细胞株(THP-1)活性的影响,以枸橼酸钠浓度为0的作为对照组,a:枸橼酸浓度为2.5 mmol/L时,不同时间点间细胞活性有统计学差异(P<0.05);B: 不同浓度的内毒素(LPS)刺激细胞对THP-1活性的影响,以LPS浓度为0作为对照组;a:LPS浓度为0.05 μg/ml时,不同时间点间细胞活性有统计学差异(P<0.05)
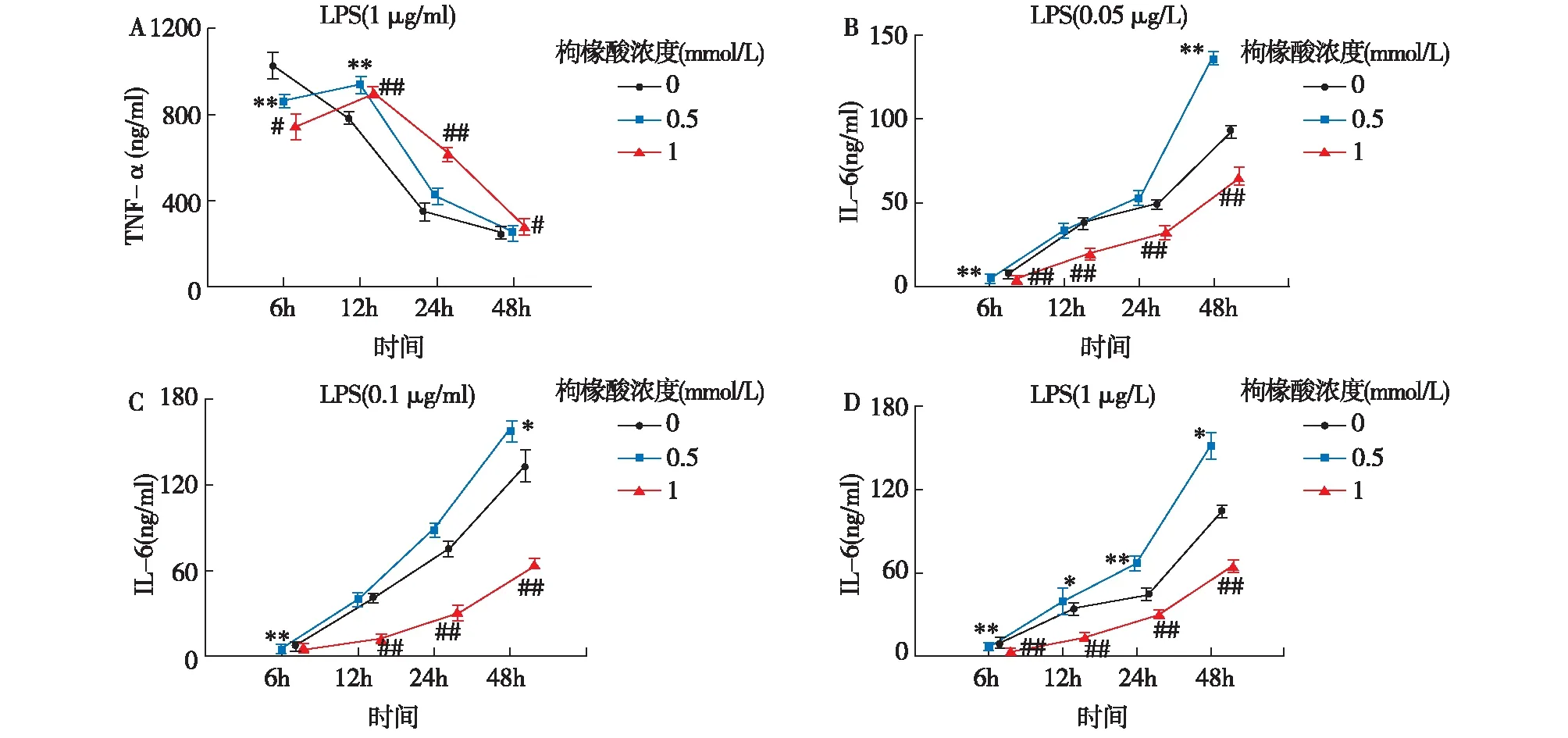
图2 肿瘤坏死因子α(TNF-α)和白细胞介素6(IL-6)分泌趋势在0、0.5 mmol/L及1 mmol/L枸橼酸钠培养条件下,用内毒素(LPS)刺激单核细胞,横坐标为培养时间(h),纵坐标为所分泌的细胞因子浓度;A:1 μg/ml LPS刺激下TNF-α的分泌状况;B、C、D:分别为0.05 μg/ml、0.1 μg/ml、1 μg/ml LPS浓度刺激下IL-6分泌状况。以枸橼酸浓度为0做为对照组,0.5 mmol/L组与对照组有差异(*:P<0.05,**:P<0.01);1 mmol/L组与对照组有差异(#:P<0.05,##:P<0.01)
讨 论
体外循环局部即刻性高浓度枸橼酸根对局部白细胞、血小板及补体激活的抑制作用已被证实,临床表现为透析膜生物相容性的改善[7],中性粒细胞[13-14]及血小板脱颗粒减少,氧化应激[14]等炎症反应降低。而本研究则采用体外细胞培养的方法证实低浓度枸橼酸根长时暴露对免疫细胞活化亦会产生一定影响。总体来看,TSC浓度较低时(0.5 mmol/L),表现为单核细胞激活时促炎细胞因子分泌的相对亢进,在更高浓度(1 mmol/L)时,则表现为促炎细胞因子(IL-6)分泌的相对抑制,而TNF-α的分泌仍相对亢进,但文献中证实更高浓度(≥2.75 mmol/L)TSC对细胞因子TNF-α的分泌有抑制作用[15-16]。这一结果有一定临床意义,因为在采用RCA抗凝的CRRT中,一般体内循环血浆中枸橼酸浓度将持续升高至0.3~1.0 mmol/L[12],甚至蓄积时出现>1 mmol/L的情况。部分临床研究观察到枸橼酸抗凝患者预后反不及肝素抗凝组[9],这可能是其中原因之一。此外,我们的结果也证实不管浓度高低,长时间枸橼酸根暴露并不降低细胞活性,说明它并无细胞毒性。本研究结果与Ashbrook等[15]的结果相似,即低浓度时TNF-α表达增加。他们验证的低浓度为1 mmol/L,在浓度高至6 mmol/L时,TNF-α的表达抑制。Karin Strobl 等[16]的研究中,枸橼酸高浓度(2.75~6.5 mmol/L)情况下LPS刺激下细胞因子分泌IL-1β,IL-6、IL-8、TNF-α均受到不同程度的抑制,亦与本实验结果类似。需注意的是,以上两实验中均只观察了单一时间点的情况,而本实验则进一步证实了长时暴露对活化状态下细胞因子分泌状况的影响。
枸橼酸根对单核细胞功能的影响具体作用机制目前还并不清楚。由于它最直接的效应是螯合钙降低循环中离子钙水平,这是其抗凝作用机制,也可能是其高浓度下对免疫细胞活化抑制的途径。在体外循环局部,枸橼酸浓度可达4~6 mmol/L,离子钙水平维持在0.25~0.35 mmol/L。而离子钙是几乎所有真核细胞中的第二信使,包括免疫细胞。免疫细胞激活,包括中性粒细胞和单核/巨噬细胞的分泌功能、吞噬作用和氧化呼吸爆发功能等[17]都依赖细胞外离子钙向胞浆内流来实现。当细胞外离子钙水平被降至很低情况下,细胞钙的内流必然也会被抑制,从而其活化后的功能状态受到抑制。这一点已有研究支持。在上文所提到的高浓度枸橼酸抑制单核细胞受LPS刺激后分泌细胞因子实验中,当离子钙水平纠正后这种抑制效应亦消失,从而证实了高浓度情况下通过降低离子钙而起抑制细胞功能作用。这也可能是上文提及的体外循环局部即刻性高浓度枸橼酸根抑制白细胞、血小板及补体激活效应的作用机制。
但本文所观察到的低浓度情况下枸橼酸表现出对单核细胞活化时分泌功能的促进作用并不能用离子钙水平的降低来解释,因为后者只可能抑制细胞分泌功能。其实,枸橼酸作为细胞能量代谢的一种中间物质,还参与了炎症、癌症、胰岛素的分泌、组蛋白的乙酰化、神经系统疾病、非酒精性脂肪肝的病理生理过程[18]。研究表明,LPS刺激可诱导单核/巨噬细胞内生成糖酵解相关酶,出现类似于瓦博格效应[19](Warburg effect,即在肿瘤细胞中发现的一种需氧的糖酵解现象[20])。这种反应与正常情况下细胞糖分解的三羧酸循环(TCA)产生能量以供给细胞功能需求不同的是,更多为满足生物合成的需求,即炎性细胞因子的合成。同时正常TCA被中断,即柠檬酸(即枸橼酸)无法进一步生成异柠檬酸及α-酮戊二酸,从而导致线粒体内柠檬酸水平升高。而线粒体上的柠檬酸载体(CIC)[21]则将柠檬酸转运至胞浆中,并被胞浆中ATP柠檬酸裂解酶(ACLY)[22]分解为草酰乙酸及乙酰COA,前者提供NADPH+H+,是一氧化氮(NO),活性氧(ROS)等炎症介质合成的原料,后者则为脂肪酸的合成提供原料,并进一步生成前列腺素(PGs),同时乙酰基促进组蛋白的乙酰化水平并调节炎症因子的转录。目前已有的证据包括,在LPS刺激下巨噬细胞胞质枸橼酸水平明显升高,阻断CIC可降低胞质水平及抑制NO及ROS产生,抑制ACLY亦可降低NO及ROS产生[21-22]。Ashbrook等[15]的研究指出细胞内枸橼酸通过上述代谢途径在LPS诱导炎症反应(如TNF-α的分泌)中作用的重要性可能远超过离子钙的作用。在体内环境中,胞质内的枸橼酸除了通过CIC从线粒体转运而来外,还可通过细胞膜上的柠檬酸转运体(PMCTs)从细胞外转运而来[23]。因此,完全有理由相信,本实验中低浓度枸橼酸培养情况下,单核细胞活化时细胞因子分泌亢进现象可能是细胞外枸橼酸进入细胞内并通过上述途径所致。而只有当细胞外枸橼酸浓度过高导致离子钙水平极低情况下,才可能导致钙内流抑制并进而影响细胞因子分泌,这一点已在前文提及的研究中证实[15-16]。
还有研究证实,三羧酸循环的重要中枢——琥珀酸脱氢酶(SDH),其活性增强加速琥珀酸氧化也是LPS促进单核细胞对炎症反应的关键[24]。本研究通过检测试剂盒中化学物质(WST-8)在细胞内线粒体中SDH还原下的产物来评估细胞活性,因此干扰参与三羧酸循环的任何环节的因素如外源性枸橼酸及LPS的刺激都可能对细胞活性的测量造成影响。在细胞培养后24h可观察到高浓度TSC培养或者低浓度LPS刺激下细胞活性均增高,我们推测与此时间点线粒体内SDH活性增强相关,由于没有更密切地监测24~48h内细胞活性的变化,对于不同浓度TSC及LPS对单核细胞活性随时间变化的影响需要进一步的探究。
本研究采用了与临床CRRT应用RCA时体内枸橼酸水平相近的浓度,观察到了单核细胞在此环境下,受LPS刺激时表现出炎性细胞因子分泌亢进的现象。这一点提示我们,在以往所观察到的RCA所带来的益处,包括抗凝有效性、安全性及体外循环生物相容性改善之外,还需注意其可能带来的不利影响,比如可能的促炎作用,特别是长时暴露情况下。其他可能不利之处还包括通过络合可能促进原本与蛋白结合的微量元素通过CRRT丢失。当然,本实验存在很多不足之处。本实验均于细胞标准培养液(1640培养液,Ca2+浓度为0.465±0.013 mmol/L)的条件下进行,未检测在校正细胞外离子钙水平后的细胞因子分泌功能,也未就影响细胞因子分泌的可能机制进行深入研究;同时仅观察了两种具有代表性的炎性细胞因子,并不清楚对其他细胞因子分泌的影响。上述问题有待今后进一步的研究来证实。
1Section 5:Dialysis Interventions for Treatment of AKI.Kidney Int Suppl(2011),2012,2(1):89-115.
2Engstad CS,Gutteberg TJ,Osterud B.Modulation of blood cell activation by four commonly used anticoagulants.Thromb Haemost,1997,77(4):690-696.
3Oudemans-van SHM,Bosman RJ,Koopmans M,et al.Citrate anticoagulation for continuous venovenous hemofiltration.Crit Care Med,2009,37(2):545-552.
4Hetzel GR,Schmitz M,Wissing H,et al.Regional citrate versus systemic heparin for anticoagulation in critically ill patients on continuous venovenous haemofiltration:a prospective randomized multicentre trial.Nephrol Dial Transplant,2011,26(1):232-239.
5Slowinski T,Morgera S,Joannidis M,et al.Safety and efficacy of regional citrate anticoagulation in continuous venovenous hemodialysis in the presence of liver failure:the Liver Citrate Anticoagulation Threshold (L-CAT) observational study.Crit Care,2015,19:349.
6Wu B,Zhang K,Xu B,et al.Randomized Controlled Trial to Evaluate Regional Citrate Anticoagulation Plus Low-Dose of Dalteparin in Continuous Veno-Venous Hemofiltration.Blood Purif,2015,39(4):306-312.
7Böhler J,Schollmeyer P,Dressel B,et al.Reduction of granulocyte activation during hemodialysis with regional citrate anticoagulation:dissociation of complement activation and neutropenia from neutrophil degranulation.J Am Soc Nephrol,1996,7(2):234-241.
8Tiranathanagul K,Jearnsujitwimol O,Susantitaphong P,et al.Regional citrate anticoagulation reduces polymorphonuclear cell degranulation in critically ill patients treated with continuous venovenous hemofiltration.Ther Apher Dial,2011,15(6):556-564.
9Link A,Klingele M,Speer T,et al.Total-to-ionized calcium ratio predicts mortality in continuous renal replacement therapy with citrate anticoagulation in critically ill patients.Crit Care,2012,16(3):R97.
10 Schilder L,Nurmohamed SA,Bosch FH,et al.Citrate anticoagulation versus systemic heparinisation in continuous venovenous hemofiltration in critically ill patients with acute kidney injury:a multi-center randomized clinical trial.Crit Care,2014,18(4):472.
11 Kramer L,Bauer E,Joukhadar C,et al.Citrate pharmacokinetics and metabolism in cirrhotic and noncirrhotic critically ill patients.Crit Care Med,2003,31(10):2450-2455.
12 Chadha V,Garg U,Warady BA,et al.Citrate clearance in children receiving continuous venovenous renal replacement therapy.Pediatr Nephrol,2002,17(10):819-824.
13 Bos JC,Grooteman MP,van Houte AJ,et al.Low polymorphonuclear cell degranulation during citrate anticoagulation:a comparison between citrate and heparin dialysis.Nephrol Dial Transplant,1997,12(7):1387-1393.
14 Gritters M,Grooteman MP,Schoorl M,et al.Citrate anticoagulation abolishes degranulation of polymorphonuclear cells and platelets and reduces oxidative stress during haemodialysis.Nephrol Dial Transplant,2006,21(1):153-159.
15 Ashbrook MJ,McDonough KL,Pituch JJ,et al.Citrate modulates lipopolysaccharide-induced monocyte inflammatory responses.Clin Exp Immunol,2015,180(3):520-530.
16 Strobl K,Harm S,Weber V,et al.The role of ionized calcium and magnesium in regional citrate anticoagulation and its impact on inflammatory parameters.Int J Artif Organs,2017,40(1):15-21.
17 Feske S.Calcium signalling in lymphocyte activation and disease.Nat Rev Immunol,2007,7(9):690-702.
18 Iacobazzi V,Infantino V.Citrate--new functions for an old metabolite.Biol Chem,2014,395(4):387-399.
19 O′Neill LA.A critical role for citrate metabolism in LPS signalling.Biochem J,2011,438(3):e5-6.
20 WEINHOUSE S.On respiratory impairment in cancer cells.Science,1956,124(3215):267-269.
21 Infantino V,Convertini P,Cucci L,et al.The mitochondrial citrate carrier:a new player in inflammation.Biochem J,2011,438(3):433-436.
22 Infantino V,Iacobazzi V,Palmieri F,et al.ATP-citrate lyase is essential for macrophage inflammatory response.Biochem Biophys Res Commun,2013,440(1):105-111.
23 Sun J,Aluvila S,Kotaria R,et al.Mitochondrial and Plasma Membrane Citrate Transporters:Discovery of Selective Inhibitors and Application to Structure/Function Analysis.Mol Cell Pharmacol,2010,2(3):101-110.
24 Mills EL,Kelly B,Logan A,Succinate Dehydrogenase Supports Metabolic Repurposing of Mitochondria to Drive Inflammatory Macrophages.Cell,2016,167(2):457-470.e13.
