利用3D打印高通量观察斑马鱼肾小球滤过膜损伤
2018-04-09陈朝红张利文秦卫松刘志红
陈朝红 张利文 侯 庆 汪 玲 李 知 秦卫松 刘志红
模式动物斑马鱼已广泛应用于肾脏疾病研究[1-2]。斑马鱼体型小,产卵量大,生长快,适合高通量基因功能筛查和药物筛选[3-4]。
斑马鱼肾小球足细胞损伤和滤过膜破坏通常表现为眶周和心包水肿,蛋白尿等[5]。蛋白尿常采用荧光排出实验检测[6]。上述表型需要从斑马鱼的背位(dorsal view)或侧方位(lateral view)观察拍照,但斑马鱼作为活体动物,悬浮在水中,难以固定其体位,观察拍照需要花费大量的时间。目前多是将斑马鱼置于硝酸纤维素和甘油等具有黏性的液体中摆位定向,或置于低熔点琼脂中,进行观察和拍照[7]。Petzold等[8]将斑马鱼胚胎置于含甘油的氟化毛细管中,矫正光学折射效应,通过旋转毛细管,可对胚胎进行360度拍照。但上述方法难以满足高通量筛查的需要,且硝酸纤维素和甘油等易造成斑马鱼胚胎脱水,对鱼体造成损伤。近年来,3D打印已应用于模型制作,缩短了产品开发周期,且制造成本低[9]。我们利用3D打印机制造斑马鱼胚胎定位工具,该工具兼容96孔微孔板和100 mm平皿,使斑马鱼胚胎的背位和侧位定向准确易行,便于显微镜电动平台自动成像。我们利用该工具对斑马鱼足细胞特异性损伤模型的水肿比例和严重程度,蛋白尿进行了定量分析。
材料与方法
斑马鱼的饲养和繁殖根据Westerfield的方法[7]斑马鱼饲养于28.5℃的水温环境中,照明14h与黑暗10h交替,雌雄两组分开孵育,每天定时喂鱼饵外加丰年虫(Artemien,Salina),至发育可以产卵后,将一雌一雄放在有孵箱的水族箱内,次日产卵。受精卵于培养液28.5℃孵化,每日更换培养液。胚胎发育超过24 h,培养液中需添加0.003% 苯硫脲(PTU),用以防止黑色素生成影响观察。
足细胞特异性损伤转基因斑马鱼模型表型观察建立足细胞特异性表达硝基还原酶(NTR)的转基因斑马鱼[10],NTR可将甲硝唑(MTZ)的硝基还原成为活性氮等细胞毒性物质,在转基因斑马鱼的胚胎养殖水中加入MTZ,可特异性诱导足细胞损伤,导致水肿和蛋白尿[10]。将Tg(pod:Gal4;UAS:NTR-mCherry)与野生型杂交,得到的后代孵育至第3天(days post fertilization,3 dpf),于荧光显微镜下筛选出肾脏表达红色荧光的幼鱼用于实验,以野生型作为对照组。将MTZ用E3溶液(5.0 mmol/L NaCl、0.17 mmol/L KCl,0.33 mmol/L CaCl2,0.33 mmol/L MgSO4)稀释至100 μmol/L 处理斑马鱼胚胎,在5 dpf后观察胚胎表型。使用瞳孔距离(pupil spacing distance,PS)和幼体体长(body length,BL)的比例(PS/BL)定量分析眶周水肿的严重程度。
眼球荧光检测[6]5 dpf的斑马鱼幼鱼以三卡因(tricaine)麻醉后,通过心脏静脉窦注射1 mg/ml 70 kD FITC-dextran(Thermo)溶液2 ml,注射后0h和12h后在倒置显微镜下采集斑马鱼视网膜血管丛拍照,并用NIH ImageJ program软件对斑马鱼瞳孔绿色荧光进行分析。斑马鱼视网膜血管丛最为丰富,肾小球滤过功能正常时,眼球区域可检测到及其丰富的绿色荧光,肾小球滤过膜受损时,斑马鱼循环70 kD FITC-dextran排出增加,眼球区域绿色荧光相比正常组荧光值下降。
3D模型的设计和打印应用OpenSCAD软件设计3D模型(图1)(南京恒宇三维技术开发有限公司)。将STL格式的模型文件导入3D打印机(美国3D Systems公司,Object 500))切片软件中开始打印,打印材料为丙烯腈-丁二烯-苯乙烯(ABS)。设置模型的打印参数:打印基板(baseplate)时选择标准模式(Standard),填充率设为10%,壳壁数设为2,层高设为0.20 mm,喷头温度设为190℃。打印梳齿(stripes)时选择高清模式(high),填充率设为15%,壳壁数设为4,层高设为0.10 mm,喷头温度设为190℃(图2)。
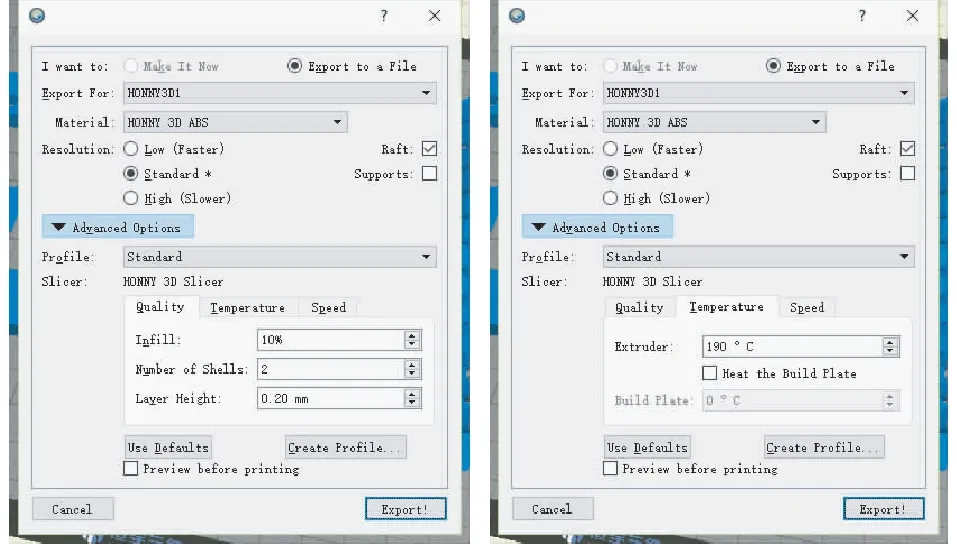
图2 3D打印机参数设置
配制琼脂胶包被的微孔板和平皿用E3缓冲液配制1%琼脂凝胶,胶热熔后用多道移液枪加50 μl于96孔板中,或加30 ml于15 mm培养皿中,将3D打印的模具插入凝胶中,模具的基板起支撑作用。待琼脂凝胶固化后,将模具小心拔出。
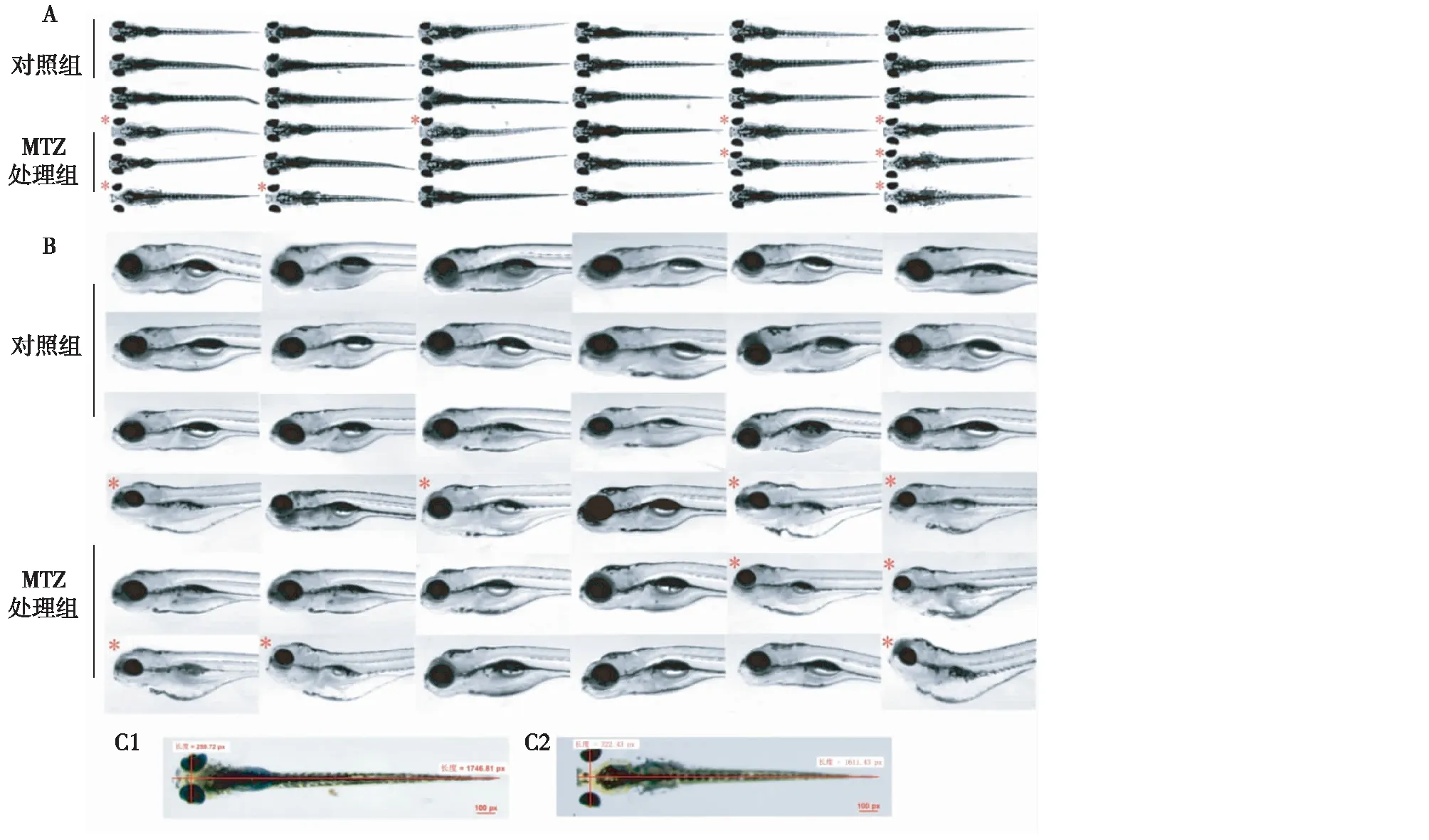
图3 应用3D打印的定位工具获取甲硝唑(MTZ)诱导斑马鱼足细胞损伤后水肿数据A,B: 体式显微镜下观察5 dpf斑马鱼幼鱼经MTZ或溶剂对照处理后形态,所示图像截取于定位工具产生的96孔板琼脂凝胶凹槽腔内幼鱼的背位(A)和侧位(B)图像,(*)标志的幼鱼具有明显的水肿;C: 幼鱼背位测量水肿程度的示意图,红线表示瞳孔间距(PS)和体长(BL),C1为正常幼鱼,C2为有水肿的幼鱼
斑马鱼胚胎成像将5 dpf斑马鱼胚胎用0.03%间氨基苯甲酸乙酯(tricaine)麻醉后用吸管转移到微孔板的孔中或平皿中,在体式显微镜下(Nikon SMZ25)用镊子尖端将胚胎排列和定位。利用配备电动平台体式显微镜多点成像和自动对焦功能获取多孔板内的斑马鱼图像,定义行数和列数(96孔板:12×6, 微孔板:8×6),以及起始和终止位置,自动多点拍摄成像。
结 果
斑马鱼的定位工具设计我们打印的模具包括基板和梳齿样长条,基板支撑梳条,可将其固定于96孔板或平皿上。梳齿顶端变细,根据鱼体和卵黄囊的大小,顶端的几何形状有差异(图1B、C),适应于斑马鱼幼鱼以侧位或背位的体位摆放。梳条插入孔板的液体琼脂内,当琼脂固化后可方便地取出模具,在琼脂凝胶内形成成行和成列的凹槽空腔。胚胎被吸移到琼脂制成的模具凹槽中,模具的宽度和设计确保胚胎可自动对齐(图3~4),一次排列48或96个斑马鱼胚胎样本。为利用斑马鱼进行高通量表型筛查和药物筛选提供了有利的工具。
利用3D打印工具高通量观察斑马鱼滤过膜损伤后水肿表型斑马鱼肾脏损伤的表现为眶周水肿(背位观察,图3A),心脏和卵黄囊水肿(侧位观察,图3B),瞳孔间距(PS)与体长(BL)的比值代表水肿的严重程度(图3C)[11]。我们利用3D打印的定位工具,观察了MTZ对足细胞过表达硝基还原酶的转基因斑马鱼的损伤并拍照,计算水肿率,定量水肿严重程度。结果显示,将Tg(pod:Gal4;UAS:NTR-mCherry)胚胎暴露于120 μmol/L MTZ 48h后,斑马鱼胚胎出现眶周水肿,心脏和卵黄囊水肿,水肿率达52.5±18.4%(n=30),PS/BL比值为0.201±0.032(n=30),较正常对照组0.149±0.008(n=30)显著升高。
检测肾小球滤过膜通透性肾小球滤过屏障受损后,高分子量葡聚糖(MW>70 kD)能从脉管系统中较快地排出。因此,我们将荧光FITC标记的70 kD葡聚糖注射到斑马鱼胚胎血管中。在基线和12h后,观察眼球视网膜血管床上的荧光强度,并对眼球进行拍照。结果显示,MTZ处理足细胞特异性表达NTR的转基因鱼,与溶剂对照组相比,MTZ处理12h后斑马鱼幼鱼视网膜血管床荧光强度明显降低(图4,*号标志),相对于基线水平的荧光强度变化显著增加,显示足细胞损伤后幼鱼对高分子葡聚糖的清除增加。
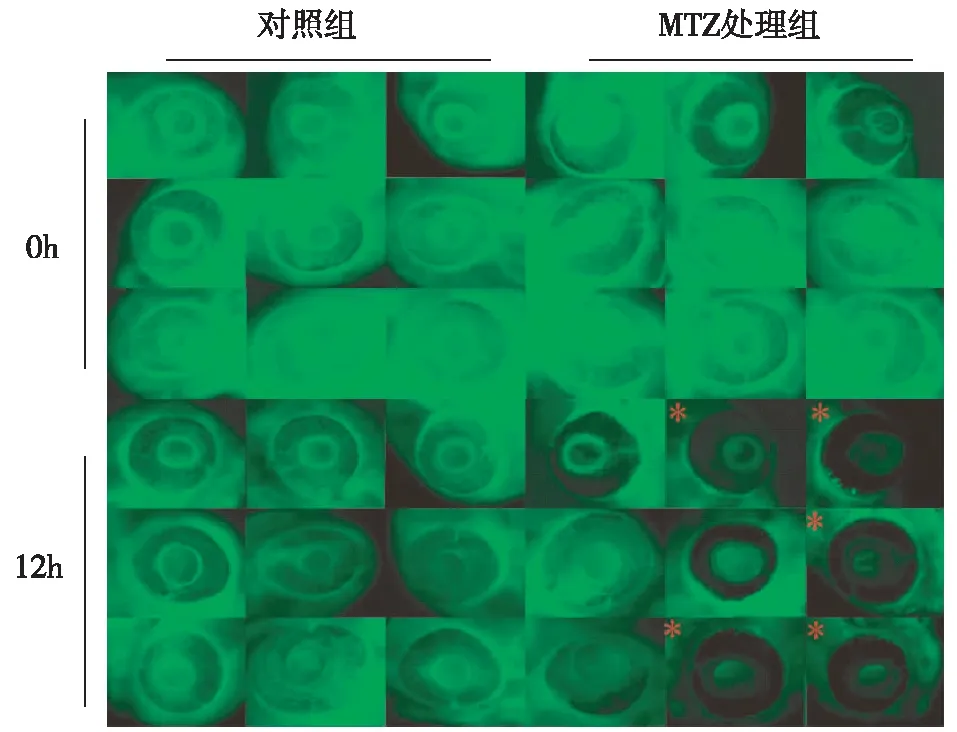
图4 应用3D打印的定位工具获取甲硝唑(MTZ)诱导足细胞损伤后斑马鱼的荧光排出率用MTZ或溶剂对照处理转基因幼鱼pod:Gal4;UAS:NTR-mCherry,后注射70 kDa FITC标记的葡聚糖,所示图像为荧光标记高分子注射前(0h)和注射后12h部分斑马鱼眼球图像,(*)标志幼鱼视网膜血管床荧光强度明显降低,显示肾小球滤过膜对大分子清除增加
讨 论
通过自动显微镜获取斑马鱼胚胎和幼鱼的表型图像是研究脊椎动物体内复杂生物过程的有效方法,应用于遗传、药物和毒物筛选等[12]。无论成像方式如何,鱼体复杂的三维形状引起的样本取向不一致会导致成像困难。所以,一致和可重复的定位是大多数研究中获得图像数据进行定量和比较分析的先决条件。为了解决这一问题,研究人员开发了多种方法和工具,有助于斑马鱼胚胎和幼鱼的体位固定。Megason等[13]利用数控铣床,用500 μm钻头在有机玻璃上打造凸槽制成模具,凸槽的形状与幼鱼侧位或背位的平面投影一致,利用该模具在琼脂凝胶中形成胚形孔(embryo shapedwells),一次可排列18个幼鱼阵列(embryo arrays)。Westhoff等[14]用黄铜制成含96个垂直针脚(perpendicular pins)的基板,针脚排列方式与96孔板的孔眼一致。该工具由数控铣床生产,先将尺寸为140 mm×100 mm×21 mm的黄铜基板用20 mm四刃立铣刀(four flute end mill)研磨。然后按照垂直针角的排列方式,用6 mm和3 mm四刃立铣刀将针脚之间的铜基板打薄到9 mm,形成5.9 mm×1 mm×11 mm的96针矩形阵列,最后,通过刻刀工具将96针的顶端雕刻成60°斜角的锥形尖端,将该模具插入96孔板中的琼脂凝胶中,可形成V型龙骨样腔室,便于鱼体的定位。研究人员利用该工具观察了庆大霉素、卡那霉素、卡托普利、氯沙坦及吲哚美辛钠等8种常用药物对斑马鱼前肾发育的影响,通过获得定位一致的图像数据,对前肾病变的形态学变化(如水肿率,肾小球融合程度和肾小球畸形率)进行定量分析,揭示了几种化合物对肾脏发育的浓度依赖性影响。
上述幼鱼定位方法与最初使用的低熔点琼脂或硝酸纤维素定位方法相比,效率大大提高,但上述模具均为自制品,并未商品化,复制成本相对较高,需在具有加工能力的车间生产,在生物实验室应用较为困难。随着科技的发展,3D打印已应用于模具生成,结合开源计算机辅助设计(Computer Aided Design,CAD)软件,可制造几何形状任意复杂的零件,适合于单件或者小批量模型的制作,开发成本低廉[15-16]。
我们已建立靶向足细胞损伤的斑马鱼模型Tg(pod:Gal4;UAS:NTR-mCherry),足细胞特异性表达NTR,NTR可将MTZ的硝基还原成为活性氮等细胞毒性物质,在转基因斑马鱼的胚胎养殖水中加入MTZ,可特异性诱导足细胞损伤,导致水肿和蛋白尿出现,但水肿的严重程度定量和蛋白尿的定量非常耗时耗力。我们利用3D打印的模具在96孔板或平皿中的琼脂凝胶中形成狭小的微腔,结合自动化成像,一次能够获取48个或96个斑马鱼幼鱼一致的背位或侧位视图。观察了肾毒性药物对斑马鱼幼鱼肾小球滤过功能的影响,高通量分析斑马鱼水肿率和蛋白尿表型,精确稳定的定位提高了瞳孔间距和体长测量的准确度和效率。本研究结果表明,3D打印可制造斑马鱼研究工具,3D打印模具较铜板模具开发成本和制作成本低廉,生产周期快,适于实验室应用。能够促进斑马鱼形态学表型的比较及定量分析,助力自动化获取报告基因表达模式的数据,是利用斑马鱼进行高通量表型筛查和药物筛选的有效工具。
1Jerman S,Sun Z.Using Zebrafish to Study Kidney Development and Disease.Curr Top Dev Biol,2017,124:41-79.
2陈朝红,刘志红.模式动物斑马鱼在肾脏疾病研究中的应用.肾脏病透析与肾移植杂志2016,25(2):159-164.
3Gut P,Reischauer S,DYR S,et al.LITTLE FISH,BIG DATA:ZEBRAFISH AS A MODEL FOR CARDIOVASCULAR AND METABOLIC DISEASE.Physiol Rev,2017,97(3):889-938.
4Saydmohammed M,Tsang M.High-Throughput Automated Chemical Screens in Zebrafish.Methods Mol Biol,2018,1683:383-393.
5Chen Z,Wan X,Hou Q,et al.GADD45B mediates podocyte injury in zebrafish by activating the ROS-GADD45B-p38 pathway.Cell Death Dis,2016,7:e2068.
6Hanke N,King BL,Vaske B,et al.A Fluorescence-Based Assay for Proteinuria Screening in Larval Zebrafish (Danio rerio).Zebrafish,2015,12(5):372-376.
7Westerfield M:The zebrafish book.A guide for the laboratory use of zebrafish (Danio rerio).4th edition.,vol.2000.Eugene:Univ of Oregon Press; 2000.
8Petzold AM,Bedell VM,Boczek NJ,et al.S SCORE imaging:specimen in a corrected optical rotational enclosure.Zebrafish,2010,7(2):149-154.
9FDS B,Diegel O,Pereira N,et al.Cell immobilization on 3D-printed matrices:A model study on propionic acid fermentation.Bioresour Technol,2017,249:777-782.
10 Zhou W,Hildebrandt F.Inducible podocyte injury and proteinuria in transgenic zebrafish.J Am Soc Nephrol,2012,23(6):1039-1047.
11 Wan X,Chen Z,Choi WI,et al.Loss of Epithelial Membrane Protein 2 Aggravates Podocyte Injury via Upregulation of Caveolin-1.J Am Soc Nephrol,2016,27(4):1066-1075.
12 Peravali R,Gehrig J,Giselbrecht S,et al.Automated feature detection and imaging for high-resolution screening of zebrafish embryos.Biotechniques,2011,50(5):319-324.
13 Megason SG.In toto imaging of embryogenesis with confocal time-lapse microscopy.Methods Mol Biol,2009,546:317-332.
14 Westhoff JH,Giselbrecht S,Schmidts M,et al.Development of an automated imaging pipeline for the analysis of the zebrafish larval kidney.PLoS One,2013,8(12):e82137.
15 Wittbrodt JN,Liebel U,Gehrig J.Generation of orientation tools for automated zebrafish screening assays using desktop 3D printing.BMC Biotechnol,2014,14:36.
16 Pearce JM.Materials science.Building research equipment with free,open-source hardware.Science,2012,337(6100):1303-1304.
