喉癌术后放化疗期间辅助应用华蟾素效果观察
2018-04-09陈艳红
陈艳红,赫 莉
(河北省邯郸市中心医院,河北 邯郸 056001)
喉鳞癌是头颈部常见的恶性肿瘤之一,其病因至今尚不清楚,可能与吸烟、癌前期病变、癌基因的激活和抗癌基因的失活等多种因素综合作用有关。目前对于早期患者喉癌多先行手术切除,术后辅助放疗、化疗及其他抗肿瘤的生物治疗,晚期患者或者因存在手术禁忌证而失去手术机会者则只能以放疗、化疗、抗肿瘤生物治疗等综合手段为主。但放化疗在杀死肿瘤细胞、抑制肿瘤生长繁殖的同时,也带来了恶心、呕吐、免疫力下降、骨髓抑制、肝肾损害等不良反应,严重影响喉癌患者的术后恢复,这是目前临床治疗中的一大难题。中医药是目前临床中普遍采用的辅助治疗肿瘤方法,其中华蟾素胶囊应用较为广泛。华蟾素胶囊是将干蟾皮中有效的脂溶性成分萃取提炼加工而成,具有消肿利水、活血溃坚化瘀、清热解毒等作用,可抑制肿瘤生长,提高机体免疫力[1]。本研究观察了喉癌术后放化疗同时辅用华蟾素胶囊对患者生存质量、疼痛情况及放化疗相关毒性的影响,旨在探讨该药用于喉癌患者的治疗意义。
1 临床资料
1.1一般资料选取2010年12月—2016年12月在本院耳鼻喉科行术后常规放化疗的喉癌患者65例,均由我院的病理医师确诊为喉部鳞状细胞癌,拟行部分/全喉切除+颈淋巴清扫术,术后TNM分期为T3/T4、N2/N3、M0;术后4周开始接受正规放疗,同时给予化疗至少2个周期;术前3个月内未行其他放、化疗及抗肿瘤的生物学治疗;治疗前卡氏评分≥70 分。 排除标准:正在使用其他同类药物治疗者; TNM分期为T1/T2、N1、M1者;治疗前卡氏评分<70分者;术前3个月内进行过其他放、化疗及抗肿瘤生物学治疗者;精神病或并发抑郁症者。将患者随机分为2组:治疗组35例,男32例,女3例;年龄43~76岁,平均62岁;高分化鳞癌9例,中分化鳞癌14例,低分化鳞癌12例;声门上型癌20例,声门型癌11例,声门下型癌4例。对照组30例,男29例,女1例;年龄43~75岁,平均61岁;高分化鳞癌6例,中分化鳞癌12例,低分化鳞癌12例;声门上型癌16例,声门型癌12例,声门下型癌2例。2组一般情况比较差异无统计学意义(P均>0.05),具有可比性。
1.2治疗方法对照组术后28 d左右开始给予正规放疗:根治性手术原发灶及手术区域DT 60 Gy,30次/6周,高危区域66 Gy,切缘不净DT 70 Gy。放疗期间同步化疗,给予TC方案:顺铂75~100 mg/m2静滴,第1天或分3 d;多西他赛60~75 mg/m2静滴,第1天。治疗组同时给予华蟾素胶囊3 粒/次口服,每天早、中、晚三餐后服用。2组均以21 d为1个治疗周期,连续治疗2个周期。
1.3观察指标
1.3.1生活质量按照功能状况的卡氏评分(Karnofsky)标准评定:正常无症状和体征记100分;症状或体征轻微,能够正常活动记90分;虽有症状或体征,但能够勉强正常活动记80分;生活能自理,但不能维持正常生活和工作记70分;虽有时需要帮助,但生活大部分能够自理记60分;常需要人照料记50分;需要别人的特殊照顾和帮助,生活无法自理记40分;生活严重不能自理记30分;需要住院并给予支持治疗的病重状态记20分;危重,临近死亡记10分;死亡记0分。卡氏评分增加不小于10分的情况为改善,分数减少不小于10分的情况为下降,分数介于两者之间的情况为稳定。
1.3.2疼痛分级按照世界卫生组织(WHO)疼痛程度分级划分为4个等级[2]进行评定。0级:无疼痛感;Ⅰ级(轻度疼痛):可以忍受的疼痛感,疼痛在平躺时消失,睡眠及正常生活不受影响;Ⅱ级(中度疼痛):无法忍受的疼痛感,疼痛在平躺时仍然存在,影响正常睡眠,需使用镇痛药物方能缓解;Ⅲ级(重度疼痛):不能忍受的剧烈疼痛,疼痛导致被动体位,可以伴有自主神经功能紊乱,严重影响睡眠及正常生活,迫切使用镇痛药物治疗。
1.3.3体质量变化治疗后体质量不下降或下降≤7%视为体质量下降不明显,一般提示预后好;治疗后体质量下降>7%视为体质量下降明显,提示预后较差。
1.3.4血液毒性反应参照 1979 年世界卫生组织抗癌药物急性及亚急性毒副反应分度标准对血液学毒性进行分度(0~Ⅳ度)[3]。实验分析根据血常规化验中的白细胞(WBC)、血红蛋白(Hb)及血小板(Plt)参数检测结果评价放、化疗的骨髓抑制情况,根据生化全项中谷丙转氨酶、肌酐、尿素等指标评价肝、肾功能损害情况,症状方面主要评估口腔黏膜损伤程度及恶心呕吐等不良反应。
1.4统计学方法采用SPSS 20.0统计软件进行统计学处理,计数资料比较采用2检验,P<0.05为差异有统计学意义。
2 结 果
2.12组治疗后卡氏评分变化情况比较治疗后治疗组卡氏评分增加及稳定者占74%(26/35),对照组占43%(13/30),2组比较差异有统计学意义(P<0.05)。见表1。

表1 2组治疗后卡氏评分情况比较 例
2.22组治疗后疼痛分级情况比较治疗组疼痛指数0~Ⅰ级者占91%(32/35),对照组为73%(22/30),2组比较差异有统计学意义(P<0.05)。见表2。

表2 2组治疗后疼痛分级情况比较 例
2.32组治疗后体质量下降情况比较治疗组治疗后体质量下降不明显25例,明显10例;对照组治疗后体质量下降不明显22例,明显8例。2组体质量下降情况比较差异无统计学意义(P>0.05)。
2.42组治疗后血液学毒性及不良反应发生情况比较治疗组口腔黏膜损害发生明显轻于对照组(P<0.05),2组WBC减少、HGB减低、Plt减少、肝肾功能损害及恶心呕吐发生情况比较差异均无统计学意义(P均>0.05)。见表3。
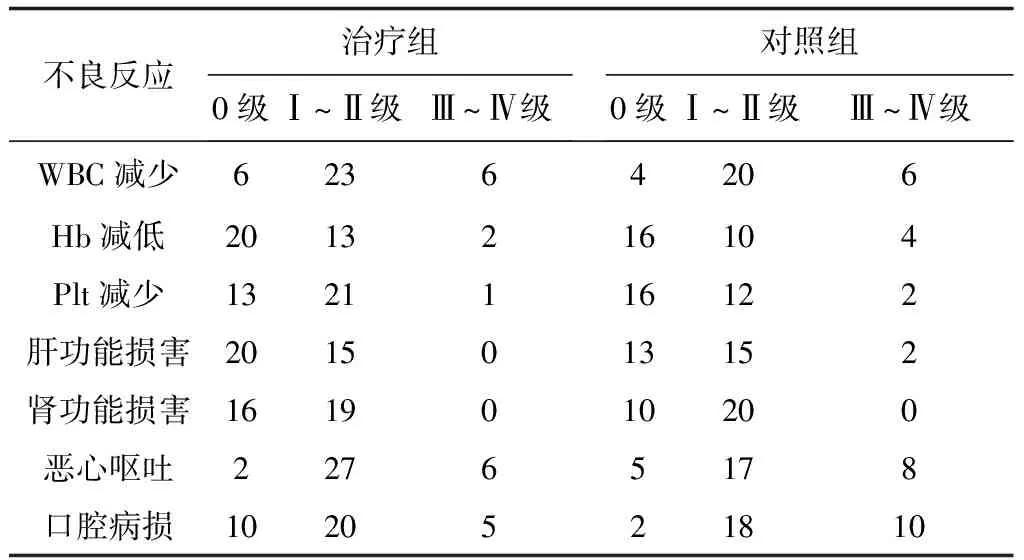
表3 2组治疗后血液学毒性及不良反应发生情况比较 例
3 讨 论
华蟾素作为药物治疗疾病,早在秦汉时期所著的《神农本草经》中就有详细记载,对于华蟾素的药性理论当时已有初步认识。现代科技利用中华大蟾蜍和黑框蟾蜍这两类蟾蜍科动物的全皮,经过一系列特殊方法提取加工,其中的蟾毒灵、脂蟾毒配基、华蟾酥毒基等是其起效的主要活性部分。现已证实华蟾素可以在抑制肿瘤细胞的生长、诱导其凋亡等多个方面发挥抗肿瘤作用,同时它还具有增强机体免疫力、消肿止痛等作用,具有不良反应小等优点。
在抗肿瘤方面,华蟾素起效的可能分子生物学机制是:①阻止肿瘤细胞增殖。肿瘤细胞的增殖离不开DNA的复制、转录和合成过程,所以抑制了DNA的合成就阻断了肿瘤细胞增殖的基础过程。通过对肝癌Bel-7402以及肝癌HepG-2细胞的实验证实,华蟾素可使Bel-7402的细胞周期停滞于G2/M期,从而抑制肝癌细胞的增殖,并且这种抑制效果在实验中呈现出明显的剂量-作用时间的依赖性。而在肝癌HepG-2中,华蟾素抑制细胞增殖的作用则是通过下调细胞周期蛋白依赖性激酶A、TopoⅠ、TopoⅡ的活性实现的,使HepG-2细胞周期阻滞于S期[4-5]。②诱导肿瘤细胞凋亡。肿瘤细胞的增殖、凋亡、分化失衡造成了肿瘤的发生、发展、扩散,所以诱导细胞向凋亡方向发展在肿瘤的治疗中非常重要。研究发现,华蟾素诱导人乳腺癌MCF-7细胞凋亡的同时,可增加Bax蛋白的表达[6];诱导膀胱癌BIU87细胞株凋亡时,华蟾素使其细胞周期阻滞在G2/M期[7]。③抑制肿瘤血管生成。肿瘤血管是滋养肿瘤生成的关键,肿瘤细胞可以向胞外释放血管生成因子,激活血管内皮细胞,促进内皮细胞增殖和迁移,内皮细胞又通过旁分泌作用促进肿瘤细胞增殖,这种内皮与肿瘤之间的相互作用促进了肿瘤血管生成。通过肺癌Lewis荷瘤小鼠的实验发现,华蟾素抑制肿瘤血管生成是通过对VEGF/VEGFR-2信号传导通路的调控实现的[8]。④抑制肿瘤形成过程中相关的酶。通过对人子宫内膜癌HHUA细胞的实验证实,华蟾素可下调癌细胞中的基质金属蛋白酶-2,从而阻止肿瘤细胞外侵、转移的发生[9]。除了基质金属蛋白酶,华蟾素还能影响肿瘤细胞中参与代谢的相关酶的活性,如葡萄糖-6-磷酸酶、Mg2+-ATP酶[10]。
在止痛方面,华蟾素可能作用机制是:①华蟾素通过与阿片受体结合,引起膜电位超极化,使神经递质释放减少,从而阻断神经冲动的传递而产生镇痛效应,没有戒断综合征、呼吸抑制等不良反应;②华蟾素通过调节组织免疫细胞抗炎作用来达到缓解肿瘤癌性疼痛的目的;③华蟾素通过抗肿瘤作用使肿瘤体积减小,减轻肿瘤对周围组织压迫,减少肿瘤对外周感觉神经的直接压迫和侵蚀作用,进而间接达到止痛效果;④华蟾素中含有的吲哚类生物碱,通过和中枢神经系统的直接作用来提高痛阈[11]。
在机体免疫方面,华蟾素可通过提升患者的体液免疫及细胞免疫能力,增强患者的机体免疫功能,免疫力强了,自然并发症出现的概率就低了,这种免疫调节作用在一定程度上抑制了恶性肿瘤的发展[12]。另外华蟾素能够促进体内白细胞以及红细胞数量增长,从而缓解放疗、化疗带来的骨髓抑制现象,降低白细胞减少的不良反应,同时可以改善骨髓造血功能下降而引起的贫血问题,推测这一促进作用可能是通过刺激粒细胞集落、脾集落和骨髓红系细胞集落来实现的[13]。
本研究结果显示,治疗组卡氏评分明显高于对照组,疼痛指数明显低于对照组,口腔损害情况轻于对照组,2组体质量下降、骨髓抑制、肝肾损害情况比较差异无统计学意义。提示喉癌术后放化疗期间配合口服华蟾素胶囊,有助于提高患者的体力,改善术后生活质量,减轻疼痛和放化疗带来的口腔黏膜损害。推测口腔黏膜损害减轻可能与华蟾素提高机体免疫功能相关;2组白细胞下降情况比较无显著性差异,提示华蟾素对提升喉癌术后放化疗期间的白细胞水平作用较弱,或与研究样本量小所致差异不显著有关。
[参考文献]
[1]王飞,吴礼国,乐晓燕. 替吉奥联合华蟾素胶囊治疗胃癌的临床疗效[J]. 中国肿瘤临床与康复,2014,12(21):143-147
[2]陈志远. 赖氨匹林用于术后镇痛的研究[J]. 中华麻醉杂志,1996,16(8):381
[3]孙燕,周际昌. 临床肿瘤内科学手册[M]. 北京:人民卫生出版社,2003:106
[4]牛凯,成宇晶. 华蟾素对人肝癌细胞Bel-7402细胞增殖及周期的影响[J]. 山西中医,2013,29(3):47
[5]高山,田莉莉,陈华,等. 华蟾素注射液对人肝癌HepG-2细胞增殖及拓扑异构酶表达的影响[J]. 中国实验方剂学杂志,2013,19(11):250
[6]徐晓武,杨晓敏,金洲祥,等. 华蟾素诱导人乳腺癌细胞株MCF-7细胞凋亡与Bax/Bcl-2的关系[J]. 中国中西医结合外科杂志,2012,18(6):580
[7]苏劲,许志坚,叶木石. 华蟾素诱导膀胱癌细胞凋亡的实验研究[J]. 细胞与分子免疫学杂志,2009,25(4):351
[8]刘浩,林洪生,花宝金,等. 华蟾素调控VEGF/VEGFR-2信号转导抑制肿瘤血管生成的研究[J]. 中华中医药学刊,2008,26(11):2489
[9]王绍光. 华蟾素与子宫内膜癌HHUA细胞MMP-2和TIMP-2表达关系的研究[J]. 妇产与遗传,2012,2(1):29
[10] 赵明芳,王哲,魏龙春,等. 华蟾素对H22荷瘤小鼠肝癌细胞Mg2+-ATP酶、葡萄糖-6-磷酸酶活性的影响[J]. 山东医药,2007,47(4):25
[11] 王宁军,芦殿荣,杨柳,等. 华蟾素缓解癌性疼痛作用机制的研究进展[J]. 世界中西医结合杂志,2016,11(4):590-592
[12] 何玮. 中药华蟾素对晚期恶性肿瘤患者免疫功能的影响[J]. 中医临床研究,2014,6(29):19
[13] 王媛媛,曹晶杰,蒋潮涌,等. 华蟾素胶囊联合放射治疗对骨转移癌骨痛的临床观察[J]. 中国医学创新,2016,13(5):56-59
