Survivin在紫杉醇诱导人胶质瘤U251细胞凋亡中的作用
2018-04-09刘馨莲张录顺陈柯宇
刘馨莲,张录顺,陈柯宇
(成都医学院,四川 成都 610500)
胶质瘤是最常见的颅内原发恶性肿瘤,占颅内肿瘤的35.26%~60.96%[1],预后差,病死率高。临床治疗以外科手术为主,由于肿瘤组织与周围脑组织分界不清,不易彻底切除,术后多辅以放化疗。研究显示,细胞凋亡调控分子的表达异常和功能紊乱在脑胶质瘤发生与演进中起着重要作用,其中Survivin的异常表达与脑胶质瘤的发生发展密切相关[2],而Survivin属人类凋亡抑制蛋白(IAP)家族中的一员,也是迄今为止发现的功能最强大的凋亡抑制因子。紫杉醇(PTx)是从红豆杉中分离出的一种化合物,现已被用于非小细胞肺癌、乳腺癌、卵巢癌、胃癌等的化疗,抗肿瘤效果良好。诱导肿瘤细胞凋亡是紫杉醇重要的作用机制,故紫杉醇极有可能与Survivin的异常表达相关。本实验观察了紫杉醇对脑胶质瘤U251细胞生长情况以及Survivin蛋白表达的影响,旨在探讨紫杉醇治疗脑胶质瘤的机制。
1 实验资料
1.1材料人脑胶质瘤U251细胞株来自成都医学院细胞培养中心,紫杉醇为上海阿拉丁生化科技股份有限公司产品,Survivin抗体为武汉三鹰公司产品,MTT检测试剂盒为江苏凯基生物公司产品,胎牛血清为杭州四季青生物材料公司产品,DMEM培养基为Gibco公司产品,其余常规试剂均购自武汉谷歌生物科技公司。
1.2方法
1.2.1细胞培养在含10%胎牛血清的DMEM培养基,37 ℃、5%CO2培养箱中培养U251细胞,根据细胞生长状态2~3 d换液或传代1次。
1.2.2倒置显微镜观察当U251细胞生长至培养瓶的80%时,更换含有紫杉醇的培养液,设紫杉醇处理组(终浓度分别为10,100,1 000,10 000 nmol/L)和空白对照组(仅细胞培养液),分别于紫杉醇作用6,12,24,48 h时在倒置显微镜下观察U251细胞的生长情况。
1.2.3MTT实验取对数生长期的U251细胞,经0.04%EDTA消化后,接种于96孔板,每孔100 μL(大约104个细胞),每组设置5个复孔,37 ℃、5% CO2培养箱中培养24 h后进行药物干预。设紫杉醇处理组(终浓度分别为10,100,1 000,10 000 nmol/L)和空白对照组(完全培养基),37 ℃、5% CO2培养箱中培养24 h后换液,每孔加入100 μL培养液、20 μL MTT液,继续培养4 h,加入150 μL DMSO溶解,振荡10 min左右至溶解完全,酶标仪测550 nm波长处的OD值。药物对细胞的生长抑制率=(对照组A值-用药组A值)/对照组A值×100%。
1.2.4Western blot检测不同浓度紫杉醇(10,100,1 000,10 000 nmol/L)作用24 h和相同浓度(100 nmol/L)紫杉醇作用不同时间(6,12,24,48 h)后,收集各组细胞,加入蛋白裂解缓冲液提取总蛋白,BCA法测蛋白浓度。制胶(10%SDS-聚丙烯酰胺凝胶)、电泳、转膜、封闭、一抗(1∶1 000),4 ℃孵育过夜,二抗(1∶2 000),室温孵育2 h,ECL法显色,显影、定影,Alpha软件系统分析目标带的光密度值。
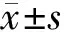
2 结 果
2.1紫杉醇对人胶质瘤U251细胞形态的影响在倒置显微镜下,空白对照组U251细胞贴壁生长状态良好,胞质透明,细胞轮廓清晰,折光性好。10 nmol/L紫杉醇处理U251细胞6 h后,细胞的贴壁能力减弱,少量细胞变圆、变小、皱缩、脱落漂浮于细胞培养液中。随着紫杉醇药物浓度的增高以及作用时间的延长,变小、变圆、脱落的细胞逐渐增多,部分黏附形成成簇的圆形小体。在10 000 nmol/L紫杉醇作用48 h后,大部分细胞脱落漂浮于细胞培养液中,仅少数细胞呈圆形贴壁生长,细胞生长受到明显抑制。
2.2紫杉醇对U251细胞的生长抑制作用MTT检测结果显示,10,100,1 000,10 000 nmol/L紫杉醇组的细胞抑制率分别为5.98%,21.38%,27.94%,35.8%,紫杉醇对U251细胞的生长抑制率随着药物作用浓度的增加而逐渐升高(P<0.05)。
2.3紫杉醇对U251细胞中Survivin蛋白表达的影响100 nmol/L紫杉醇诱导的Survivin表达早在6 h已经出现,随着时间的延长,Survivin表达水平呈升高趋势,见图1。不同浓度紫杉醇处理24 h后,10 nmol/L紫杉醇诱导的Survivin表达水平最高,随着药物浓度的增加,Survivin表达水平并未显示出简单的线性关系,说明药物干预需选择合适的浓度,见图2。

图1 紫杉醇处理后6,12,24,48 h细胞中Survivin表达

图2 不同浓度紫杉醇处理后细胞中Survivin表达
3 讨 论
紫杉醇是目前临床上治疗多种肿瘤的一线用药,其抗肿瘤机制主要有:①通过与p微管蛋白结合,稳定微管蛋白构象,抑制细胞分裂、增殖[3]。②可诱导bcl-2高磷酸化[4],以致其不能与bax结合,引起凋亡;还可激活Caspases-3、Caspases-8、STAT3、Ras/Raf等信号系统诱导细胞凋亡[5-8]。③激活免疫系统[9]、抗肿瘤血管形成[10]等。本实验结果显示,紫杉醇处理过的人脑胶质瘤U251细胞贴壁数量减少,折光性减弱,出现细胞凋亡形态,提示紫杉醇对人脑胶质瘤U251细胞具有明显的生长抑制效应,其效应存在着剂量依赖关系。因此,进一步研究紫杉醇诱导人脑胶质瘤U251细胞凋亡的分子生物学机制对于临床应用将有很大的帮助。
1997年,Ambrosini等[4]筛选并分离出了一种新的可抑制细胞凋亡的基因,命名为Survivin。Survivin基因位于人体17q25染色体上,全长14.7 kb,由3个内显子和4个外显子组成,是编码16.5 kDa的蛋白质[11]。Survivin主要特异性表达于人类胚胎和发育的胎儿组织中,广泛表达于大多数肿瘤组织如肺癌、食管癌、胃癌、肝癌、结直肠癌、膀胱癌、胶质瘤等[12]。Survivin能通过细胞色素C、Caspase-3、Caspase-7、Caspase-9等线粒体途径抑制细胞凋亡,也能通过FasR、TNFR、Caspase-8等死亡受体途径抑制细胞凋亡,还参与细胞周期调控[13],其表达在G2/M期最高。Survivin还可以通过稳定微管结构,在有丝分裂过程中发挥重要作用[14];其除了直接促进肿瘤发生外,还可在血管内皮细胞增殖阶段高表达,从而在肿瘤血管生成过程中发挥关键的促血管生成作用[15]。Survivin与化疗耐药、放疗不敏感相关,靶向Survivin的小分子抑制剂、反义寡核苷酸等均已处于临床研究中。本实验结果显示,100 nmol/L的紫杉醇处理人脑胶质瘤U251细胞6 h后,Survivin蛋白表达水平即升高,且随着作用时间延长,Survivin蛋白表达水平呈升高趋势;采用不同浓度的紫杉醇干预人脑胶质瘤U251细胞24 h后, 10 nmol/L紫杉醇组Survivin蛋白表达水平最高。说明在短时间内紫杉醇即可诱导Survivin的高表达,这有可能是药物作用的早期结果,这与Ling等[16]研究结果相符。随着紫杉醇浓度的增加,Survivin蛋白表达水平有所降低,但Survivin表达水平并未显示出简单的线性关系,提示在临床用药过程中,任意提高药物浓度对诱导U251细胞凋亡是无效的,应选择合适的药物浓度。
综上所述,紫杉醇对人胶质瘤U251细胞具有明显的生长抑制作用,其可以通过下调Survivin表达水平而诱导细胞凋亡,抑制肿瘤生长,为其临床应用提供了一定依据。
[参考文献]
[1]张纪. 深入开展胶质瘤综合治疗及其基础研究[J]. 中华神经外科杂志,2003,19(1):1-2
[2]屈洪艳,蔡润,朱正鹏. P16和Survivin蛋白在脑胶质瘤中的表达及其临床意义[J]. 国际检验医学杂志,2011,32(4):466-467
[3]Mitra A,Sept D. Taxol allosterically alters the dynamics of the tubulin dimer and increases the flexibility of microtubules[J]. Biophys J,2008,95(7):3252-3258
[4]Ambrosini G,Adida C,Altieri DC. A novel anti-apoptosis gene, survivin, expressed in cancer and lymphoma[J]. Nat Med,1997,3(8):917-921
[5]Walker SR,Chaudhury M,Frank DA. STAT3 inhibition by microtubule-targeted drugs: dual molecular effects of chemotherapeutic agents[J]. Mol Cell Pharmacol,2011,3(1):13-19
[6]Lu PH,Yu CC,Chiang PC,et al. Paclitaxel induces apoptosis through activation of nuclear protein kinase C-δ and subsequent activation of golgi associated cdk1 in human hormone refractory prostate cancer[J]. J Urol,2011,186(6):2434-2441
[7]Sun H,Yu T,Li J. Co-administration of perifosine with paclitaxel synergistically induces apoptosis in ovarian cancer cells: more than just AKT inhibition[J]. Cancer Lett,2011,310(1):118-128
[8]Eum KH,Lee M. Crosstalk between autophagy and apoptosis in the regulation of paclitaxel-induced cell death in v-Ha-ras-transformed fibroblasts[J]. Mol Cell Biochem,2011,348(1/2):61-68
[9]Huang Y,Fang Y,Dziadyk JM,et al. The possible correlation between activation of NF-KB/IkBpathway and susceptibility of tumor cell to paclitaxel-induced apoptosis[J]. Cancer Res,2002,13(2):113-122
[10] Merchan JR,Jayaram DR,Supko JG,et al. Increased endothelial uptake of paclitaxel as a potential mechanjsm for its antiangiogenic effeets: potentiation by Cox-2 inhibition[J]. Int J Cancer,2005,113(3):490-498
[11] 宋长山,谭家驹,赵建亭,等. p16与survivin蛋白在食管癌中的表达及意义[J]. 中国肿瘤,2007,18(8):625-627
[12] Jaiswal PK,Goel A,Mittal RD. Survivin: A molecular biomarker in cancer[J]. Indian J Med Res,2015,141(4):389-397
[13] Johnson ME,Howerth EW. Survivin: a bifunctional inhibitor of apoptosis protein[J]. Vet Pathol,2004,41(6):599-607
[14] Chakravarti A,Noll E,Black PM,et al. Quantitatively determined survivin expression levels are of prognostic value in human gliomas[J]. J Clin Oncol,2002,20(4):1063-1068
[15] Fukuda S,Pelus LM. Regulation of the inhibitor of apoptosis family member survivin in normal cord blood and bone marrow CD34(+) cells by hematopoietic growth factors: implication of survivin expression in normal hematopoiesis[J]. Blood,2001,98(7):2091-2100
[16] Ling X,Bernacki RJ,Brattain MG,et al. Induction of survivin expression by taxol (paclitaxel) is an early event, which is independent of taxol-mediated G2/M arrest[J]. J Biol Chem,2004,279(15):15196-15203
