饱和蒸汽对大豆豆瓣中磷脂酶D的影响
2018-04-09李婷婷刘天一于殿宇
李婷婷 王 旭 刘 芳 张 鲁 刘天一 于殿宇
(东北农业大学食品学院,哈尔滨 150030)
于殿宇,男,1964年出生,教授,粮油精深加工技术
在酶法脱胶工艺过程中,胶体物质主要是指磷脂[1]。磷脂分为水化磷脂(Hydratable Phosph-olipids,HP)和非水化磷脂(Non-hydratable Phospholipids,NHP)[2-3]。水化磷脂包括磷脂酰胆碱(卵磷脂,PC)、磷脂酰乙醇胺(脑磷脂,PE)、磷脂酰肌醇(PI)、缩醛磷脂酰胆碱(APC)等[4-5],都含有极性较强的基团,因此具有比较强的亲水性,与水接触后能与水形成水合物,可以从油中析出并经过离心分离除去。在毛油进行脱胶时,水化磷脂可以通过水化脱胶、酸法脱胶、特殊脱胶等传统的脱胶方法除去[6-7]。但是,大豆毛油中非水化磷脂是以磷脂酸和溶血磷脂酸的钙镁盐的形式存在的[8],非水化磷脂具有明显的疏水性,水化脱胶中较难与水结合,去除较为困难,增加毛油的损耗和生产成本[9]。所以生产中应尽量避免产生非水化磷脂。
在大豆油预处理过程中,大豆需要软化以增加弹塑性,减少轧坯时的粘辊现象,保证坯片的质量,提高浸出率。由于大豆中磷脂酶D的存在使非水化磷脂含量增多,控制大豆豆瓣中磷脂酶D的活性可以很好的控制非水化磷脂的含量[10-11]。因而,利用饱和蒸汽对软化后的大豆豆瓣进行处理,研究其对大豆豆瓣中磷脂酶D活性的影响,以期降低毛油中的非水化磷脂含量。
本实验扦取破碎后的大豆豆瓣样品,在确保大豆豆瓣氮溶解指数(Nitrogen solubility index,NSI)变化不大的条件下,对豆瓣进行加温软化,然后向软化后豆瓣中通入饱和蒸汽进行湿热处理,研究破碎程度、饱和蒸汽温度和蒸汽处理时间对大豆豆瓣中磷脂酶D活性的影响,通过溶剂萃取制得大豆毛油,研究大豆毛油中非水化磷脂的含量,以期更好地指导实际生产。
1 材料与方法
1.1 材料与仪器
破碎后不同大小的大豆豆瓣样品[含水量(12±0.2)%]:黑龙江九三康诺有机农产品科技有限公司;乙醚、高氯酸、氯化钙、氢氧化钠、丙酮、正丙醇、乙酸钠、石油醚、雷氏盐等均为分析纯:国药集团。
LG10-2.4A型高速离心机:北京众益中和生物有限公司;F2102型植物粉碎机:天津市泰斯特仪器有限公司;JB-3型定时恒温磁力搅拌器:上海雷磁新泾仪器有限公司;LDR3-0.7R(Ⅱ)蒸汽发生器:温州市鹿城江心服装机械有限公司;DHG-9123A电热鼓风干燥箱:上海一恒科学仪器有限公司。
1.2 方法
1.2.1大豆中磷脂酶D的测定方法
酶的制备:把豆瓣粉碎,称取5.0 g粉末样品在低温下进行脱脂。移入布氏漏斗中,真空抽滤。并用石油醚冲洗滤饼。室温下干燥。进一步研细,重复操作过程。把大豆粉浸泡后进行浸提,得到粗制大豆粉,通过离心分离,使其与不溶性杂质分离,取上层清夜用50%饱和度的硫酸铵进行蛋白质盐析沉淀,沉淀物用水溶解得到酶液[12]。
酶活力的测定:将30.0 mL的底物加入带塞的试管中,在25 ℃水浴锅中,温度平衡后,加入稀释10倍的酶液5.0 mL,在反应开始时,加入1.0 mL乙醚,混匀后于25 ℃保温20 min,反应用2.0 mL高氯酸终止。把混合物移入100.0 mL的分液漏斗,加入10.0 mL乙醚,剧烈振荡使乙醚可充分萃取未反应的磷脂和产物磷脂酸,用乙醚反复萃取3次,将乙醚分离后,进行胆碱测定[13]。
1.2.2大豆豆瓣软化过程对磷脂酶D活性变化趋势的研究
将经破碎处理的大豆豆瓣放入不锈钢锅内,水浴锅内温度为65 ℃,间隔一段时间翻转物料,软化时间20 min,并进行大豆豆瓣中磷脂酶D活性的测定,测定方法同1.2.1。
1.2.3 饱和蒸汽处理对大豆豆瓣中磷脂酶D活性变化趋势的研究
选取规格为直径28 cm,高13 cm的不锈钢锅,下开口直径为4 cm以利于蒸汽通入,上开口直径6 cm以利于蒸汽通出,内置60目不锈钢蒸屉网,需将整个不锈钢蒸屉网覆盖上大豆豆瓣防止短路,利用蒸汽发生器将饱和蒸汽处理通入锅底,间隔一段时间翻转物料,对大豆豆瓣进行饱和蒸汽处理,测定不同条件下大豆豆瓣中磷脂酶D的活性,测定方法同1.2.1。
1.2.4大豆豆瓣中油脂的萃取
采用索氏抽提法,对软化后的大豆豆瓣以及1.2.3中经饱和蒸汽处理后得到的大豆豆瓣,分别进行油脂的萃取[14-15]。
1.2.5响应面优化饱和蒸汽处理最佳参数
综合单因素实验结果,采用Box-Behnken模型,对破碎程度(A)、饱和蒸汽温度(B)、通汽时间(C)3个因素进行优化,以大豆豆瓣中磷脂酶D活性(Y)为响应值,进行三因素三水平的响应面分析,使用Design Expert 8.0.6设计响应面实验以优化蒸汽处理参数。响应面因素水平编码见表1。

表1 Box-Behnken设计实验因素水平及编码
1.2.6大豆豆瓣中NSI值的测定
取1.2.3中大豆豆瓣,对其进行大豆豆瓣中蛋白氮含量的测定。并利用公式计算NSI值。
大豆蛋白氮含量测定方法为GB 5511—2008《谷物和豆类氮含量测定》
1.2.7大豆毛油中非水化磷脂含量的测定
取一定量的大豆毛油,加热至80 ℃,加入大豆毛油中磷脂含量10倍质量的等温蒸馏水,在较低转速下搅拌30 min后离心20 min,得到水化脱胶油。采用测定油脂水化前后磷脂总含量的方法,即水化后磷脂含量占水化前磷脂含量的百分比,从而得出非水化磷脂所占比例[16]。
磷脂含量测定参照GB/T 5537—2008《粮油检验磷脂含量的测定(钼蓝比色法)》
1.2.8大豆毛油脱胶油精炼率的计算
参照杨亚济[17]的方法,计算制得大豆毛油进行水化脱胶的精炼率。
2 结果与讨论
2.1 单因素对磷脂酶D活性的影响
2.1.1大豆豆瓣中磷脂酶D活性
将工厂中扦取的破碎后的大豆豆瓣经软化后置于烧杯中,对其大豆豆瓣中磷脂酶D的活性进行测定,测定结果为0.76 U/mg·min。
2.1.2大豆豆瓣的破碎程度对豆瓣中磷脂酶D活性的影响
将大豆豆瓣置于烧杯中,以大豆豆瓣大小作为衡量破碎程度的指标,筛选出破碎为4、5、6、7、8瓣的大豆豆瓣样品置于水浴锅内的不锈钢锅中进行软化,温度为65 ℃,软化时间20 min。取软化后大豆豆瓣置于1.2.3的锅中,通入0.14 MPa、110 ℃的饱和蒸汽,通汽时间为1.5 min。分别取2.0 g大豆豆瓣,测定其大豆豆瓣中磷脂酶D活性。测定结果见图1。

图1 破碎程度对酶活性的影响
由图1可知,不同的破碎程度对大豆豆瓣中磷脂酶D的活性有显著影响。当大豆豆瓣的破碎程度为4瓣时,其磷脂酶D的活性最强,这可能是由于大豆豆瓣尺寸较大而导致在饱和蒸汽湿热处理过程中不充分,饱和蒸汽难以传质至大豆豆瓣中心,使大豆豆瓣中磷脂酶D的活性分布不均。当大豆豆瓣的破碎程度为6瓣,其磷脂酶D的活性变化趋势不明显,即此时大豆豆瓣经饱和蒸汽湿热处理时可以充分受热,大豆豆瓣湿热处理较为彻底。当大豆豆瓣的破碎程度为7~8瓣时,其磷脂酶D的活性虽达到最低值,但由于此时样品尺寸过小,不宜于后续的轧坯操作。因此,本实验选取最佳破碎程度为6瓣的大豆豆瓣。
2.1.3饱和蒸汽温度对大豆豆瓣中磷脂酶D活性的影响
取破碎为6瓣的大豆豆瓣置于水浴锅内的不锈钢锅中进行软化,温度为65 ℃,软化时间20 min。取软化后大豆豆瓣置于1.2.3的锅中,调节蒸汽发生器的压力,在不同压力下,分别通入100、105、110、115、120 ℃的饱和蒸汽,通入饱和蒸汽时间为1.5 min。分别取2.0 g大豆豆瓣测定磷脂酶D活性。测定结果见图2。
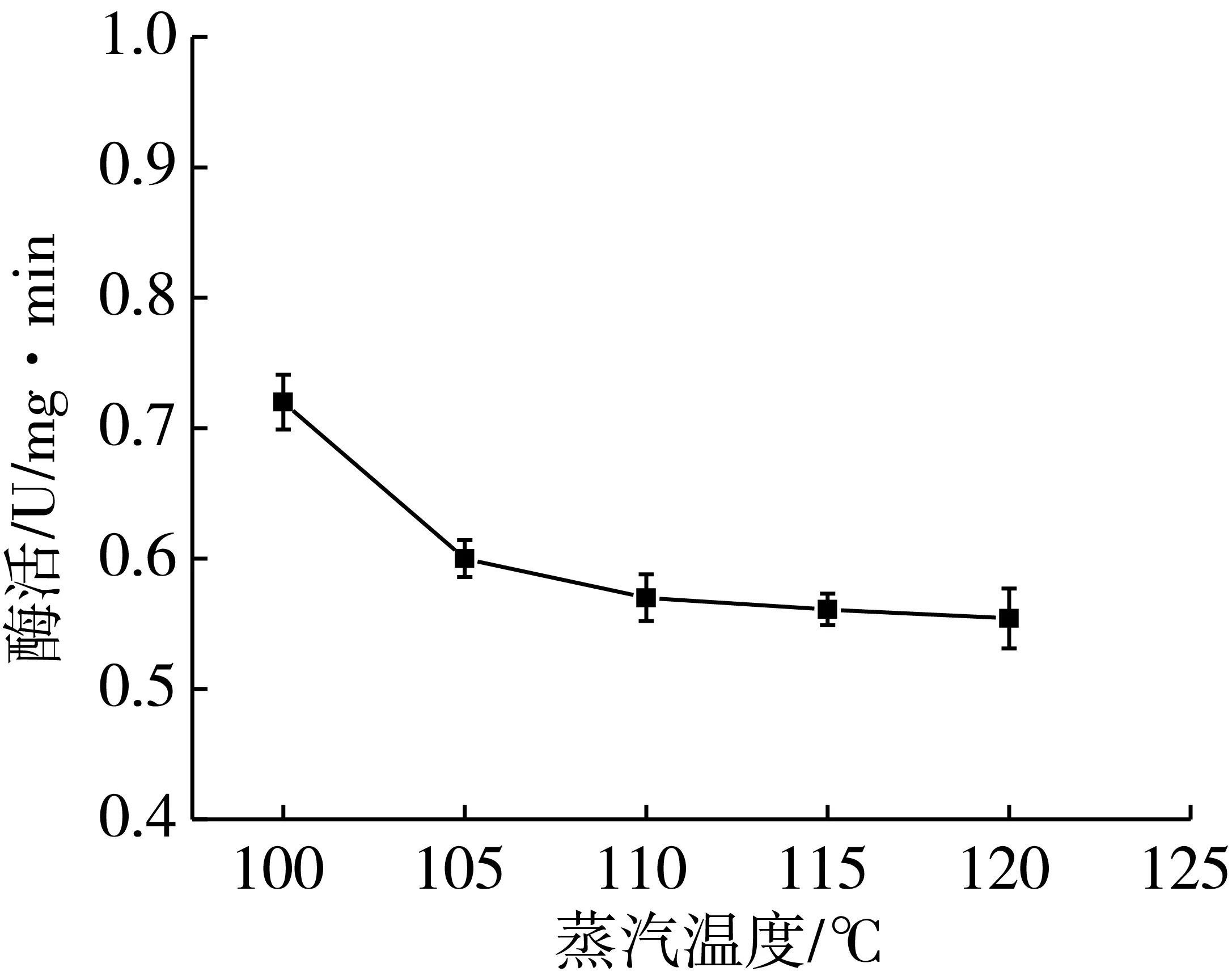
图2 饱和蒸汽温度对酶活性的影响
由图2可知,随着蒸汽温度逐渐升高,酶的活性逐渐降低。当温度处于100~105 ℃时,随着温度升高,大豆豆瓣中磷脂酶D活性的变化趋势较明显,这可能是因为温度对酶活性的作用较大,使部分酶发生变性,因而酶活性降低。当温度处于105~115 ℃时,大豆豆瓣中磷脂酶D活性的变化趋势不明显,此原因可能是饱和蒸汽温度较高,大部分酶已被钝化,因此酶活随温度的变化较小。当温度处于120 ℃时,虽然温度越高,酶活损失越大,温度过高时,会影响大豆豆瓣蛋白的NSI,继而影响大豆豆瓣的质量。因此在不影响大豆豆瓣中蛋白质的性质情况下,本实验选择通入蒸汽的最佳温度为110 ℃。
2.1.4通入饱和蒸汽时间对大豆豆瓣中磷脂酶D活性的影响
取破碎为6瓣的大豆豆瓣置于水浴锅内的不锈钢锅中进行软化,温度为65 ℃,软化时间20 min。取软化后大豆豆瓣置于1.2.3的锅中,通入110 ℃的饱和蒸汽,通汽时间分别为0.5、1、1.5、2、2.5 min。分别取2.0 g大豆豆瓣测定磷脂酶D活性。测定结果见图3。

图3 通入饱和蒸汽时间对酶活性的影响
由图3可知,随着通入饱和蒸汽时间的延长,酶的活力逐渐减弱。当通汽时间在0.5~1 min时,大豆豆瓣中磷脂酶D活性降低趋势缓慢,可能是由于此时通入饱和蒸汽时间较短,大部分酶没有被灭活。当时间为1~1.5 min时,随着通入饱和蒸汽时间的延长大豆豆瓣中磷脂酶D活性下降较快,即温度一定时,通汽时间越久,酶活损失越明显。而在1.5 min以后,酶活降低趋势又趋于平缓,如若再延长时间,则会使大豆豆瓣中的蛋白NSI降低,影响产品质量。因而选取通入饱和蒸汽最佳时间为1.5 min。
2.2 响应面优化饱和蒸汽湿热处理豆瓣最佳条件
综合单因素实验的结果,以破碎程度(A)、饱和蒸汽温度(B)、通汽时间(C)3个因素进行优化,以大豆豆瓣中磷脂酶D活性(Y)为响应值,进行三因素三水平的响应面分析,使用Design Expert 8.0.6设计响应面实验以优化饱和蒸汽处理豆瓣条件。响应面实验方案与结果见表2。对表2进行拟合的二次模型方差分析见表3。
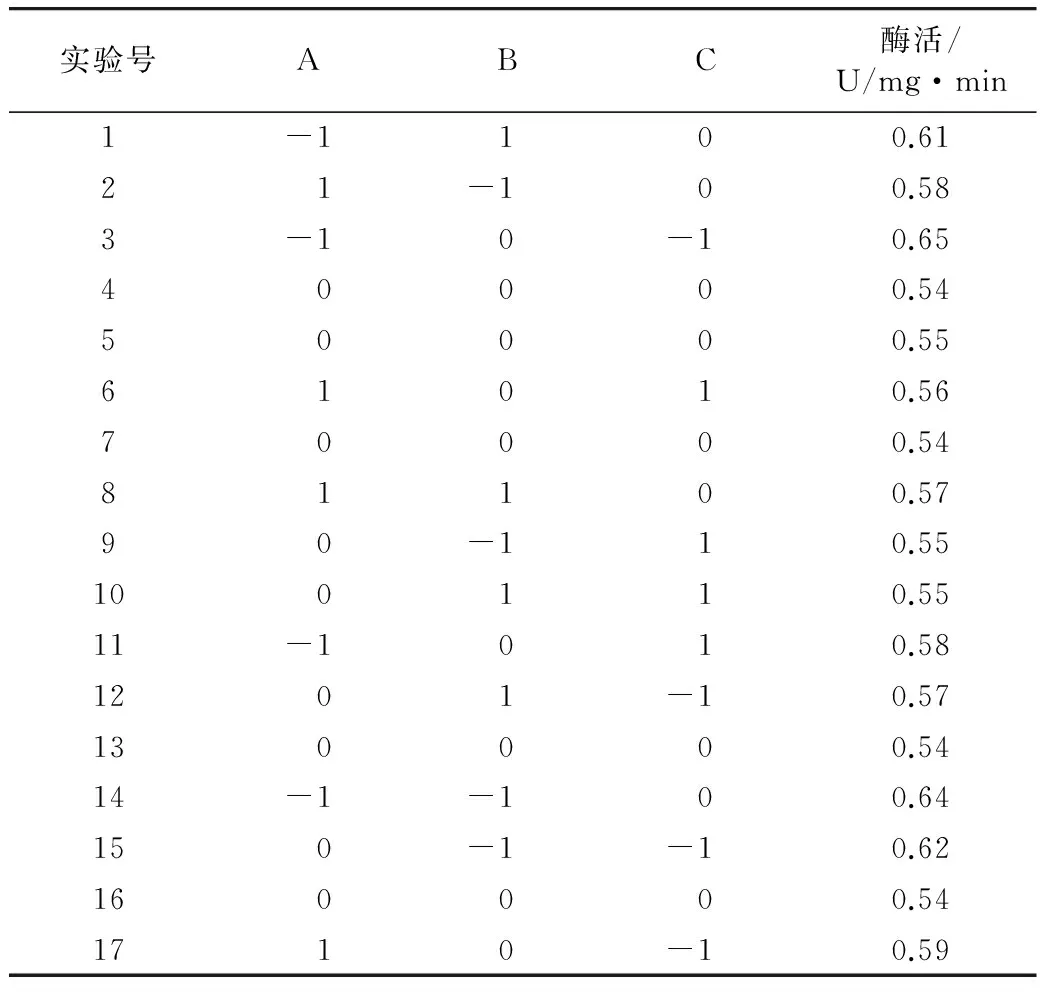
表2 Box-Behnken实验设计及结果
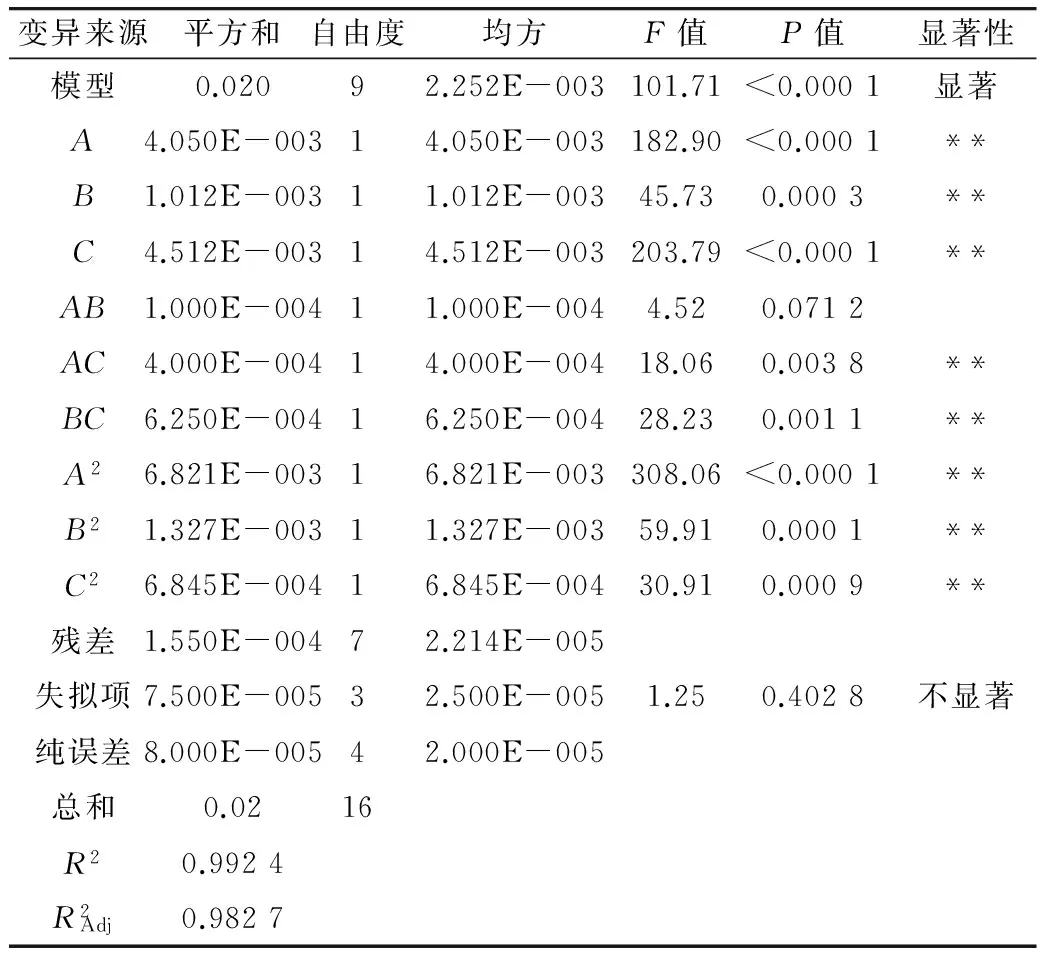
表3 回归方程的方差分析表
注:**差异极显著(P<0.01);*差异显著(P<0.05)。
由表3知,实验共进行17次,其中析因实验为12次,中心实验为5次。采用Design expert 8.0.6软件对表中数据进行二次多项回归拟合,各实验因子对响应值的影响可用如下函数表示:
Y=0.54-0.023A-0.011B-0.024C+(5.000E-003)AB+0.01AC+0.013BC+0.040A2+0.018B2+0.013C2。




图4 大豆豆瓣中磷脂酶D活性的响应面图
从图4中可以看出,破碎程度、饱和蒸汽温度、通汽时间在两两交互时,保持其中2个变量不变,随着另外2个变量的增加,大豆豆瓣中磷脂酶D活性总体上呈现降低的趋势。
对方程进行分析求解,以大豆豆瓣中磷脂酶D活性的变化趋势得到经饱和蒸汽处理大豆豆瓣的最佳处理工艺条件为:破碎程度6.17瓣、饱和蒸汽温度109.93 ℃、通汽时间1.93 min。考虑到实际操作的方便,将饱和蒸汽通入大豆豆瓣的最佳处理条件修改为破碎程度6瓣、饱和蒸汽温度110 ℃、通汽时间2 min,在此条件下,饱和蒸汽处理后的大豆豆瓣中磷脂酶D活性的理论预测值为0.529 U/mg·min,实际测得大豆豆瓣中磷脂酶D活性为0.54 U/mg·min,表明该模型可行。且与蒸汽处理前相比,酶活损失为28.9%。
2.3 饱和蒸汽处理时间对大豆豆瓣蛋白NSI的影响
由2.2可知,饱和蒸汽可以使大豆豆瓣中磷脂酶D的活性失活,但是当通入饱和蒸汽的量过多时,会使大豆豆瓣蛋白质发生变性,因而影响后续产品质量。本实验主要以NSI对大豆豆瓣蛋白变性程度进行评价。通入饱和蒸汽的时间对大豆豆瓣蛋白的NSI有显著影响[18],因而本实验采用0.14 MPa、110 ℃的饱和蒸汽,并以不同通汽时间对大豆豆瓣蛋白NSI的影响进行测定。结果见图5。
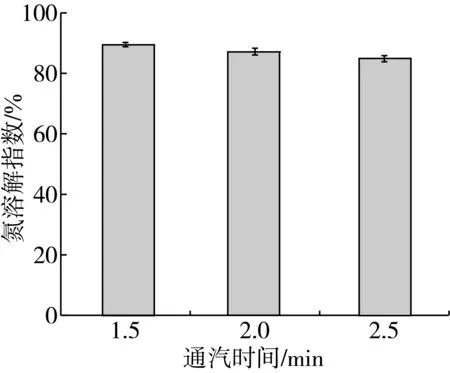
图5 通入蒸汽时间对NSI变化影响
由图5可知,大豆豆瓣蛋白NSI随着通入饱和蒸汽时间的延长而逐渐下降。大豆豆瓣蛋白NSI越低,则其质量越差,因此本实验选取的110 ℃、2 min的饱和蒸汽处理条件不仅可以使大豆豆瓣中磷脂酶D灭活,还可以保证大豆豆瓣蛋白NSI较高,从而不影响其质量。
2.4 饱和蒸汽处理对大豆毛油中非水化磷脂含量影响
饱和蒸汽可以使大豆豆瓣中磷脂酶D钝化,则必然会对毛油中非水化磷脂含量有一定的影响,本实验中,测定以饱和蒸汽处理大豆豆瓣及未经蒸汽处理大豆豆瓣制得的大豆毛油,其结果见图6。
图6 蒸汽处理前后对非水化磷脂含量变化影响
由图6可知,未经饱和蒸汽处理大豆豆瓣制得的大豆毛油中非水化磷脂约占磷脂总量的12.4%,氮溶解指数为91.4%。以饱和蒸汽处理大豆豆瓣制得的大豆毛油中非水化磷脂约占总磷脂含量的2.3%,相比之下,非水化磷脂含量减少,主要原因饱和蒸汽处理可以有效降低大豆豆瓣中磷脂酶D活性,阻止大豆豆瓣中磷脂酶D催化水解反应发生[19],避免磷脂酸的产生,从而减少了毛油中非水化磷脂的含量。因而对软化后大豆豆瓣进行饱和蒸汽处理,可以达到降低毛油中非水化磷脂的目的, 经水化脱胶油脂精炼率提高了0.36%,效果较好。
3 讨论
未经饱和蒸汽处理的大豆豆瓣磷中脂酶D活性为0.76 U/mg·min,大豆豆瓣蛋白NSI为91.4%,大豆毛油中非水化磷脂质量分数高达12.4%。将软化后的大豆豆瓣进行饱和蒸汽处理,在最佳条件下,大豆豆瓣中磷脂酶D活性降低了28.9%,大豆豆瓣蛋白NSI仅降低了4.2%,对大豆豆瓣的蛋白质量影响较小。对萃取毛油中非水化磷脂含量降低了10.1%,经水化脱胶大豆脱胶油的精炼率提高了0.36%。由此可见,通过对大豆软化后的豆瓣进行饱和蒸汽处理,对大豆豆瓣中磷脂酶D的活性影响较大,从而可以更好地指导实际生产。
[1]XIE M, DUNFORD N T. Lipid composition and emulsifying properties of canola lecithin from enzymatic degumming[J]. Food Chemistry, 2017, 218:159-164
[2]LI Z, LIU H, ZHAO G, et al. Enhancing the performance of a phospholipase A1, for oil degumming by bio-imprinting and immobilization[J]. Journal of Molecular Catalysis B Enzymatic, 2016, 123:122-131
[3]YU D, MA Y, XUE S J, et al. Characterization of immobilized phospholipase A1, on magnetic nanoparticles for oil degumming application[J]. LWT-Food Science and Technology, 2013, 50(2):519-525
[4]王玉,孙博,陈晓慧,等. 磷脂含量对大豆油贮藏稳定性的影响[J]. 食品科学,2011,32(9):122-125
WANG Y, SUN B, CHEN X H, et al. Effect of phospholipids on storage stability of soybean oil[J]. Food Science, 2011,32(9):122-125
[5]CERMINATI S, EBERHARDT F, ELENA C E, et al. Development of a highly efficient oil degumming process using a novel phosphatidylinositol-specific phospholipase C enzyme[J]. Applied Microbiology & Biotechnology, 2017:1-9
[6]潘明喆,柴玉华,杜鹏. 磷脂酶A1用于大豆油酶法脱胶技术的研究[J]. 食品工业科技,2008(5):219-222
PAN M Z, CHAI Y H, DU P. Study on enzymatic degumming of soybean oil by phospholipase A1[J]. Science and Technology of Food Industry, 2008(5):219-222
[7]QU Y, SUN L, LI X, et al. Enzymatic degumming of soybean oil with magnetic immobilized phospholipase A2[J]. LWT-Food Science and Technology, 2016, 73:290-295
[8]孙博,关茵,李红玲,等. 水蒸气法脱除大豆油脂中非水化磷脂[J]. 食品科学,2011,32(6):49-52
SUN B, GUAN Y, LI H L, et al. Non-hydratable phospholipids water vapor removal in soybean oil[J]. Food Science, 2011,32(6):49-52
[9]胡新娟,张正茂,邢沁浍,等. 微波处理降低小麦胚芽油中非水化磷脂含量的工艺优化[J]. 食品科学,2016,27(8):8-12
HU X J, ZHANG Z M, XING Q H, et al. Optimization of microwave treatment for reducing the content of non hydrate phospholipids in wheat germ oil[J]. Food Science, 2016,27(8):8-12
[10]王希,杨帆,杜宣利,等. 软化条件对大豆软化效果影响的研究[J]. 中国油脂,2015,40(12):7-11
WANG X, YANG F, DU X L, et al. Study on the softening effect on the softening conditions of soybean[J]. China Oils and Fats, 2015,40(12):7-11
[11]LIST G R, MOUNTS T L, LANSER A C, et al. Effect of moisture, microwave heating, and live steam treatment on phospholipase D activity in soybeans and soy flakes[J]. Journal of the American Oil Chemists' Society, 1990, 67(11):867-871
[12]倪培德,裘爱泳,江涛. 大豆磷脂酶D的研究[J]. 中国粮油学报,1991(3):36-41
NI P D, QIU A Y, JIANG T. Study on soybean phospholipase D[J]. Journal of the Chinese Cereals and Oils Association,1991(3):36-41
[13]谢朝顺,李桂华. 分光光度法测定大豆中磷脂酶D[C]. 中国粮油学会油脂分会学术年会暨产品展示会,2009
XIE C S, LI G H. Determination of phospholipase D in soybean by Spectrophotometry[C]. Academic year and product exhibition of oil and grease branch of China Grain and Oil Institute,2009
[14]吴海波,齐宝坤,江连洲,等. 发酵全脂大豆粉提取油和蛋白的研究[J]. 中国粮油学报,2015,30(8):24-31
WU H B, QI B K, JIANG L Z, et al. Study on oil and protein extraction of fermented soybean meal[J]. Journal of the Chinese Cereals and Oils Association, 2015,30(8):24-31
[15]WANG G H, SU P, ZHANG F, et al. Comparison of microwave-assisted extraction of aloe-emodin in aloe with Soxhlet extraction and ultrasound-assisted extraction[J]. Science China Chemistry, 2011, 54(1):231-236
[16]杨梅桂,周秀娟,金琰斐. 非水化磷脂及其定量检测[J]. 中国卫生检验杂志,2008,18(1):71
YANG M G, ZHOU X J, JIN Y F. Nonhydratable phospholipids and quantitative detection[J]. Chinese Journal of Health Laboratory Technology, 2008,18(1):71
[17]杨亚济. 大豆油酶法脱胶应用实践[J] .中国油脂,2016,41(8):107-109
YANG Y J. Application of enzymatic degumming of soybean oil[J]. China Oils and Fats, 2016,41(8):107-109
[18]郑田要. 以高温脱脂豆粕为原料制备大豆分离蛋白的研究[D]. 广州:华南理工大学, 2010
ZHENG T Y. Preparation of soybean protein isolate by high temperature defatted soybean meal[D].Guangzhou:South China University of Technology,2010
[19]PANTAZI D, DROUGAS E, LOPPINET B, et al. Hydrolysis by phospholipase D of phospholipids in solution state or adsorbed on a silica matrix[J]. Chemistry & Physics of Lipids, 2006, 139(1):20-31.
