经肝动脉化疗栓塞联合射频消融治疗原发性肝细胞癌合并门静脉癌栓的预后影响因素分析
2018-04-09肖金成康鑫鑫白淇文
肖金成,康鑫鑫,白淇文,李 靖
1.郑州大学附属肿瘤医院微创介入科,河南 郑州 450003;2.郑州大学第一附属医院麻醉科,河南 郑州 450052
原发性肝细胞癌(hepatocellular carcinoma,HCC)是常见的消化系统肿瘤之一,约30%的HCC患者确诊时已合并门静脉癌栓(portal vein tumor thrombus,PVTT)[1],一旦HCC细胞侵袭门静脉系统,极易导致癌细胞的肝内转移播散和手术后肿瘤复发,严重影响患者预后[2]。目前HCC的众多微创治疗方法中,以经肝动脉化疗栓塞(transcatheter arterial chemoembolization,TACE)最为常用。但在TACE治疗中由于肝动脉被人为阻塞,若同时伴有门静脉阻塞则可能加重肝组织供血不足,进而引起肝功能损害[3],因此,目前的大部分指南将TACE视为合并PVTT的HCC患者的治疗禁忌证。然而,在实际临床工作中,大量合并不同程度PVTT的HCC患者仍在接受TACE治疗,并取得了一定的疗效[4]。此外,有部分研究显示,TACE治疗合并PVTT的HCC患者并非绝对禁忌证,而受患者肝功能、PVTT部位等因素的影响[5-6]。本研究回顾性分析107例患者的临床资料及随访数据,旨在探究可能影响HCC合并PVTT患者TACE联合射频消融(radiofrequency ablation,RFA)治疗后生存期及肿瘤复发的相关因素,以期为临床HCC治疗方法的选择提供参考。
1 资料和方法
1.1 一般资料
回顾性分析2011年1月1日—2013年12月31日于郑州大学附属肿瘤医院确诊为HCC合并PVTT并行TACE联合RFA治疗的157例患者的临床资料。所有患者均符合《原发性肝癌诊疗规范(2011年版)》诊断标准,术前经CT、MRI检查证实肝内存在肿瘤灶且门静脉主干或主要分支内存在癌栓,并经术中穿刺活检病理确诊。患者均为初次诊断或术后复发,不愿接受手术或不能耐受手术,同时临床资料、实验室检验资料及随访资料完整。排除随访资料不完整,合并有肝性脑病、难治性腹腔积液、消化道出血、凝血功能障碍的患者,以及术前曾行手术切除或氩氦刀冷冻治疗、行肝移植术、病理诊断为肉瘤、混合细胞性HCC、胆管细胞癌的患者。所有治疗均在患者知情同意下进行,并签署知情同意书。
1.2 治疗方法
所有患者均先行TACE治疗,2~3周后行RFA。患者于术前接受包括血常规、肝肾功能、影像学及甲胎蛋白(alpha-fetoprotein,AFP)在内的常规检查,结合肿瘤位置、形态、大小及数量确定治疗方案。TACE术:采用Seldinger技术对股动脉进行穿刺,在数字减影血管造影透视下将导管选择性置入肿瘤供血动脉内,再将化疗药物(注射用洛铂50 mg/m2,海南长安国际制药有限公司;氟尿苷0.5~1.0 g/m2,浙江海正药业股份有限公司;同时根据肿瘤体积及肿瘤术中栓塞情况酌情使用注射用盐酸吡柔比星20~40 mg/m2,浙江海正药业股份有限公司)与栓塞剂碘化油(5~25 mL,具体剂量根据肿瘤大小、血供丰富程度、患者体表面积和肝功能情况而定)在数字减影血管造影透视下经导管缓慢注入供血动脉内进行栓塞,栓塞结束后,再次行肝动脉造影,评估栓塞程度及肝动脉其他分支的血流情况。术后进行保肝、镇痛等对症治疗。RFA患者在接受治疗前保持空腹4~6 h,全凭静脉麻醉,CT定位,确定穿刺点、进针方向及角度,将射频电极针由定位点刺入肿瘤中心,确认位置无误后打开电极针开始RFA治疗,治疗时温度控制在95 ℃以上(小于110 ℃)。当瘤体直径在3 cm以下,治疗时间控制在5 min左右;瘤体直径在3~4 cm,治疗时间控制在10 min左右;瘤体直径在5 cm以上,治疗时间控制在15 min左右。对于较大的肿瘤采用一次定位多点穿刺技术治疗。术中密切观察患者的生命体征,避免严重并发症的发生。治疗结束后,退针时进行针道烧灼止血,用创可贴保护创口,术后常规应用止血药及抗生素3 d。
1.3 检测指标及随访
对患者的原始病案及术后随访数据进行回顾性整理和分析。统计患者的人口学资料,包括性别、年龄、吸烟史及饮酒史等;实验室指标包括术前AFP、丙氨酸转氨酶(alanine aminotransferase,ALT)、天冬氨酸转氨酶(aspartate aminotransferase,AST)、总胆红素(total bilirubin,TBIL)及白蛋白(albumin,ALB)水平;临床资料包括肝功能Child Pugh分级、肿瘤数量、肿瘤大小、门静脉癌栓部位、肝硬化和肝炎史。通过电话、邮件及门诊等方式对患者的生存期进行随访,记录肿瘤复发或转移及患者死亡的时间。生存期的计算以患者行AFP治疗日和死亡日分别作为起点和终点。在截止随访时未出现复发转移或死亡,以最后1次随访时间为截尾日期,本研究随访截至2016年12月31日,随访时间范围为3~72个月。
1.4 统计学处理
采用Stata及R软件进行统计学分析,正态分布的计量资料数据用x±s表示,非正态分布的计量资料以中位数(Q1-Q3)表示,计数资料用例数(率)表示。首先对各项可能因素进行单因素分析,对其中差异有统计学意义的因素再采用多因素Cox回归模型进行分析,P<0.05为差异有统计学意义。
2 结 果
2.1 研究对象的基本资料
研究纳入的157例患者的基本资料见表1。

表1 157例患者的一般情况Tab. 1 Baseline characteristics of the 157 patients
2.2 TACE联合RFA治疗HCC合并PVTT患者预后影响因素的单因素分析
分析TACE联合RFA治疗HCC合并PVTT患者3年生存及复发转移风险相关影响因素结果显示,治疗前AFP、ALT、AST、ALB水平,癌栓部位,肝功能Child Pugh分级,肿瘤数目及肿瘤直径为患者3年生存率的主要影响因素,其中,ALB水平为保护性因素,其余为危险因素;肿瘤复发转移的主要影响因素有性别,肝硬化病史,治疗前AFP、ALT、AST、ALB水平,癌栓部位,肝功能Child Pugh分级,肿瘤数目及肿瘤直径,其中女性和ALB水平为保护性因素,其余为危险因素(表2)。
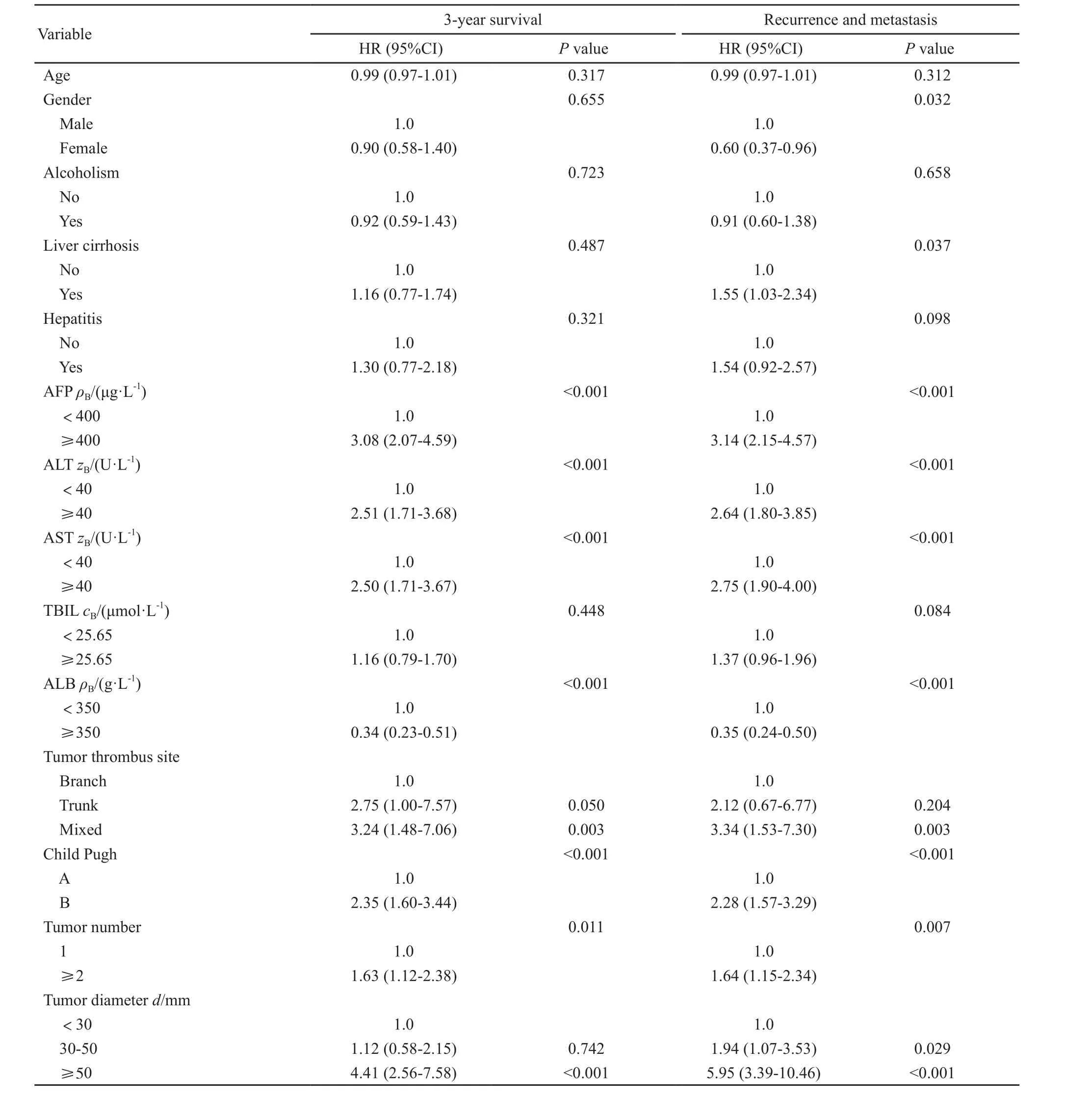
表2 HCC合并PVTT患者3年生存及复发转移风险相关因素分析Tab. 2 Risk factors of 3-year survival and recurrence and metastasis in HCC patients with PVTT
2.3 TACE联合RFA治疗HCC合并PVTT患者预后影响因素的多因素Cox回归分析
对单因素分析中差异有统计学意义的指标进行多因素Cox回归分析。结果显示,在调整和控制年龄、性别、肿瘤数目及直径的前提下,术前AFP、ALT、AST、ALB水平,癌栓部位及肝功能Child Pugh分级为影响患者治疗后3年生存的独立因素,其中血清ALB水平为保护性因素,其余为危险因素;血清ALB水平同样为降低肿瘤复发转移风险的保护性因素,而术前AFP、ALT、AST水平及癌栓部位为肿瘤复发转移的独立危险因素(表3)。
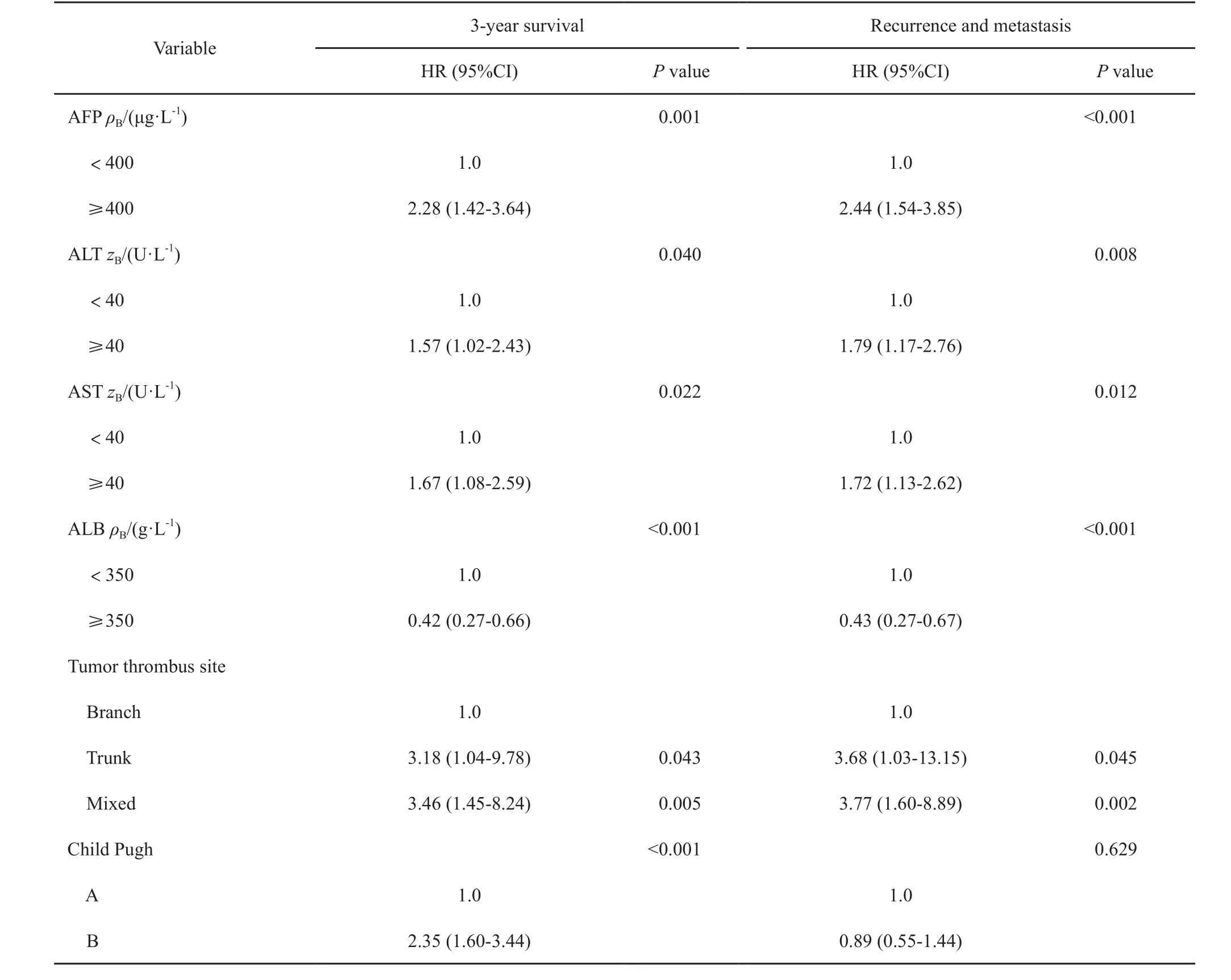
表3 HCC合并PVTT患者预后影响因素的多因素Cox回归分析Tab. 3 Multivariate Cox regression analysis of the prognostic factors in HCC patients with PVTT
3 讨 论
PVTT是肿瘤局部播散与远处转移的启动点,对肿瘤细胞的肝内播散性转移、肝硬化及食管静脉曲张起促进作用,若未经治疗,HCC合并PVTT患者的平均生存时间只有2.7~4.0个月[7]。有研究表明,对于失去外科手术机会的中晚期HCC患者,TACE联合RFA能够更加有效地提高肿瘤完全坏死率和抑制局部复发,改善患者的生存状态,其肿瘤反应和短期生存率优于任何一种单一的治疗方式[8]。虽然既往研究认为,当癌栓位于主干或一级分支内时,是TACE及RFA治疗的禁忌证。但近年来随着技术的完善,RFA也开始应用于PVTT患者的治疗[9]。有临床研究发现,TACE并非HCC合并PVTT的绝对禁忌,其疗效受肿瘤侵犯程度、肿瘤形态及肝功能等多重因素的影响[10]。因此,充分探究TACE联合RFA治疗HCC合并PVTT预后影响因素,对于更好地选择其适应证、提高治疗效果都有着积极意义,同时也有利于医患之间的沟通,避免不必要的医疗纠纷。本研究回顾性分析了157例HCC合并PVTT患者行TACE联合RFA治疗的临床资料,这部分患者6个月、1年和3年生存率分别为58.0%、40.8%和29.9%,3年肿瘤转移复发率为83.7%,与文献中报道结果相类似[7],提示纳入资料能够反映该患者群体疾病发展趋势,所得结果可靠。
既往有关HCC患者TACE术后生存及复发危险因素的研究结果显示,AFP、Child Pugh分级、总胆红素及合并门静脉侧支循环是影响生存时间的独立危险因素,肿瘤大小、肿瘤数目、肿瘤包膜情况、血管侵犯、分化程度、肝纤维化以及术前AFP和AST水平等是影响HCC复发的独立危险因素[11-12]。本研究多因素分析结果显示,在调整和控制性别、年龄、肿瘤数量及直径等混杂因素的情况下,发现术前AFP、ALT及AST水平为患者3年生存的独立危险因素,AFP、AST水平为肿瘤复发转移的独立危险因素,与既往研究结果相一致;另外,肝功能Child Pugh分级是反应肝功能储备的重要指标,虽然RFA是微创手术,但还是难免对肝脏造成一定损伤,需要相对较好的储备功能进行修复,有研究表明,肝功能B级和C级的患者预后明显差于肝功能A级患者[13]。本研究多因素分析结果显示,同样接受TACE联合RFA治疗后,肝功能B级患者3年内死亡的风险是肝功能A级患者的2.35倍,提示临床实践中对肝功能较差者选择RFA治疗时需慎重,或应在改善其肝功能后再行RFA治疗。有文献报道,TACE治疗分支PVTT疗效优于主干PVTT[14]。本研究中,门脉癌栓发生于左支91例,右支55例,主干4例,混合7例,Cox回归分析结果显示,混合PVTT患者预后最差,其3年内死亡风险是分支PVTT患者的3.46倍,肿瘤复发转移风险是分支PVTT患者的3.77倍;主干PVTT患者3年内死亡风险是分支PVTT患者的3.18倍,肿瘤复发转移风险是分支PVTT患者的3.68倍。
另外,较高的血清ALB水平也是HCC患者术后3年生存和降低肿瘤转移复发风险的保护性因素,分析原因可能为血清ALB由肝脏合成,其浓度能够反应肝脏功能水平,且ALB在维持血液胶体渗透压、体内代谢物质运输及营养等方面起着很重要的作用,并影响患者对抗疾病的能力[15]。
综上所述,TACE联合RFA是治疗HCC合并PVTT的重要手段,其预后受到多种因素的影响,在对患者进行治疗前通过相关因素评价可以更好地选择治疗的适应证,并对患者的预后进行评价,提高HCC治疗水平。另外,本研究也存在以下不足:为单中心、回顾性研究,样本量小,有存在选择性偏倚的风险,因此仍需大样本队列研究进行验证。
[参考文献]
[1] 俞礽爱, 刘佳, 乐弈, 等. 外科手术联合TACE治疗晚期肝癌合并门静脉癌栓的疗效分析 [J]. 中国普通外科杂志, 2015, 24(7): 933-938.
水稻根表铁膜中铁和砷、铁和镉的相关性分析(图2)表明,早稻和晚稻根表铁膜铁和镉(如晚稻,R2=0.993,P=0.0030)、铁和砷(如晚稻R2=0.995,P=0.0024)之间都具有显著相关性,铁膜铁是水稻根际环境中控制镉砷行为的重要因素(Qiao et al.,2018)。但施加零价铁对水稻吸收镉的影响较轻微,这可能是由于零价铁在氧化过程中易于在其表面形成铁氧化物而将其包裹住,反应活性因而相应降低所致。
[2] 陈大朝, 王艺辉, 纪荣佳, 等. TACE联合放疗治疗原发性肝癌合并门静脉癌栓改善患者生存质量 [J]. 现代肿瘤医学, 2017, 25(1): 96-99.
[3] 贾佳, 祁兴顺, 韩国宏. 肝动脉化疗栓塞在肝细胞肝癌合并门静脉癌栓患者中的应用 [J]. 介入放射学杂志, 2014,23(4): 352-356.
[4] 赵增富, 王茹芳, 任庆莹, 等. 肝动脉化疗栓塞联合射频消融治疗肝癌合并门静脉癌栓的疗效分析 [J]. 中国现代普通外科进展, 2014, 17(8): 634-636.
[5] GEORGIADES C S, HONG K, D'ANGELO M, et al. Safety and efficacy of transarterial chemoembolization in patients with unresectable hepatocellular carcinoma and portal vein thrombosis[J]. J Vasc Interv Radiol, 2005, 16(12): 1653-1659.
[6] NIU Z J, MA Y L, KANG P, et al. Transarterial chemoembolization compared with conservative treatment for advanced hepatocellular carcinoma with portal vein tumor thrombus: using a new classification [J]. Med Oncol, 2012,29(4): 2992-2997.
[7] 李梦阁, 赵亚林, 刘晓利, 等. 不同微创治疗方法对HBV相关原发性肝癌合并门静脉癌栓患者的预后影响 [J]. 临床肝胆病杂志, 2017, 33(4): 684-688.
[8] 罗小军, 邓和军, 沈艾, 等. 射频消融联合肝动脉化疗栓塞治疗原发性肝癌的临床观察[J]. 中国肿瘤临床与康复,2016, 4(4): 398-400.
[9] 伍路, 杨业发, 申淑群, 等. 门静脉癌栓微波消融及射频消融治疗80例分析 [J]. 介入放射学杂志, 2016, 25(6): 510-514.
[10] 黄书明, 陈圣开, 张涛. 肝癌切除术联合术后 TACE 对肝癌合并门静脉癌栓患者的治疗效果及预后影响因素分析[J]. 中国医学前沿杂志电子版, 2016, 8(6): 160-164.
[11] 赵鹏, 郑加生, 张洪海, 等. 肝动脉导管化疗栓塞联合 CT引导精准微波消融治疗原发性肝癌的疗效及影响因素[J]. 中华肿瘤杂志, 2016, 38(2): 138-145.
[12] YIN J, ZHANG H, HE Y, et al. Distribution and hepatocellular carcinoma-related viral properties of hepatitis B virus genotypes in Mainland China: a community-based study [J]. Cancer Epidemiol Biomarkers Prev, 2010, 19(3): 777-786.
[13] 李蕊利, 万娟. 原发性肝癌射频消融预后的影响因素分析[J]. 现代肿瘤医学, 2015, 23(20): 2970-2972.
[14] 陈俊伟, 庞鹏飞, 孟晓春, 等. TACE联合索拉非尼治疗原发性肝癌合并不同分型门静脉癌栓的临床观察 [J]. 中华医学杂志, 2013, 93(9): 663-667.
[15] 崔海涛, 赵红梅, 吴艳萍, 等. 血清UA、Alb及sFas水平与原发性肝癌的相关性分析 [J]. 临床合理用药杂志, 2015,8(8A): 136-137.
