阿帕替尼治疗晚期胃癌的疗效预测和预后分析
2018-04-09赵青芳关露露吕慧芳陈贝贝樊鑫鑫王茂勋高晓会郭彦伟陈小兵
赵青芳,关露露,吕慧芳,陈贝贝,樊鑫鑫王茂勋,高晓会,郭彦伟,陈小兵
1.郑州大学附属肿瘤医院,河南省肿瘤医院肿瘤内科,河南 郑州 450000;2.河南科技大学第一附属医院肿瘤内科,河南 洛阳 471003;3.郑州大学第五附属医院肿瘤内科,河南 郑州450052
胃癌是世界第5大常见的恶性肿瘤,也是全球第3大癌症相关死亡原因[1]。尽管部分胃癌患者可接受根治性切除术和辅助化疗,但复发率仍然很高,预后较差。
近年来,不断发展的肿瘤分子生物学技术揭示,血管内皮生长因子(vascular endothelial growth factor,VEGF)和VEGF受体-2(VEGF receptor-2,VEGFR-2)介导的信号转导和血管生成是胃癌发生、发展的重要机制。而阿帕替尼正是一种小分子酪氨酸激酶抑制剂(tyrosine kinase inhibitor,TKI),可高度选择性结合并抑制VEGFR-2,减少内皮细胞迁移、增殖并降低肿瘤微血管密度。Ⅲ期临床研究表明[2],阿帕替尼可改善化疗难治性晚期或转移性胃癌患者的无进展生存期(progression-free survival,PFS)和总生存期(overall survival,OS)。阿帕替尼治疗期间,出现高血压、手足皮肤反应(hand-foot skin reaction,HFSR)等并不少见,早期治疗有效的患者,最终可能对该治疗产生抵抗。因此,寻找合适的疗效预测分子标志物,是抗血管靶向治疗亟待解决的重要问题。本研究主要探讨胃癌患者临床病理特征及治疗相关不良反应与阿帕替尼治疗疗效及预后的关系。
1 资料和方法
1.1 临床资料
选取2015 年1月—2016年8月收治的105例晚期胃癌患者,其临床资料分别来自郑州大学附属肿瘤医院、河南科技大学第一附属医院和郑州大学第五附属医院,三家单位均有完整随访资料。其中,男性65例,女性40例,年龄23~82岁,中位年龄58岁。病理类型:乳头状腺癌3例,管状腺癌19例,低分化腺癌59例,印戒细胞癌18例,黏液腺癌6例。治疗前均行血常规、凝血功能+D-二聚体、肝肾功能+离子四项+血脂、心电图及增强CT等检查。所有患者均满足以下条件:① 经组织病理学确诊胃癌,TNM分期Ⅳ期;② 观察指标明确,可经CT检测病灶大小并评估疗效;③ 二线及以上化疗失败,既往未接受过VEGFR-TKI治疗;④ ECOG评分0~2分,无第二原发肿瘤;⑤ 基础血压正常或经降压药物治疗后收缩压小于等于140 mmHg、舒张压小于等于90 mmHg;⑥ 骨髓储备、肝肾和凝血功能正常。
1.2 治疗方法
口服甲磺酸阿帕替尼片,起始剂量250 mg,每天1次,若患者未出现不良反应或出现1~2级不良反应经对症处理后恢复,在服药1~2周后可增加剂量至500 mg/d和750 mg/d,每28 d为1个周期。每2个周期评价疗效,所有患者持续治疗直至疾病进展(progressive disease,PD)或出现不能耐受的严重不良反应。
1.3 疗效评价及随访观察指标
按照实体肿瘤疗效评价标准(RECIST l.0版)将疗效分为完全缓解(complete response,CR)、部分缓解(partial response,PR)、疾病稳定(stable disease,SD)和PD,(CR+PR)/总例数×100%为客缓解率(objective response rate,ORR),(CR+PR+SD)/总例数×100%为疾病控制率(disease control rate,DCR)。PFS指患者接受治疗开始至肿瘤出现进展或死亡的时间。观察患者不良反应发生率,按照WHO标准进行评价。
1.4 统计学处理
采用SPSS 21.0软件进行统计学分析,率的比较采用χ2检验,Logistic多元回归模型分析各项因素与DCR的关系。生存分析应用Kaplan-Meier法,采用log-rank检验分析影响PFS的各项因素,多因素生存分析采用Cox回归模型。P<0.05为差异有统计学意义。
2 结 果
2.1 治疗相关不良反应发生率
根据WHO标准,本研究随访期间出现的常见不良反应有蛋白尿(40.95%)、高血压(38.10%)、白细胞减少(35.24%)、中性粒细胞减少(30.48%)、出血(26.67%)、血小板减少(23.81%)、HFSR(23.81%)、乏力(19.05%)、腹泻(15.24%)和呕吐(8.57%)。其中Ⅲ~Ⅳ级不良反应发生率较低,患者耐受性较好,主要有高血压(2.86%)、HFSR(4.76%)、蛋白尿(1.90%)、腹泻(1.90%)、白细胞降低(2.86%)、血小板降低(3.81%)、乏力(1.00%)和出血(1.90%)。
2.2 客观疗效及总体生存情况
随访截至2017年2月28日,随访率为96%。105例患者中,进展或死亡96例,删失9例。其中:CR 0例(0.00%),PR 6例(5.71%),SD 63例(60.00%),PD 36例(34.29%),ORR为5.71%,DCR为65.71%。中位PFS(median PFS,mPFS)为71 d(95%CI:50.1~91.9 d)。
2.3 临床特征和不良反应与疗效的关系
采用χ2检验研究治疗前相关临床特征发现,ECOG评分0~1分和2分者DCR分别为72.80%和41.67%,差异有统计学意义(P=0.005,表1),药物剂量250、500和750 mg患者DCR分别为41.67%、72.97%和71.43%,差异有统计学意义(P=0.022,表1)。3种药物剂量两两比较发现,药物剂量250和500 mg患者DCR比较差异有统计学意义(P=0.005)。采用同样的方法分析不良反应与疗效的关系发现,HFSR、高血压、蛋白尿及腹泻者DCR较高(表2)。Logistic多因素分析显示,ECOG评分0~1分、HFSR及高血压与DCR高显著相关(表3)。
2.4 临床特征和不良反应与PFS的关系
采用Kaplan-Meier法作为标准生存分析法,log-rank检验研究与PFS相关因素发现,年龄大于56岁患者PFS(mPFS为92 d,95%CI:75.1~108.9 d)比年龄小于等于56岁患者(mPFS为51 d,95%CI:29.7~72.7 d)延长(P=0.045);ECOG PS 0~1分患者PFS(mPFS为92 d,95%CI:75.6~108.3 d)比2分患者(mPFS为35 d,95%CI为22.9~47.0 d)延长(P<0.001);阿帕替尼250 mg患者mPFS为43 d(95%CI:36.3~49.7 d),500 mg患者mPFS为89 d(95%CI为70.4~107.6 d),750 mg患者mPFS为92 d(95%CI:10.0~174.1 d),3种药物剂量两两比较发现,250和500 mg患者PFS差异有统计学意义(P<0.001),表明剂量500 mg患者PFS较长;高血压患者PFS(mPFS为119 d,95%CI:83.2~154.8 d)比血压正常患者(mPFS为60 d,95%CI:45.2~74.8 d)延长(P=0.002);出现HFSR患者PFS(mPFS为130 d,95%CI:80.2~119.8 d)比无HFSR患者(mPFS为59 d,95%CI:44.8~73.2 d)延长(P=0.001);出现蛋白尿患者PFS(mPFS为105 d,95%CI:58.1~151.9 d)比无蛋白尿患者(mPFS为69 d,95%CI:58.4~79.6 d)延长(P=0.041,表1、2)。Cox多因素分析显示,ECOG评分、药物剂量、HFSR及高血压是阿帕替尼治疗晚期胃癌PFS的独立预后因素,其中,剂量500 mg患者预后较好,250和750 mg患者进展危险性差异无统计学意义(P=0.510,表4)。
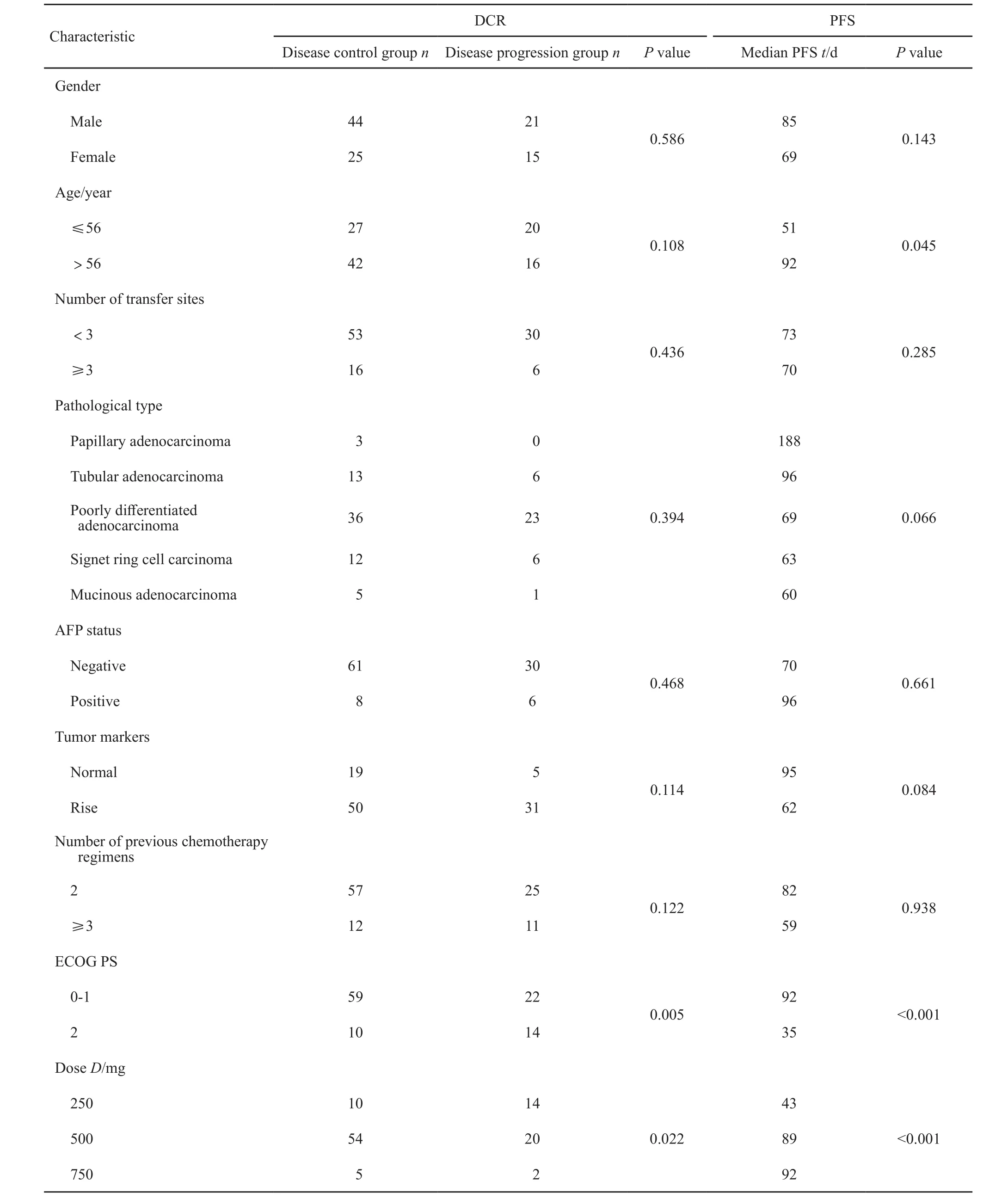
表1 不同临床特征分组间DCR及PFS单因素分析Tab. 1 Univariate analysis of DCR and PFS among different clinical features
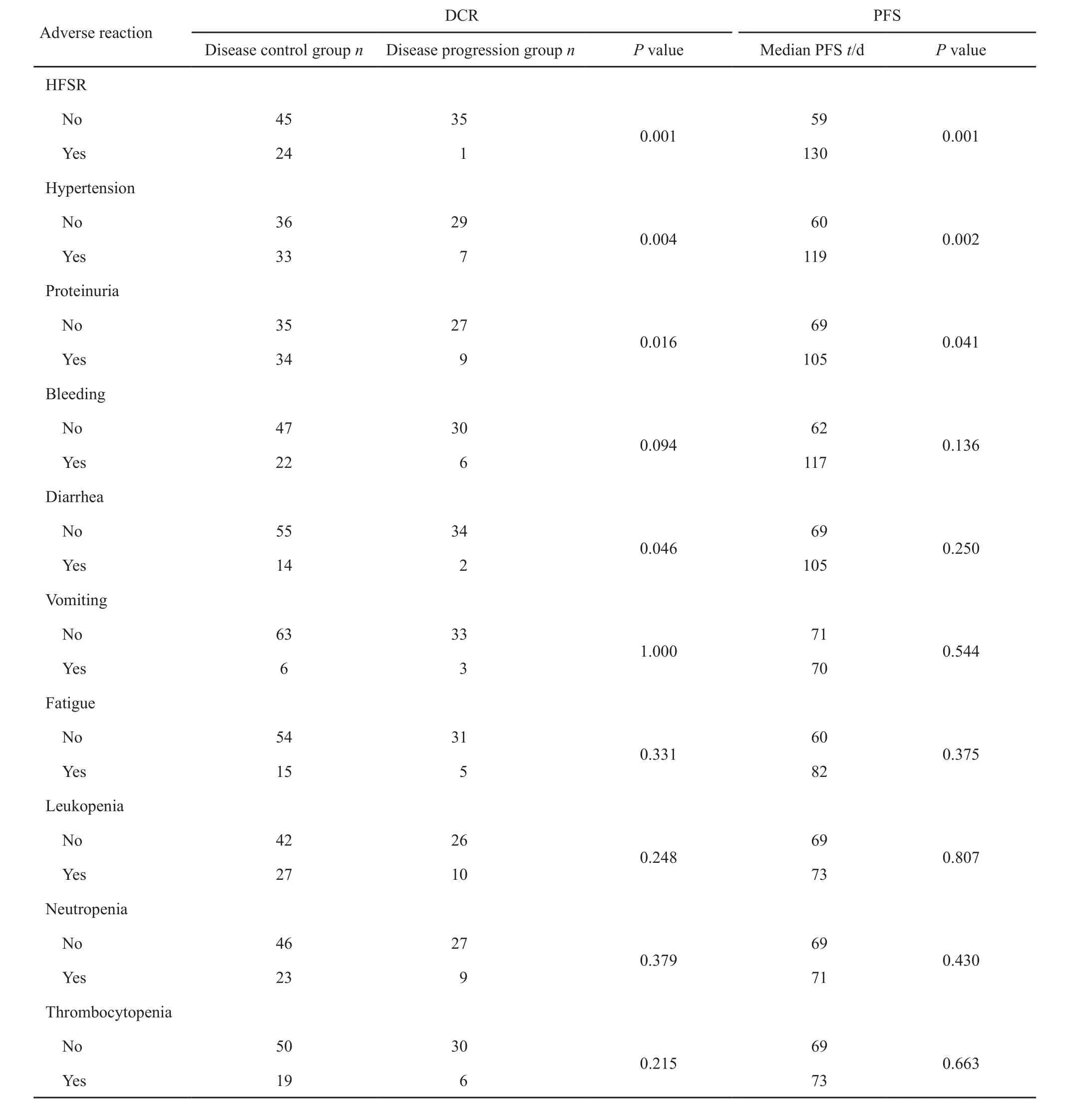
表2 治疗相关不良反应对DCR及PFS的单因素分析Tab. 2 Univariate analysis of disease-related adverse effects on DCR and PFS

表3 阿帕替尼治疗晚期胃癌疗效多因素logistic回归分析Tab. 3 Multivariate logistic regression analysis of apatinib in the treatment of advanced gastric cancer
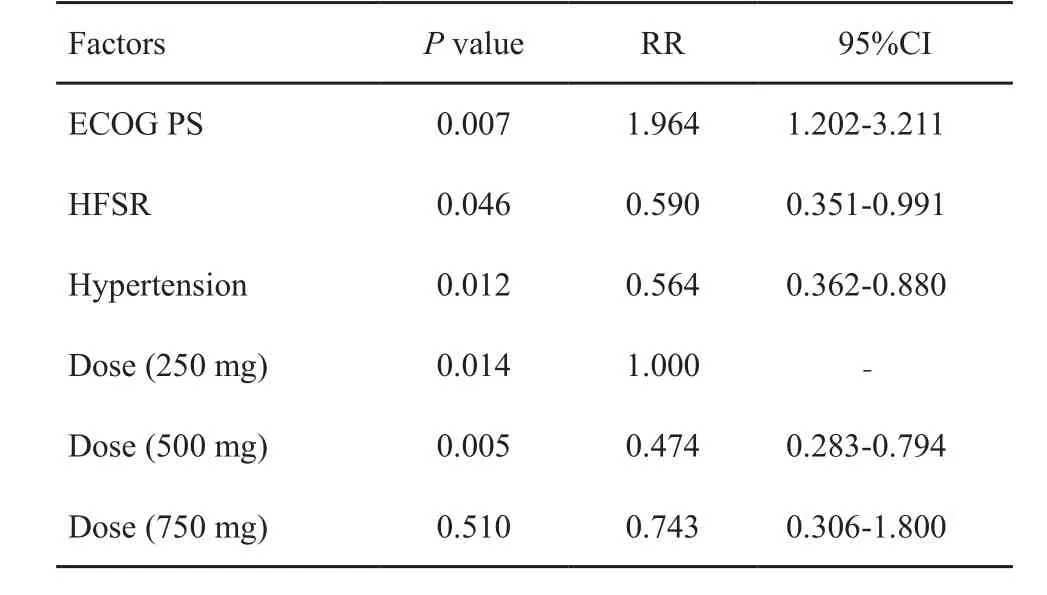
表4 阿帕替尼治疗晚期胃癌PFS多因素Cox回归分析Tab. 4 Multivariate Cox regression analysis of apotatinib in the treatment of advanced gastric cancer
3 讨 论
阿帕替尼可与VEGFR-2结合,通过竞争性抑制VEGF与VEGFR-2结合及VEGFR-2自动磷酸化,可发挥强大的抗肿瘤作用[3]。近期一项晚期胃癌Ⅲ期临床研究结果显示,阿帕替尼组mPFS比安慰剂组明显延长(2.6个月vs 1.8个月,P<0.001)[4]。本研究观察阿帕替尼多线治疗晚期胃癌的疗效,全组患者总体mPFS为71 d,与上述研究结果基本一致。
在临床特征方面,本研究结果显示,ECOG评分可作为DCR和PFS的独立预测因素。阿帕替尼主要抑制肿瘤新生血管形成,而对已形成的肿瘤血管并无显著的退缩或逆转作用,故对肿瘤负荷过大、体质差的患者可能难以获得更好的疗效,因此ECOG评分2分患者DCR较低。Meehan等[5]报道老年肾细胞癌患者微血管密度较年轻患者高,对抗血管靶向药物更加敏感,疗效更佳。本研究单因素分析显示,年龄大于56岁者PFS延长(P=0.045),与上述结果一致。一项Ⅱ期临床研究[6]对比了阿帕替尼850 mg(每天1次)和425 mg(每天2次)患者,其ORR分别为6.38%和13.00%,mPFS分别为3.7和3.2个月。本研究首次进行了药物减量试验,其结果显示,给予阿帕替尼500 mg(每天1次)患者具有较好的疗效且PFS较长,尚需大样本临床试验进一步证实。目前没有研究表明阿帕替尼在血清AFP阳性胃癌(AFP-producing gastric cancer,AFPGC)中的治疗效果。Kamei等[7]研究发现,AFP通过与转录因子相互作用,上调血管内皮生长因子C(VEGF-C)表达,可能与其高侵袭性和不良预后相关。VEGFR-2是VEGF-C的受体之一,由此推测,阿帕替尼可能通过抑制VEGFR-2,减弱VEGF-C的作用从而改善AFPGC预后[8],但本研究中其差异无统计学意义。因此,阿帕替尼是否能逆转AFPGC不良预后,尚有待大样本前瞻性临床试验证实。
Poprach等[9]研究表明,治疗期间出现药物相关不良反应及其程度与治疗获益和维持时间有关。阿帕替尼治疗期间出现的高血压可能归因于其下调一氧化氮的生物利用度,而一氧化氮是一种血管舒张剂,从而引起血管收缩;同时减少肾脏钠离子排泄,导致水钠潴留;而抗血管治疗本身抑制血管内皮功能,导致血管稀疏、血压升高[10]。George等[11]研究发现,有症状的高血压(尤其是3级)与舒尼替尼治疗胃肠间质瘤PFS延长显著相关(P<0.001)。此外,Fan等[12]报道80例经阿帕替尼治疗的乳腺癌,出现治疗相关性高血压(P=0.038)是PFS和临床获益率的独立预测因素。本研究结果显示,出现高血压患者PFS显著延长(P=0.012),DCR较高(P=0.043),与上述研究结果一致。此外,有研究表明,VEGFR-TKIs类药物治疗转移性肾癌期间出现的高血压,随着血压程度的升高,患者中位PFS进一步延长(P=0.006)[13]。
目前HFSR的发病机制尚不十分清楚,可能与VEGFR、血小板衍生生长因子受体(plateletderived growth factor receptor,PDGFR)、RET激酶及FMS样酪氨酸激酶3(FMS-like tyrosine kinase-3,Flt-3)信号转导通路有关[14]。TKI抑制VEGF和PDGF,导致毛细血管损伤,当手足等部位在日常活动中受到压力等机械损伤时,可出现伴随炎性反应症状的HFSR。有研究发现,既往接受过TKI治疗的患者再次接受另外一种TKI治疗时,HFSR程度会减弱[15]。在一项舒尼替尼治疗转移性肾癌的研究中,Poprach等[9]的研究发现,治疗期间出现HFSR患者PFS(P=0.007)和OS(P=0.027)均延长。本研究显示,出现HFSR患者PFS显著延长(P=0.046),DCR更高(P=0.012)。
另一个备受争议的不良反应是蛋白尿。VEGF在维持肾小球功能方面可能与以下机制有关。肾小球的足细胞和内皮细胞表达VEGFR-2,与VEGFA结合后,VEGFR2磷酸化,从而调节肌动蛋白重组和聚合并导致足细胞形态变化,维持肾小球的结构和功能。而阿帕替尼抑制VEGFR-2磷酸化,导致内皮细胞增生和蛋白尿[16],可以作为治疗有效的一项指标。本研究单因素分析结果显示,有蛋白尿的患者DCR较高(P=0.016),PFS延长(P=0.041),而多因素分析未显示蛋白尿是阿帕替尼治疗的独立预后因素。
综上所述,阿帕替尼治疗晚期胃癌期间,出现HFSR、高血压相关不良反应可作为疗效及PFS的预测指标,同时ECOG评分也不容忽视。在临床应用中,阿帕替尼500 mg(每天1次)的剂量可能有较好的安全性和受益性。由于阿帕替尼是多靶点激酶抑制剂,尚需扩大样本量从基因检测水平进行广泛深入的研究,以更好地实现胃癌的个体化治疗。
[参考文献]
[1] NETWORK T C G A. Comprehensive molecular characterization of gastric adenocarcinoma[J]. Nature, 2014, 513(7517): 202-209.
[2] QIN S K. Phase Ⅲ study of Apatinib in advanced gastric cancer:a randomized, double-blind, placebo-controlled trial[J]. J Clin Oncol, 2014, 32(suppl): a4003.
[3] ZHANG H. Apatinib for molecular targeted therapy in tumor[J]. Drug Des Devel Ther, 2015, 9(11): 6075-6081.
[4] LI J, QIN S, XU J, et al. Randomized, double-blind,placebo-controlled phase Ⅲ trial of apatinib in patients with chemotherapy-refractory advanced or metastatic adenocarcinoma of the stomach or gastroesophageal junction[J]. J Clin Oncol, 2016(3): 1448-1454.
[5] MEEHAN B, APPU S, ST CROIX B, et al. Age-related properties of the tumour vasculature in renal cell carcinoma[J]. BJU Int, 2011, 107(3): 416-424.
[6] LI J, QIN S, XU J, et al. Apatinib for chemotherapy-refractory advanced metastatic gastric cancer: results from a randomized,placebo-controlled, parallel-arm, phase Ⅱ trial[J]. J Clin Oncol, 2013, 31(26): 3219-3225.
[7] KAMEI S, KONO K, AMEMIYA H, et al. Evaluation of VEGF and VEGF-C expression in gastric cancer cells producing alpha-fetoprotein[J]. J Gastroenterol, 2003, 38(6): 540-547.
[8] ZHU X R, ZHU M L, WANG Q, et al. A case report of targeted therapy with apatinib in a patient with advanced gastric cancer and high serum level of alpha-fetoprotein[J]. Medicine,2016, 95(37): e4610-4613.
[9] POPRACH A, PAVLIK T, MELICHAR B, et al. Skin toxicity and efficacy of sunitinib and sorafenib in metastatic renal cell carcinoma: a national registry-based study[J]. Ann Oncol,2012, 23(12): 3137-3143.
[10] VAN HEECKEREN W J, ORTIZ J, COONEY M M, et al. Hypertension, proteinuria, and antagonism of vascular endothelial growth factor signaling: clinical toxicity, therapeutic target, or novel biomarker?[J]. J Clin Oncol, 2007, 25(21):2993-2995.
[11] GEORGE S, REICHARDT P, LECHNER T, et al. Hypertension as a potential biomarker of efficacy in patients with gastrointestinal stromal tumor treated with sunitinib[J]. Ann Oncol, 2012, 23(12): 3180-3187.
[12] FAN M, ZHANG J, WANG Z, et al. Phosphorylated VEGFR2 and hypertension: potential biomarkers to indicate VEGF-dependency of advanced breast cancer in anti-angiogenic therapy[J]. Breast Cancer Res Treat, 2014, 143(1): 141-151.
[13] 宋岩, 杜春霞, 张雯, 等. 治疗相关高血压与血管内皮生长因子受体酪氨酸激酶抑制剂治疗转移性肾细胞癌疗效的关系[J]. 中华肿瘤杂志, 2016, 38(9): 698-702.
[14] CHU D, LACOUTURE M E, WEINER E, et al. Risk of handfoot skin reaction with the multitargeted kinase inhibitor sunitinib in patients with renal cell and non-renal cell carcinoma: a meta analysis[J]. Clin Genitourin Cancer, 2009,7(1): 11-19.
[15] BUCHLER T, KLAPKA R, MELICHAR B, et a1. Sunitinib followed by sorafenib or vice versa for metastatic renal cell carcinoma-data from the Czech registry[J]. Ann Oncol,2012, 23(2): 395-401.
[16] WANG H, YUE Z, WU J, et al. The accumulation of VEGFA in the glomerular basement membrane and its relationship with podocyte injury and proteinuria in Alport syndrome[J]. Plos One, 2015, 10(8): e0135648.
