单中心高度恶性软组织肉瘤的诊疗经验
2018-04-09杨荣利汤小东李大森
孙 馨,郭 卫,杨荣利,汤小东,唐 顺,李大森
北京大学人民医院骨与软组织肿瘤治疗中心,北京 100044
软组织肉瘤是指起源于间叶组织的恶性肿瘤,已知的组织学亚型有50多种,生物学行为各异,预后也不同。高度恶性软组织肉瘤是指肿瘤细胞分化程度差,具有多形性、凝固性坏死及核分裂相。其具体肿瘤类型包括Ⅲ/Ⅳ级的纤维肉瘤、高级别未分化多形性肉瘤、高级别脂肪肉瘤、深部平滑肌肉瘤、横纹肌肉瘤、血管外皮细胞瘤、滑膜肉瘤、恶性外周神经鞘瘤、神经母细胞瘤、透明细胞瘤、神经外胚层瘤、软组织骨肉瘤、上皮样肉瘤和腺泡状软组织肉瘤。与低度恶性的病灶相比,高度恶性软组织肉瘤更容易发生转移(转移率:>50% vs<15%),预后也更差(5年生存率:40%~60%vs 90%~98%)[1]。
本文总结了北京大学人民医院骨与软组织肿瘤治疗中心10余年的诊治经验,并运用统计学方法分析影响高度恶性软组织肉瘤的预后因素,以期在治疗早期预测患者预后情况,制定更为合理的个体化治疗方案,从而提高疗效。
1 资料和方法
1.1 临床资料
2000年7月—2014年7月,北京大学人民医院共收治499例高度恶性软组织肉瘤患者。其中,473例患者接受手术及辅助治疗,病历资料完整,均登记在北京大学人民医院骨与软组织肿瘤治疗中心随访数据库,按照登记要求术后每6个月接受手术局部B超或MRI检查,且每年接受全身系统检查以明确有无复发转移情况。
患者男女比例为268∶205。平均年龄为46岁(2~87岁),约60%的患者患病年龄在40岁以上。肿瘤常见于四肢,共348例,2/3的患者发生在下肢深方软组织;发生在躯干部的肿瘤有126例。共有19种组织病理类型。
共有374例患者为原发初治肿瘤;其余99例患者在外院接受过手术治疗,就诊时有肿瘤残留或复发。就诊后患者均接受系统检查(患病部位行CT、MRI检查;其他检查包括:肺部CT、头部CT检查、骨扫描或PET/CT检查)。初治肿瘤中,185例患者接受术前穿刺或切开活检。77例患者接受术前放化疗以减少肿瘤负荷、缩小肿瘤范围,其中34例行术前化疗,56例行术前局部放疗(剂量控制在50 Gy左右)。
400例患者接受保肢手术以最大限度保留功能,其中165例患者进行了骨与关节重建,61例患者接受血管重建,98例患者接受游离植皮、皮瓣移植等软组织重建。302例患者只接受单次手术;由于出现复发及转移等问题,其余171例患者接受2~7次手术,总手术次数为706次。
全部374例初治患者手术切缘经病理诊断均没有发现肿瘤细胞残留,其中331例(88.50%)能达到广泛或根治性切除边界(在正常组织中切除肿瘤或切除整个受累间室),43例(11.50%)只能达到边缘性切除(在假包膜外、反应区内切除肿瘤)。
370例患者在北京大学人民医院骨与软组织肿瘤治疗中心继续接受术后辅助化疗;153例患者针对手术部位接受了局部放疗(放疗剂量为40~70 Gy)。放疗增加了局部伤口发生并发症的风险[2],共77例(50.3%)患者出现放疗区域伤口延迟愈合、不愈合等问题(表1)。
1.2 随访资料
随访时间计算方法为从患者就诊之日起,截至2014年7月1日,或患者死亡之日。平均随访时间为46.9个月(8.0~127.0个月),中位随访时间为43.0个月。其中47例随访时间不足3年,142例随访时间不足5年,138例随访时间超过10年。随访内容包括登记随访日期、患者生存情况、复发转移情况及保肢患者术后功能情况,扫描复制随访期间影像学资料及其他化验检查资料。
1.3 统计学处理
用Cox模型做高度恶性软组织肉瘤预后的因素分析:将选定的12个特征性临床因素的有关资料进行量化、赋值。生存时间按月计算,以确诊时间至末次随诊所获得的截止时间为准,死于其他疾病者作为失访,利用累积生存率,通过拟然比进行单因素分析,随后对初步筛选出的显著性因素进行Cox模型多因素分析。采用SPSS 19.0统计软件对数据进行处理,P<0.05为差异有统计学意义。
2 结 果
2.1 复发情况
103例(21.8%)患者术后出现局部复发,平均复发间期为13.3个月(2.0~35.0个月)。原发初治患者的复发间期明显长于复发患者(16.2个月vs 10.7个月)。手术切缘直接影响局部复发率(P=0.004),肿瘤局部复发次数越多,污染区域越大,广泛切除难度越高,而复发风险也随之升高(P=0.000)。通过χ2检验分析,性别、年龄及肿瘤发病部位与局部复发率无明显相关。手术方式的选择(保肢还是截肢术)及是否接受辅助治疗并不是影响局部肿瘤进展的相关因素(P>0.05) 。

表1 473例高度恶性软组织肉瘤基本情况Tab. 1 Clinical data of 473 patients with high-grade soft tissue sarcoma
2.2 转移情况
本组患者中,39例患者就诊时即存在远处转移,另有109例患者随访期内出现不同程度的转移。111例患者发现肺转移,大多数为双肺多发转移。33例患者出现淋巴结转移,13例患者出现骨转移,11例患者出现远处软组织转移。另有少数患者出现脑转移及腹膜后软组织转移。
性别、年龄及肿瘤部位与转移比率无明显相关性(P>0.05)。非计划性切除导致肿瘤残留或术后复发而需要二次手术的患者转移率较高(P=0.003)。多次复发、多次手术的患者,更易发生远处转移(P=0.003)。采取何种手术方式都不影响患者的转移情况(P=0.229)。只有广泛或根治的外科切除范围(P=0.000)及接受全身系统性化疗(P=0.000)才能有效地控制肿瘤沿血液循环、淋巴循环系统向远处转移。
2.3 生存情况及预后因素分析
至随访截止时,258例(54.5%)患者没有任何转移或复发征象,101例(21.4%)患者带瘤生存。另外107例(24.1%)患者死于肿瘤及肿瘤并发症,中位死亡时间为31.0个月(8.0~109.0个月);7例(1.5%)患者死于肿瘤外其他原因。3、5和10年的总生存率分别为82.6%、69.0%和58.7%;而无病生存率分别为73.8%、52.1%和23.4%。性别、年龄及肿瘤部位等因素的差异并不影响患者的累积生存率。
不同组织学类型的患者的预后情况差异有统计学意义(P=0.001)。在更易发生远处转移的肿瘤中,黑色素瘤及透明细胞肉瘤的患者死亡比例最高(50%,8/16),中位生存期为44个月,5年总生存率仅为44.1%。而44例纤维肉瘤患者中仅有4例(9.1%)死亡,中位生存期为82.0个月,5年总生存率(83.8%)高于其他肿瘤患者。
对本组数据进行单因素分析,结果显示,就诊时机、治疗方式影响肿瘤的预后。原发初治患者的预后情况好于复发肿瘤患者(P=0.000)。对初治的肿瘤,我们尽可能计划性地进行广泛乃至根治性切除(P=0.001)。随着手术次数的增加,患者的无病生存率逐步下降(P=0.020)。化疗相对敏感的肿瘤患者,应该接受术后辅助性化疗,降低复发及转移风险(P=0.020);术前有转移或累及范围较大的肿瘤患者,还应考虑新辅助化疗,以提高保肢手术的概率。保肢或截肢治疗不影响患者生存情况(P=0.189),局部放疗也不影响患者生存情况(P=0.766)。
建立Cox模型多因素回归分析,肿瘤的组织学类型、辅助化疗及转移情况是影响患者预后的危险因素(表2)。
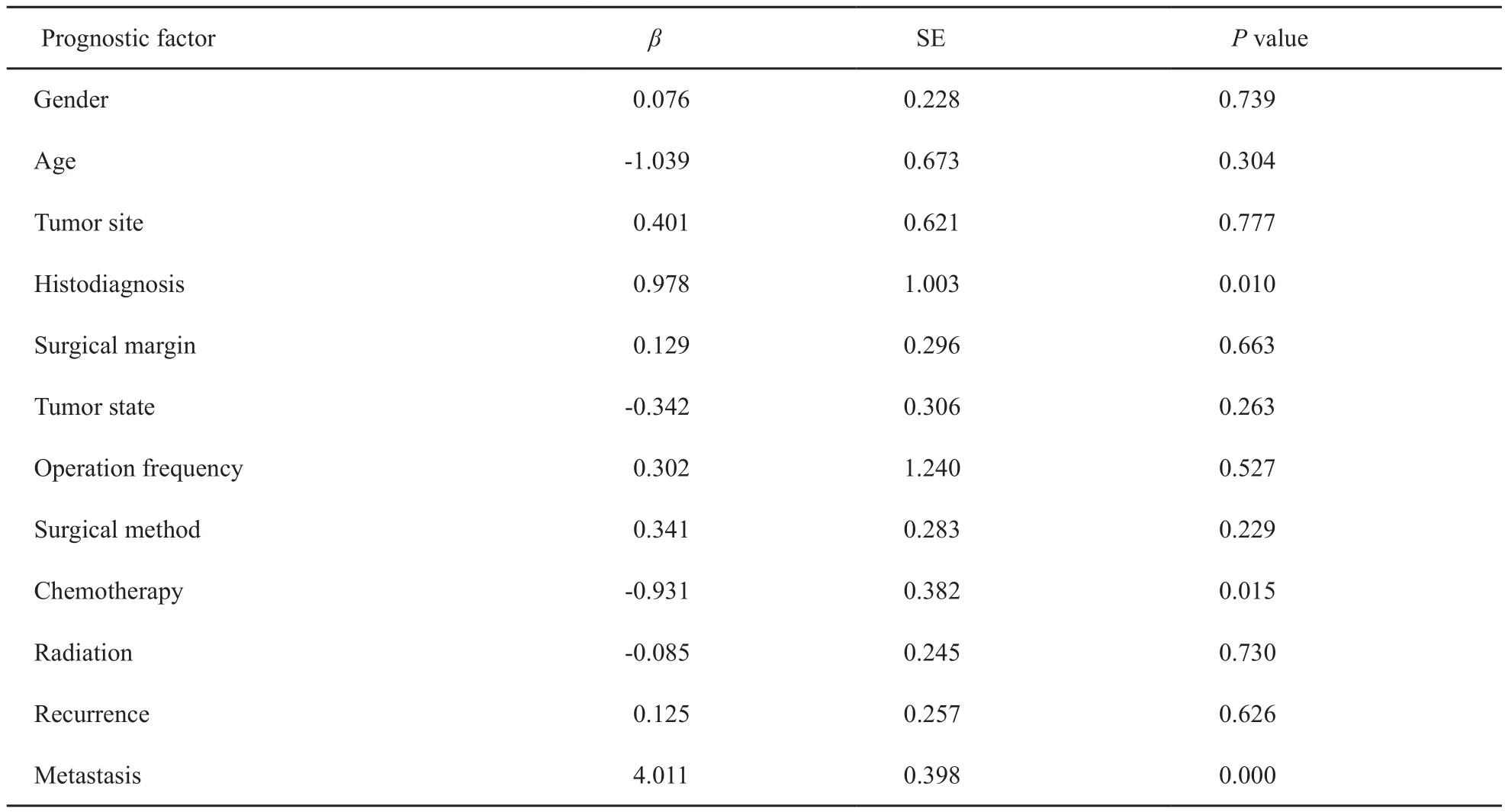
表2 473例高度恶性软组织肉瘤患者预后情况的多因素分析Tab. 2 Multivariate predictors of overall survival in 473 patients with high-grade soft tissue sarcoma
3 讨 论
对任何怀疑软组织肉瘤的患者都应进行活检,根据临床病史、影像学检查资料及病理结果明确肿瘤性质。对原发初治软组织肿瘤患者,如果存在如下4种临床表现,则高度怀疑为软组织肉瘤:体积迅速增加,肿块直径大于5 cm,累及深筋膜层深部,有疼痛症状。经过确诊的软组织肉瘤根据自然病程及治疗的不同,提供个体化的治疗。
不同的肿瘤类型,生物学行为不同:有些倾向于转移,有些倾向于局部浸润;有些对化疗敏感,有些只能靠手术切除治疗[3]。总体而言,黑色素瘤、原始神经外胚层肿瘤等虽然对化疗等治疗敏感,但仍进展迅速,预后差;腺泡状横纹肌肉瘤、滑膜肉瘤及高级别未分化多形性肉瘤等对化疗不敏感,也极易复发转移,预后也不乐观。
手术边界是外科治疗首先要考虑的问题。不管是选择截肢术,还是切除受累的血管神经,我们尽可能保证安全边界,才能有效地降低复发风险。尤其是对于浸润性生长的纤维系统肉瘤,切除范围要结合MRI诊断结果及术中情况,如有必要则进行术中快速冰冻病理检查辅助判断。但是对于已经有广泛转移的患者,不宜采取截肢术而影响患者有限生存时间内的生活质量。
对于复发肿瘤患者,在不能判断边界情况或正常组织污染的情况下,我们选择二次扩大切除的边界更要尽可能达到广泛乃至根治性切除,使其获得与原发初治患者相似的总生存期。Hanasilo等[4]的最近研究也显示,两者在复发及总生存率上的差异无统计学意义。
软组织肉瘤的生长以局部浸润或沿肌束间蔓延为主,假包膜外微转移是复发的主要原因。应尽可能切除肿瘤边缘2 cm范围内的正常组织,以降低局部复发风险。Trovik等[5]的研究显示,不安全的手术边界是复发的重要因素,但并不与转移相关;而复发和预后的关系,仍有争议。Gronchi等[6]研究发现,在研究的1 017例软组织肉瘤患者中,复发患者的死亡率为原发初治患者的3.7倍。我们建议术前尽可能明确肿瘤性质,制定缜密的手术方案,尽可能获得安全的手术边界。
本研究的患者中,腺泡状软组织肉瘤及黑色素瘤极易发生远处转移,而且转移部位多为肺、脑等重要器官,死亡率高于其他肿瘤。一旦发生远处转移,就预示着患者预后不良[3],3年生存率不足30%[7]。
本研究中,患者的转移情况主要受肿瘤侵袭的影响(P=0.000),另外有计划的广泛性切除手术能最大限度地减少肿瘤负荷并延长带瘤生存时间(P=0.000),能够降低远处转移风险。我们的经验是对于显微镜下级别高、生物学行为倾向于转移的软组织肉瘤,如黑素瘤、透明细胞肉瘤、腺泡状软组织肉瘤、横纹肌肉瘤及原始神经外胚层肿瘤等归为高危组,对这些患者应在明确诊断后,根据个体情况开展新辅助化疗或术后放化疗等综合治疗,密切观察全身转移情况,尽早对转移部位给予干预措施,以延长患者的生存时间[7]。
软组织肿瘤生物学行为各异,放化疗敏感性不一,为患者选择合适的手术及术前、术后辅助放化疗方案是降低复发、转移率,改善预后的重要手段[3]。
术前、术后辅助化疗能有效防止肿瘤的转移,尤其是对于化疗敏感的肿瘤(P=0.015),能延长患者生存时间。我们建议大多数高度恶性软组织肉瘤患者在能耐受化疗不良反应的情况下宜采取多药联合化疗,降低远处转移风险,提高总体生存率。
对于高度恶性肿瘤的患者来说,术前放疗可有效杀灭肿瘤外部或周边需氧的肿瘤细胞,术后辅助放疗可以提高肿瘤的局部控制率。Dickie等[8]总结了768例手术辅助放疗的软组织肉瘤患者的治疗经验,对于边缘性甚至病灶内切除肿瘤的患者,放疗可以降低切缘的复发率。本研究患者在术前及术后放疗中获益。因此,建议对边缘性切除或复发的高度恶性软组织肉瘤患者给予术后局部放疗。应慎重采用术前放疗,以避免造成软组织条件差,不能覆盖缺损面。
本研究的部分患者,由于肿瘤局部复发不具备切除条件或多处转移且不能耐受化疗等治疗,对其肿瘤进行免疫组织化学检测或基因分型,选择合适的靶向药物(帕唑帕尼、阿帕替尼及依维莫司等),也会使患者获益[9]。
高度恶性软组织肉瘤类型多样,部位多变,生物学行为不同,复发转移风险高,预后不乐观。治疗目标是延长患者的生存时间,降低复发风险,最大程度保留肢体功能。建议对高度恶性软组织肉瘤患者采取手术联合辅助治疗的综合性个体化治疗。尤其对初治的患者,应尽可能采取计划性的广泛切除术,避免由于首次治疗不当而增加手术次数,进而影响患者预后。
综上所述,我们应根据肿瘤大小、位置、周围组织情况及患者全身情况来制定合适的手术方式;根据肿瘤组织学类型,采取合适的辅助治疗手段。
[参考文献]
[1] KATTAN M W, LEUNG D H, BRENNAN M F. Postoperative nomogram for 12-year sarcoma-specific death [J]. J Clin Oncol, 2002, 20(3): 791-796.
[2] EL-BARED N, WONG P, WANG D. Soft tissue sarcoma and radiation therapy advances, impact on toxicity [J]. Curr Treat Options Oncol, 2015, 16(5): 19.
[3] RAVI V, PATEL S. Adjuvant chemotherapy for soft tissue sarcomas [J]. Surg Oncol Clin N Am, 2012, 21(2): 243-253.
[4] HANASILO C E, CASADEI M S, AULETTA L, et al.Comparative study of planned and unplanned excisions for the treatment of soft tissue sarcoma of the extremities [J].Clinics (Sao Paulo), 2014, 69(9): 579-584.
[5] TROVIK C S, BAUER H C, ALVEGARD T A, et al.Surgical margins, local recurrence and metastasis in soft tissue sarcomas: 559 surgically-treated patients from the Scandinavian Sarcoma Group Register [J]. Eur J Cancer,2000, 36(6): 710-716.
[6] GRONCHI A, MICELI R, FIORE M, et al. Extremity soft tissue sarcoma: adding to the prognostic meaning of local failure [J]. Ann Surg Oncol, 2007, 14(5): 1583-1590.
[7] KANG S, KIM H S, KIM S, et al. Post-metastasis survival in extremity soft tissue sarcoma: a recursive partitioning analysis of prognostic factors [J]. Eur J Cancer, 2014, 50(9): 1649-1656.
[8] DICKIE C I, GRIFFIN A M, PARENT A L, et al. The relationship between local recurrence and radiotherapy treatment volume for soft tissue sarcomas treated with external beam radiotherapy and function preservation surgery [J].Int J Radiat Oncol Biol Phys, 2012, 82(4): 1528-1534.
[9] FREZZA A M, STACCHIOTTI S, GRONCHI A. Highlights in soft tissue sarcomas and gastrointestinal stromal tumours(GIST) trials reported at ASCO 2017 annual meeting [J].BMC Medic, 2017, 15(1): 160.
