利用CRISPR/Cas9技术编辑粒长基因GS3改善粳稻花时
2018-04-09孟帅徐鹏张迎信王宏曹立勇程式华沈希宏
孟帅 徐鹏 张迎信 王宏 曹立勇 程式华 沈希宏
利用CRISPR/Cas9技术编辑粒长基因改善粳稻花时
孟帅 徐鹏 张迎信 王宏 曹立勇 程式华 沈希宏*
(中国水稻研究所/浙江省超级稻研究重点实验室/水稻生物学国家重点实验室,杭州 311401;)
【目的】花时不遇是影响杂交水稻制种产量的直接因素之一,已有研究表明水稻粒型差异对花时有影响。本研究采用功能缺失突变来研究粳稻花时差异,以期为粒型影响花时提供佐证。【方法】利用CRISPR/Cas9技术来定向编辑控制粒长基因,获得13对粒型差异的近等基因系粳稻,小区种植,采用目测法来调查花时。【结果】获得转基因T0植株并对其T1植株测序分析,发现长白25、吉粳102、浙粳88、武运粳27和J42均发生单碱基插入移码突变,垦鉴稻6号、空育131、浙粳22、扬粳4227、南粳9108、J5933、J6167和J5938均发生部分碱基缺失突变。对T1植株粒型考查表明,突变体的粒长均显著长于野生型。对稳定的后代花时统计分析发现,粒型变长的突变体均比野生型花时有所提前,且吉粳102、空育131、浙粳88、武运粳27、扬粳4227这5个材料的突变体花时均显著早于野生型,其余材料开花也提早,但不显著。【结论】长粒型粳稻突变体的花时早于短粒粳稻野生型,这一研究可为粳稻粒型育种提供参考,加速长粒粳稻亲本选育,有望推动杂交粳稻发展。
粳稻;花时;CRISPR/Cas9;
我国水稻的种植面积约3067 万hm2,其中粳稻种植面积约占21.7%,而杂交粳稻的种植面积仅占粳稻播种面积的5%[1-3],相比杂交籼稻而言,杂交粳稻的发展相对缓慢,应用十分有限,其中制种产量低是影响杂交粳稻发展的主要因素之一[4-5]。粳稻开花习性差是制约制种产量的主要因素,主要表现在开花不集中且分散,高峰期不明显[6]。
对于杂交水稻育种而言,不育系柱头外露是一个优良性状,柱头外露有利于水稻异花授粉,从而提高异交结实率。研究表明,粳稻的柱头一般不外露或者外露率很低[7],选育柱头外露率高的粳稻材料相对较难。除了选择柱头外露率高的材料外,田大成等[8]认为花时不遇对粳稻异交结实特性影响较大。造成这一差异的因素主要有3种,即花器官特性、品种类型间差异、谷粒的长宽比[9]。近年来,随着杂交水稻亲本开花习性研究的不断深入[10],同一亚种(籼稻或粳稻)水稻,其开花习性也存在差异。谷粒越长,开花越早;谷粒越圆,开花越迟[11-13],而这在粳稻品种中尤为突出,但对这一现象目前还缺乏系统深入研究,其分子调控机制还不十分清楚。由于谷粒长度和长宽比具有稳定的遗传特性,因此,粒型可作为现今选育早花时不育系的一种参考[14],可望通过改变谷粒的长度和长宽比来调整水稻开花早晚的问题。
是第一个被克隆调控粒型的基因,主要调控水稻粒长和粒重的主效QTL。当其N端调控器官大小的结构域(OSR)发生功能缺失突变后,会导致水稻籽粒变长[15-17]。CRISPR/Cas9(Clustered Regularly Interspaced Short Palindromic Repeats/ CRISPR-associated Protein 9)[18-20]是近几年来发展起来的一种对基因进行编辑的技术,该技术操作简便,效率高,安全可靠且成本较低[21-23]。研究者利用CRISPR/Cas9技术对拟南芥、水稻等植物进行了基因编辑[24-26]。Shan等[27]利用CRISPR/Cas9技术对水稻基因和实现编辑,该技术在水稻基因编辑中开创了先例,与此同时,基因编辑技术也给花时研究提供了一种新的技术途径与方法。
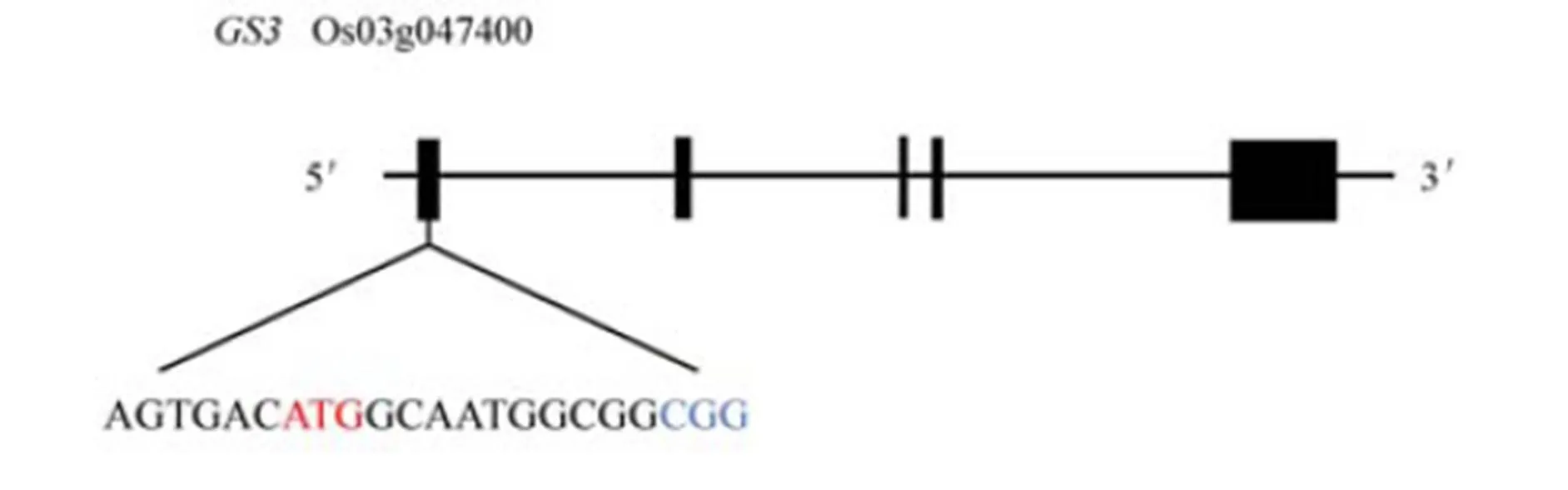
红色字母表示起始密码子,蓝色字母表示PAM序列。线条表示内含子,黑盒子代表外显子。
Fig. 1. Schematic diagram of the geneand the targeted site.
本研究主要利用CRISPR/Cas9技术对控制粒长主效基因进行编辑,通过改善水稻粒长及长宽比来探究花时差异,进而为粳稻育种研究提供理论依据。
1 材料与方法
1.1 试验材料
13对近等基因系材料,来自长白25、吉粳102、空育131、垦鉴稻6号、浙粳22、浙粳88、武运粳27、扬粳4227、南粳9108、J5933、J6167、J5938、J42及它们的基因编辑突变体。T1植株2016年冬季种植于中国水稻研究所海南陵水转基因试验基地,进行阳性株鉴定、基因型检测和粒型等性状的调查;T2植株夏季种植于中国水稻研究所富阳转基因试验基地,2017年5月22日、6月5日、6月20日分3期播种,温室内于7月22日播种,调查开花。
1.2 靶位点的选择及验证
根据CRISPR/Cas9系统识别前间区序列邻近基序(Protospacer Adjacent Motif, PAM),在上游约20个核苷酸序列处设计靶位点序列AGTGACATG GCAATGGCGG,并添加接头引物GS3-CAS9,靶位点的特异性通过Cas-OFFinder (http://www. rgenome.net/cas-offinder/)分析和水稻基因组BLAST分析验证,最终将靶序列选在第1外显子上(图1)。
1.3 CRISPR/Cas9表达载体的构建及基因编辑
本研究所用中间载体SK-gRNA和表达载体PC1300-Cas9由中国水稻研究所基因资源挖掘课题组提供。利用试剂盒快速把sgRNA靶位点序列插入中间载体SK-gRNA中,然后将含有靶位点的序列用酶Ⅰ(Ferment公司产品)切割下来,最后再用T4(NEB公司)连接酶连接至最终载体PC1300-Cas9上。用载体引物T3及引物GS3-CAS9R对构建的最终载体测序分析(测序由杭州擎科梓熙生物技术有限公司完成),验证质粒构建正确。后期送公司完成转农杆菌转化水稻愈伤,并获得T0代转基因植株。

表1 本研究所用引物
1.4 引物
本研究所用的引物见表1,引物由杭州擎科梓熙生物技术有限公司合成。
1.5 T0代阳性株及基因型的检测
用CTAB法[28]提取转基因T0代植株叶片DNA,放置在-20℃冰箱中保存。分别用设计的潮霉素引物HygF/R和载体引物CAS9F/R扩增,然后将提取的DNA进行PCR扩增实验,PCR体系如下:2×Master Mix 7.5 μL,前后引物(10 μmol/L)各0.5 μL,DNA 1 μL,ddH2O 5.5 μL。PCR程序如下:94℃下90 s;94℃下30 s;57℃下30 s;72℃下30 s;72℃下5 min;10℃下5 min。PCR产物用2%琼脂糖凝胶进行电泳,电泳结束后用EB溶液染色并拍照。能跑出条带的说明是阳性植株,然后进行基因型的检测。
1.6 靶位点的检测
为了检测靶位点的突变类型,我们设计引物GS3-F/G来扩增T0代阳性株的目的片段,将含有目的片段的样品送测序公司测序分析。纯合体出现单峰,杂合体出现双峰,对于杂合株可用在线软件工具DSDecode(http://dsdecode.scgene.com/)进行峰图分析,以获得杂合突变信息[29-30]。
1.7 突变体表型分析
在抽穗期选取同一背景下野生型和突变体植株各6株,分别观察记录抽穗日期,取其平均值。同时在成熟期测量其株高,并选取所选每个单株的主穗,考查植株粒型。将种子烘干,每个单株随机选择50粒饱满的种子测量粒长、粒宽及长宽比。获得的数据用Microsoft Excel 2010进行统计分析。
1.8 花时调查
采用目测法[31]调查水稻花时。分别进行田间和温室试验。田间每份材料种植6株,作为一个小区,每期每株调查7 d的花时,取每份材料花时的平均值。温室的光温参数如下:7:30-19:30, 30℃, 相对湿度为75%;19:31-次日7:30, 24℃, 相对湿度为85%。温室内,每份材料种植3株,每株调查5 d的花时,取平均值。花时统计以午夜0点为基准,用分钟来表示。
2 结果与分析
2.1 CRISPR/Cas9表达载体的构建
已知基因是调控粒长的主效基因,通过对该基因的序列分析发现,该基因由5个外显子组成,编码一个由232个氨基酸组成的跨膜蛋白,而该基因编码的蛋白对粒型起负调控作用。在第1外显子上选取一条长度为20 bp特异性较好的靶位点序列,并将其构建到中间载体上后再连接到表达载体中,用于开展转基因实验(图2)。
2.2 获取转基因阳性植株
将带有靶位点的表达载体通过农杆菌转化到受体材料内并获得转基因T0植株,然后通过载体引物CAS9来鉴定载体是否成功整合到植株体的基因组内。分别获得长白25、吉粳102、空育131、垦鉴稻6号、浙粳22、浙粳88、武运粳27、扬粳4227、南粳9108、J5933、J6167、J5938和J42转基因阳性株苗32、38、42、45、40、55、40、33、56、33、38、39、45株。将这13份突变材料分别种植于海南获得T1植株。
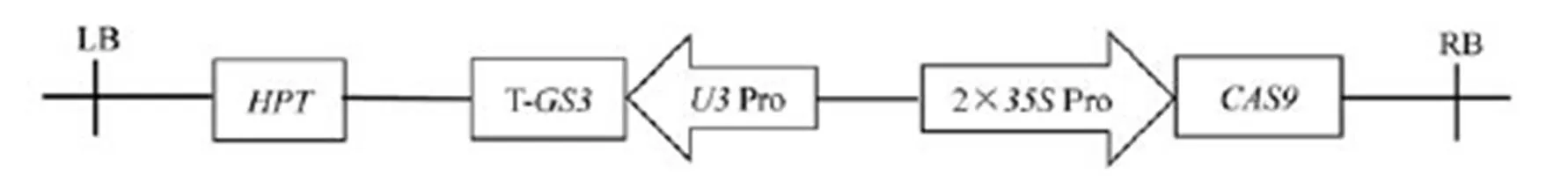
HPT-潮霉素磷酸转移酶基因;LB-左边界;RB-右边界;Cas9蛋白的启动子是35S;GS3的sgRNA的启动子为U3。
Fig. 2. Schematic diagram illustrating the structure of CRISPR/Cas9-expressing vector targeting with.

靶序列为红色部分,PAM序列用蓝色部分,碱基插入的用蓝色小写字母表示,缺碱基的用蓝色连字表示。WT-野生型;CB25-长白25; KJD6-垦鉴稻6号;JJ102-吉粳102;KY131-空育131;ZJ22-浙粳22;NJ9108-南粳9108;ZJ88-浙粳88;WYJ27-武运粳27;YJ4227-扬粳4227。图4和表3中的品种代号与该图相同。
Fig. 3. Mutation types atloci of thirteenvarieties in T1generation.
2.3 基因型检测
为了进一步了解这13份突变体材料的基因型,提取T1阳性植株DNA,并用引物GS3测序分析。每份材料均选取发生纯合突变的序列进行测序分析,结果表明,长白25、吉粳102、浙粳88、武运粳27和J42均在第1外显子ATG下游8 bp处发生单碱基(T、G)插入突变,而垦鉴稻6号、空育131、浙粳22、扬粳4227、南粳9108、J5933、J6167和J5938发生部分碱基缺失突变(图3)。
2.4 T1植株性状考查分析
对T1植株后代纯合的植株进行粒型考种分析和农艺性状考查。结果表明,13份突变体粒型均比野生型显著增长,长宽比也显著增长(图4)。其中长白25、垦鉴稻6号、吉粳102、空育131、浙粳88、武运粳27、扬粳4227、J6167、J42等9份材料的突变体的粒长较野生型植株增加0.22~0.94 mm,且达极显著水平,而浙粳22、南粳9108、J5933、J5938等4份材料的突变体粒长较野生型植株增加0.01~0.26 mm,达显著水平。同时13份突变体的株高均比其野生型低,且长白25、垦鉴稻6号、吉粳102、空育131、浙粳22、浙粳88、武运粳27、扬粳4227、J6167、J5938、J42等11份材料表现出显著差异(0.05水平)。所有材料在播始历期上无明显差异(表3)。
2.5 花时差异分析
选取同一背景条件下的13对材料,选取后代纯合突变植株进行田间花时调查统计,结果表明突变体的花时早于野生型花时。进一步分析发现,吉粳102、武运粳27、空育131和浙粳88的突变体花时均比野生型的花时早10~15 min,吉粳102和浙粳88的突变体在花时上表现出显著差异,而空育131和武运粳27在花时上表现出极显著差异(表3,图5-A)。在温室内进一步对花时观察发现,长白25、空育131、浙粳88、武运粳27和扬粳4227野生型的花时均比突变体的花时晚大约17 min(图5-B),最终统计结果表明,长白25、空育131、浙粳88和武运粳27的花时均表现出极显著差异,而且扬粳4227的花时也表现出显著差异。因此,通过以上数据的分析发现,温室内的花时差异均比田间的花时差异大,且扬粳4227的观察结果进一步显示环境因素对水稻花时的影响,尽管环境因素对花时存在影响,但综上调查结果表明粳稻粒型对水稻花时存在影响,即长粒型的粳稻开花较早。

图4 T1植株13份材料及其突变体粒型性状
Fig. 4. Grain shape of the thirteen materials and their T1mutants.
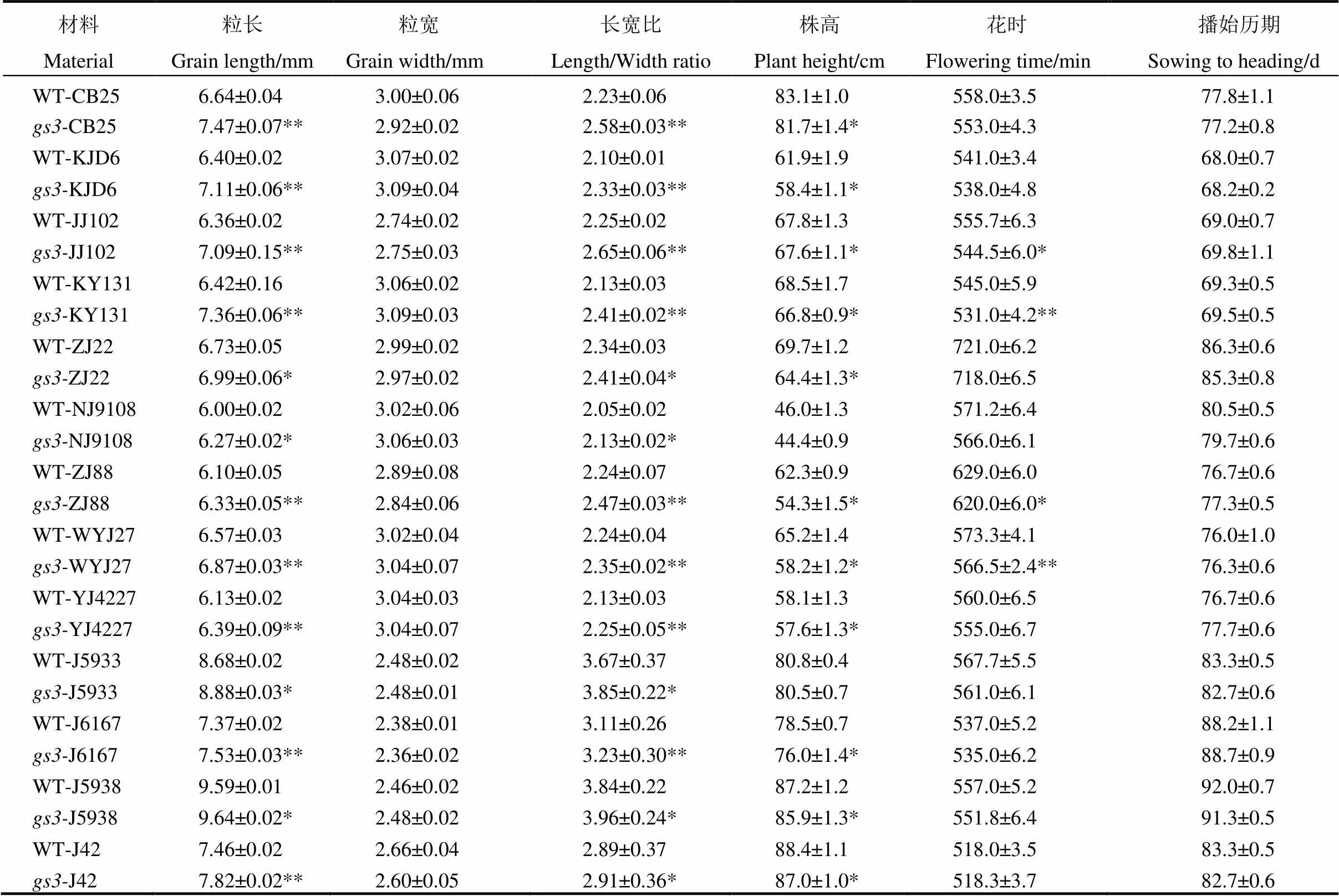
表3 T1植株13份材料及其突变体的农艺性状
*和**分别表示野生型与突变体在0.05,0.01水平上显著差异。
*,** Significant difference between WT and mutant at 0.05, 0.01 level, respectively.
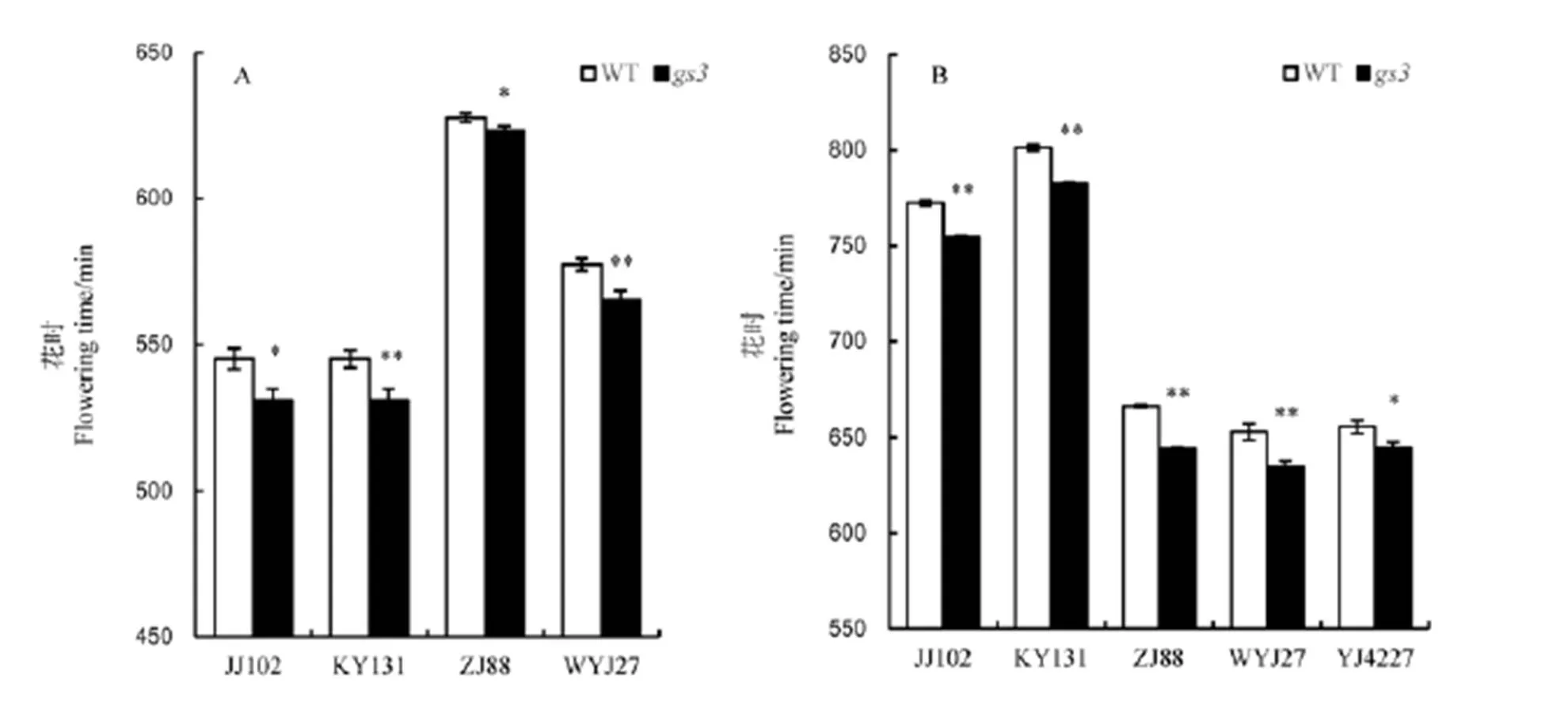
A-田间试验。B-温室调查。JJ102-吉粳102;KY131-空育131;ZJ88-浙粳88;WYJ27-武运粳27;YJ4227-扬粳4227;WT-野生型。*表示差异达0.05显著水平; **表示差异达0.01显著水平。
Fig. 5. Flowering time of five materials and their mutants.
3 讨论
我国杂交水稻自1973年利用野败胞质实现三系配套以来,已取得举世瞩目的成就,几十年来,科技人员主要通过提高柱头外露率等方法来提高异交结实率,进而提高杂交水稻制种产量。但水稻花时差异的不同也会对异交结实率产生一定的影响[32]。因此,改善水稻花时已成为育种家们不断追求的目标,现今对早花时材料的发掘和利用,可以有效解决杂交水稻制种中花时不遇的问题。水稻花时是一个非常复杂的调控过程,不仅受基因网络的调控,还受外部环境的影响,二者共同作用所产生的多种信息汇集在一起从而精准的调控水稻的花时[33]。然而我们在育种过程中发现,长粒的粳稻比短粒粳稻花时相对较早且较集中。为此,我们通过基因编辑技术在粳稻中构建了近等基因系,进行粳稻粒型与花时的关系研究。
本研究利用CRISPR/Cas9技术对控制粒长主效基因进行编辑,获得了粒长较长的突变体。通过田间和温室对水稻花时的统计调查发现,田间观察结果显示吉粳102、空育131、浙粳88和武运粳27的野生型和突变体在花时上能够表现出显著的差异,而在温室内调查发现除了以上4份材料在花时上表现出显著差异外,扬粳4227也表现出显著差异水平,说明环境对水稻花时是有影响的。花时存在差异的植株,它们在株高上也存在差异,通过对基因的研究发现,该基因对株高性状也存在影响,而高超明等[34]研究发现田间温度和湿度离地表距离不同而存在差异,这一现象说明控制粒长的基因可能通过改变株高差异来间接影响花时。然而一些研究学者认为引起花时差异的原因可能因为材料本身遗传背景的不同[35],传统的籼稻粒长较传统的粳稻长,且籼亚种材料开花较粳稻要早。除此之外也有研究表明水稻分蘖角度的不同也会影响稻穗周围的温度和湿度[36],水稻抽穗期温湿度的不同会对花时产生影响[37],但这些影响是否与粒型差异有关目前还尚未报道。
13份突变体的粒型虽然比野生型显著增长,但增加的粒长仅有0.52 mm左右。而国际标准中长、中、短粒的标准分别为:6.50-7.5 mm、5.51-6.49 mm、<5.5 mm[38]。也就是说,基因编辑材料的粒长虽然显著增加,但未达到从短粒到中粒长粒的变化。这也许是造成本研究探究的粒型对开花的影响结果不是很理想的原因。我们利用创制的长粒粳稻(≥6.5 mm)与传统团粒粳稻进行了田间观察对比[39-40],发现花时差异可以达到半小时以上,而且开花高峰明显集中,在杭州8月下旬,长粒粳稻花时主要集中在10:30-12:00,其开花高峰主要集中在11:00-11:30,团粒粳稻花时主要集中在11:00-13:00,其开花高峰不明显[41],另外,本研究中由于所选的转基因受体材料部分是长粒型粳稻(≥6.5 mm),已比传统的粳稻增加1~2 mm,可以看出通过基因编辑后的长粒粳稻,有些材料粒型增加并不是很明显,或许这可以解释为什么13对材料中只有5对材料在花时上表现出差异。选取调控粒型的其他基因对试验材料进行基因编辑或对13份突变体材料进行再编辑,或许会获得粒长增加比率更大的粒型结果,这对于我们探究粒型对花时关系的研究可能会更有说服力,也有望深入研究粒型调控开花习性的分子机理。除此之外,粒型大小改变也可能会对花器官和浆片的发育产生影响,这些变化都可能影响水稻的花时,当花器官发育不健全时,主要表现在花丝发育不正常,弹力不足,最终导致花丝不能正常伸出进而影响水稻开花[42]。近几年,随着分子信息学的快速发展,已有研究表明浆片吸水膨大响应内外源信号来调控内外稃分离,使得内稃向内挤压,最后内外稃分开,花丝伸出,水稻开花[43-45]。此外,已有研究报道水稻不育系的开花相对分散,不集中[46],或许这可以为减少制种双亲花时差异提供新思路,可以通过编辑早开花材料的育性基因来延迟花时,为制种双亲花时相遇提供机遇。但目前对于水稻花时的调控机制还不十分清楚,对花时基因发掘和研究可望为花时改良提供理论参考。笔者相信,随着生物信息学的发展,可以进一步了解水稻花时的分子调控网络机制,选育花时较好的粳稻亲本,推动杂交粳稻发展。
[1] 金成海, 高明晶, 周广春, 全东兴, 孟维韧, 朴红梅. 北方杂交粳稻恢复系育种研究进展. 现代农业科技, 2014, 34(23): 63-64.
Jin C H, Gao M J, Zhou G C, Quan D X, Meng W R, Pu H M. Research advance on restorer lines ofhybrid rice in Northern China., 2014, 34(23): 63-64. (in Chinese with English abstract)
[2] 林建荣, 宋昕蔚, 吴明国. 4份籼粳中间型广亲和恢复系的生物学特性及其杂种优势利用. 中国水稻科学, 2012, 26(6):656-662.
Lin J R, Song X W, Wu M G. Biological characteristics and heterosis utilization of four indica-japonican intermediate type restorer lines with wide compatibility., 2012, 26(6): 656-662. (in Chinese with English abstract)
[3] 徐美兰, 金正勋, 李晓光, 张忠臣, 刘海英, 张丰转, 赵书宇. 7个粳稻SSR和SRAP分子标记遗传距离比较及其与产量性状杂种优势的关系. 分子植物育种, 2009, 7(6): 1084-1092.
Xu M L, Jin Z X, Li X G, Zhang Z C, Liu H Y, Zhang F Z, Zhao S Y. Comparison of genetic distance among seven cultivars of japonica rice based on SSR and SRAP and its relationship with heterosis of yield traits., 2009, 7(6): 1084-1092. (in Chinese with English abstract)
[4] 马启林. 杂交水稻制种花时不遇的生态生理机制研究: Ⅲ. 亲本花时差异的生理基础. 湖北农学院学报, 2000(2): 97-99, 103.
Ma Q L. Ecological physiology of blooming time unoverlapping in hybrid rice seed production: III. Physiological foundation of blooming time unoverlapping., 2000(2): 97-99, 103. (in Chinese with English abstract)
[5] 朱镇, 赵凌, 张亚东, 王才林. 粳型杂交水稻优势及相关分析. 金陵科技学院学报, 2007, 23(3): 53-56.
Zhu Z, Zhao L, Zhang Y D, Wang C L. Heterosis and correlation analysis for three-linehybrid rice., 2007, 23(3): 53-56. (in Chinese with English abstract)
[6] 姜健, 李金泉, 徐正进. 水稻籼粳杂交育种研究进展. 吉林农业科学, 2003, 28(1): 9-14.
Jiang J, Li J Q, Xu Z J, The advancement of hybrid breeding between indica and japonica rices., 2003, 28(1): 9-14. (in Chinese with English abstract)
[7] 黄友明. 雄性不育水稻的颖花开放习性研究综述. 宜春学院学报, 2009, 31(4): 110-112.
Huang Y M. Summary about the habit researching of floret opening on male sterile rice., 2009, 31(4): 110-112. (in Chinese with English abstract)
[8] 田大成. 水稻异交栽培学. 成都: 四川科学技术出版社, 1991: 37-38.
Tian D C. Outcrossing cultivation of rice. Chengdu: Sichuan Science and Technology Press, 1991: 37-38. (in Chinese)
[9] 闫志强, 徐海, 马作斌, 高东昌, 徐正进. 籼稻与粳稻花时对茉莉酸甲酯(MeJA)响应的敏感性差异. 中国农业科学, 2014, 47(13): 2529-2540.
Yan Z Q, Xu H, Ma Z B, Gao D C, Xu Z J. Differential response of floret opening to exo-methyl jasmonate between subsp.and subsp.in rice., 2014, 47(13): 2529-2540. (in Chinese with English abstract)
[10] 李梅, 吴献强, 奉志高. 水稻光温敏核不育系特征特性和开花习性观察与分析. 安徽农业科学, 2008(17): 7169-7171.
Li M, Wu X Q, Feng Z G. Observation and analysis on the characteristics and the flowering habits of rice photo-thermo sensitive genic male sterile lines., 2008(17): 7169-7171. (in Chinese with English abstract)
[11] 王小虎, 钟卫国, 王雪刚, 赵品恒, 苏月红, 俞良, 季向东, 李标, 孙菊英, 梁国华. BT型长粒粳稻不育系常01-11A的选育及应用. 杂交水稻, 2014, 29(1): 10-14.
Wang X H, Zhong W G, Wang X G, Zhao P H, Su Y H, Yu L, Ji X D, Li B, Sun J Y, Liang G H. Breeding and utilization of long-grain BT-type japonica CMS line Chang 01-11A in rice.,2014, 29(1): 10-14. (in Chinese with English abstract)
[12] 马作斌, 詹瞻, 程效义, 高继平, 何广生, 刘迪, 徐海, 徐正进. 花时性状在籼粳交后代中的表现及其对外部环境的响应. 杂交水稻, 2011, 26(5): 70-76.
Ma Z B, Zhan Z, Cheng X Y, Gao G S, Liu D, Xu H, Xu Z J. Flowering time in filial generations of cross between indica and japonica rice and its response to external environment., 2011, 26(5): 70-76. (in Chinese with English abstract)
[13] 李金军, 范国华, 张仁余, 高荣村. 不同水稻品种花时的比较试验. 浙江农业科学, 2007(1): 63-66.
Li J J, Fan G H, Zhang R Y, Gao R C. Comparison test of flowering time in different rice varieties.i, 2007(1): 63-66. (in Chinese)
[14] 张萌, 戴冬青, 李西明, 张华丽, 马良勇. 水稻花时性状研究进展. 核农学报, 2016, 30(2): 267-274.
Zhang M, Dai D Q, Li X M, Zhang H L, Ma L Y. Advances on the study of flowering time trait in hybrid rice., 2016, 30(2): 267-274. (in Chinese with English abstract)
[15] Fan C, Xing Y, Mao H, Lu T, Han B, Xu C, Li X, Zhang Q., a major QTL for grain length and weight and minor QTL for grain width and thickness in rice, encodes a putative transmembrane protein., 2006, 112(6): 1164.
[16] Mao H, Sun S, Yao J, Wang C R, Yu S B, Xu C G, Li X H, Zhang Q F. Linking differential domain functions of the GS3 protein to natural variation of grain size in rice., 2010, 107(45): 19579-19584.
[17] 沈兰, 李健, 付亚萍, 王俊杰, 华宇峰, 焦晓真. 利用CRISPR/Cas9系统定向改良水稻粒长和穗粒数性状. 中国水稻科学, 2017, 31(3): 223-231.
Shen L, Li J, Fu Y P, Wang J J, Hua Y F, Jiao X Z. Orientation improvement of grain length and grain number in rice by using CRISPR/Cas9 system., 2017, 31(3): 223-231. (in Chinese with English abstract)
[18] Wiedenheft B, Sternberg S H, Doudna J A. RNA-guided genetic silencing systems in bacteria and archaea., 2012, 482(7385): 331-338.
[19] Takuro H, Izuho H. Genome engineering using the CRISPR/Cas system., 2014(3): 69-76.
[20] Shan Q W, Wang Y P, Li J, Zhang Y, Chen K, Liang Z, Gao C X. Targeted genome editing in crop plants using a CRISPR/Cas system // GeneticsSociety of China. Plant Genomics in China: ⅩⅣ. Nanjing: Genetics Society of China, 2013.
[21] Baltes N J, Voytas D F. Enabling plant synthetic biology through genome engineering., 2015, 33(2): 120-131.
[22] Belhaj K, Chaparrogarcia A, Kamoun S, Patron N J, Nekrasov V. Editing plant genomes with CRISPR/Cas9., 2015, 32: 76-84.
[23] 李君, 张毅, 陈坤玲, 单奇伟, 王延鹏, 梁振. CRISPR/Cas系统: RNA靶向的基因组定向编辑新技术. 遗传, 2013(11): 1265-1273.
Li J, Zhang Y, Chen K L, Shan Q W, Wang Y P, Liang Z. CRISPR/Cas: A novel way of RNA-guided genome editing., 2013(11): 1265-1273. (in Chinese with English abstract)
[24] Miao J, Guo D, Zhang J, Huang Q P, Qin G J, Zhang X, Wan J M, Gu H Y, Qu L J. Targeted mutagenesis in rice using CRISPR-Cas system., 2013, 23(10): 1233.
[25] Upadhyay S K, Kumar J, Alok A, Rahesh T. RNA-guided genome editing for target gene mutations in wheat., 2013, 3(12): 2233.
[26] Feng Z, Zhang B, Ding W, Liu X, Yang D L, Wei P, Cao F, Zhu S, Zhang F, Mao Y, Zhu J K. Efficient genome editing in plants using a CRISPR/Cas system., 2013, 23(10): 1229.
[27] Shan Q, Wang Y, Li J, Cao C. Genome editing in rice and wheat using the CRISPR/Cas system., 2014, 9(10): 2395.
[28] Rogers S O, Bendich A J. Extraction of Total Cellular DNA from Plants, Algae and Fungi Plant Molecular Biology Manual. Springer Netherlands, 1994: 183-190.
[29] Li J, Zhang Y, Chen K, Liang Z, Zhang K, Liu J, Xi J, Qiu J L, Gao C. Targeted genome modification of crop plants using a CRISPR-Cas system., 2013, 31(8): 686-688.
[30] Ma X, Chen L, Zhu Q, Chen Y, Liu Y G. Rapid decoding of sequence-specific nuclease-induced heterozygous and biallelic mutations by direct sequencing of PCR products., 2015, 8(8): 1285-1287.
[31] 万国, 冯跃, 张凤娇, 徐群, 王一平, 余汉勇, 袁筱萍, 彭锁堂. 水稻花时性状的QTL定位. 核农学报, 2013, 27(5): 562-567.
Wan G, Feng Y, Zhang F J, Xu Q, Wang Y P, Yu H Y, Yuan X P, Peng S T. Mapping QTLs for flowering time in rice., 2013, 27(5): 562-567. (in Chinese with English abstract)
[32] 袁隆平. 杂交水稻学. 北京:中国农业出版社, 2002: 28-29.
Yuan L P. Hybrid Rice. Beijing: China Agriculture Press, 2002: 28-29. (in Chinese)
[33] Kobayasi K, Matsui T, Yoshimoto M, Hasegawa T. Effects of temperature, solar, radiation, and vapor-pressure deficit on flowering time in rice., 2015, 13(1): 21-28.
[34] 高继平, 隋阳辉, 张文忠, 姚晨, 高明超, 赵明辉, 徐正进. 水稻灌浆期冠层温度对植株生理性状及稻米品质的影响. 中国水稻科学, 2015, 29(5): 501-510.
Gao J P, Sui Y H, Zhang W Z, Yao C, Gao M C, Zhao M H, Xu Z J. Effect of canopy temperature on physiological characteristic and grain quality at filling stage in rice., 2015, 29(5): 501-510. (in Chinese with English abstract)
[35] Webb B D, Bollich C N, Adair C R, Johnston T H. Characteristics of rice varieties in the U. S. Department of Agriculture Collection., 1968, 8(3): 361-365.
[36] 于亚辉, 刘郁, 陈广红, 王绍林, 夏明, 阕补超, 郑英杰, 徐正进. 控制水稻分蘖角度对群体生态特性的影响. 气象与环境学报, 2008(5): 67-71.
Yu Y H, Liu Y, Chen G H, Wang S L, Xia M, Que B C, Zheng Y J, Xu Z J. Effect of controlling tiller angle on population ecological characteristics of paddy rice.,2008(5): 67-71. (in Chinese with English abstract)
[37] 姚俊萌, 李迎春, 张金恩, 舒婷, 陆魁东. 播期和抽穗期温度对水稻岳优9113生长及产量的影响. 浙江农业学报, 2015, 24(5): 718-723.
Yao J M, Li Y C, Zhang J E, Shu T, Lu K D. Effects of sowing date and temperature on growth and yield of late rice Yueyou 9113., 2015, 24(5): 718-723. (in Chinese with English abstract)
[38] Khush G S, Paule C M, Delacruz N M. Rice grain quality evaluation and improvement at IRRI//Proceedings of the Workshop on Chemical Aspects of Rice Grain Quality. Los Baños, Laguna, Philippines: IRRI, 1978: 21-31.
[39] 沈希宏, 程式华, 曹立勇, 傅秀民, 占小登. 一种长粒杂交粳稻选育方法: CN102640701A[P]. 2012-08-22.
Shen X H, Chen S H, Cao L Y, Fu X M, Zhan X D. The breeding method of selecting of long-grain japonica hybrid rice: CN102640701A[P]. 2012-08-22. (in Chinese)
[40] 沈希宏, 程式华, 曹立勇, 傅秀民, 占小登. 一种长粒杂交粳稻恢复系选育方法: CN102657077A[P]. 2012-09-12.
Shen X H, Chen S H, Cao L Y, Fu X M, Zhan X D. The breeding method of selecting restoring lines long-grain hybrid japonica rice: CN102657077A[P]. 2012-09-12. (in Chinese)
[41] 沈希宏, 程式华, 曹立勇, 傅秀民, 占小登. 长粒型优质抗病粳稻不育系长粳1A的选育. 杂交水稻, 2013, 28(4): 15-17.
Shen X H, Cheng S H, Cao L Y, Fu X M, Zhan X D. Breeding of long-grainCMS line Changjing 1A with fine grain quality, and good disease resistance., 2013, 28(4): 15-17. (in Chinese with English abstract)
[42] 李进波, 万丙良, 戚华雄. 水稻花器官发育的遗传研究进展. 湖北农业科学, 2010, 49(10): 2563-2566.
Li J B, Wan B L, Qin H X. Progress of genetic research on floral organ development of rice., 2010, 49(10): 2563-2566. (in Chinese)
[43] 付永琦, 向妙莲, 蒋海燕, 何永明, 曾晓春. 水稻颖花开放前浆片转录组变化. 中国农业科学, 2016, 49(6): 1017-1033.
Fu Y Q, Xiang M L, Jiang H Y, He Y M, Zeng X C. Transcriptome profiling of lodicules before floret opening inL., 2016, 49(6): 1017-1033. (in Chinese with English abstract)
[44] Heslop-Harrison Y, Heslop-Harrison J S. Lodicule function and filament extension in the grasses: Potassium ion movement and tissue specialization., 1996, 77(6): 573-582.
[45] Qin Y, Yang J, Zhao J. Calcium changes and the response to methyl jasmonate in rice lodicules during anthesis., 2005, 225(1): 103-112.
[46] Liu L, Zou Z S, Qian K, Xia C, He Y, Zeng H L, Zhou X, Riemann M, Yin C S. Jasmonic acid deficiency leads to scattered floret opening time in cytoplasmic male sterile rice Zhenshan 97A., 2017, 68(16): 4613-4625.
CRISPR/Cas9-mediated Editing ofto Improve Flowering Time inRice
MENG Shuai, XU Peng, ZHANG Yingxin, WANG Hong, CAO Liyong, CHENG Shihua, SHEN Xihong*
(China National Rice Research Institute / State Key Laboratory of Rice Biology / Key Laboratory for Zhejiang Super Rice Research, Hangzhou 311401, China;)
【Objective】Flowering time asynchrony is one of the main factors limiting seed production of hybrid rice between male and female parents, and some studies have shown that flowering time is related to grain shape. Loss of function mutant ofwas used to study the difference of flowering time in this study so as to elucidate the impact of grain shape on flowering time.【Method】CRISPR/Cas9-mediated editing ofto achieve 13 pairs of near-isogenic linevarieties. Then the flowering time was investigated with visual methods. 【Result】T1individuals derived from T0generation were genotyped. The sequencing results show that some bases were mutated with single base insertion, including Changbai 25, Jijing 102, Zhejing 88, Wuyunjing 27, J42 and others with bases deletion, including Kenjiandao 6, Kongyu 131, Zhejing 22, Yangjing 4227, Nanjing 9108, J5933, J6167, J5938. For the grain shape of T1, themutants conferred longer grain length compared to the wild type, and themutants of Jijing 102, Kongyu 131, Zhejing 88, Wuyunjing 27 and Yangjing 4227 were significantly earlier in flowering time than those of the wild type. The others were also earlier, but not significant.【Conclusion】 Long-grainrice has an earlier flowering time than short-grainrice, which could provide references to study the grain-type breeding ofrice, and it would accelerate the breeding process of long-grainparents and promote the development of hybridrice.
rice; flowering time; CRISPR/Cas9;
Corresponding author, E-mail: xihongshen@126.com
Q785;S511.032
A
1001-7216(2018)02-0119-09
2017-09-11;
2017-11-17。
国家863计划资助项目(2014AA10A603);国家公益性农业科技研究专项(201403002);中国农业科学院创新工程超级稻育种创新团队和水稻杂种优势研究机理研究创新团队资助项目(CAAS-ASTIP-2013-CNRRI);国家自然科学青年科学基金资助项目(31501290)。
通讯联系人,E-mail:xihongshen@126.com
10.16819/j.1001-7216.2018.7112
