响应镉胁迫的水稻WRKY15转录因子基因的分离与表达特征
2018-04-09彭喜旭白宁宁王海华
彭喜旭 白宁宁 王海华, *
响应镉胁迫的水稻WRKY15转录因子基因的分离与表达特征
彭喜旭1, 2白宁宁1王海华1, 2, *
(1湖南科技大学 生命科学学院,湖南 湘潭 411201;2重金属污染土壤生态修复与安全利用湖南省高校重点实验室,湖南 湘潭 411201;)
【目的】镉(Cd)是一种对植物生长发育和人类健康均具有很强毒害效应的重金属元素。WRKY转录因子在抗逆生理过程中起重要的调节作用。为了研究基因在镉胁迫响应和抗性反应中的作用,【方法】基于基因注释,采用RT-PCR策略从一氧化氮(NO)处理的水稻叶片中分离完整的编码序列,运用生物信息学软件分析其编码蛋白的结构特征,采用qRT-PCR分析其基因的空间(器官)特异性及诱导表达模式;运用酵母单杂交方法检测其转录激活活性。【结果】克隆了cDNA 序列,长988 bp,包含一个长825 bp的完整开放读码框,编码274个氨基酸。OsWRKY15具有1个典型的WRKY保守结构域,锌指类型为C2HC,归类于WRKY第3组;拥有一个核定位信号,因此推测为一种核蛋白。酵母单杂交分析表明,它具有转录激活活性。在根中的表达丰度最高,其次是叶和茎,在颖果、花和干种子中的表达丰度较低;受Cd、NO和脱落酸(ABA)快速且显著诱导,且在根中被诱导的程度比叶中大,而水杨酸、茉莉酸和乙烯对其表达无明显影响。【结论】OsWRKY15是一个具有功能的核蛋白,推测其可能通过NO、ABA介导的信号途径参与水稻对Cd胁迫的抗性反应。
WRKY转录因子;镉;基因分离;基因表达模式;水稻
镉(cadmium,Cd)是植物的非必需营养元素,其积累能直接或间接抑制植物的光合、呼吸和蒸腾作用,引起水分、矿质代谢异常和氧化胁迫,从而导致植株叶片失绿、卷曲坏死,根尖发黄,生长迟缓,最终死亡[1]。Cd具高迁移性,易被作物吸收,并通过食物链威胁人类健康[2]。金属矿藏开采、冶金、“三废”排放、污水灌溉、污泥与磷肥的施用是土壤Cd污染的主要来源[3]。
植物通过复杂的信号转导途径启动对Cd胁迫的应答,包括信号感知、次级信使产生、信号级联放大,最终汇集于转录因子对一系列参与Cd吸收、转运和解毒相关基因的转录激活,从而启动对Cd胁迫的主动抗性反应[4]。转录因子在植物Cd应答的信号转导中占据重要位置。全基因组表达谱分析表明,Cd胁迫下,水稻中包括DREB、NAC、MYB、AP2/ERFBP、WRKY在内的一些转录因子基因表达被早期诱导[5, 6]。在芥菜()中,bZIP转录因子基因受Cd诱导;进一步的分析表明,BjCdR5参与Cd吸收以及从根至地上部的长距离转运,在Cd抗性中发挥重要作用[7]。硫代葡萄糖苷是细胞中一种重要的硫的储存形式,在植物逆境应答中发挥重要功能。在天蓝遏蓝菜中,受高Cd诱导,参与硫代葡萄糖苷合成的调节[8]。
WRKY转录因子在高等植物中构成蛋白超家族[9]。它们最典型的结构特征是含有1至2个保守的WRKY结构域:由大约60个氨基酸组成,其N端的七肽WRKYGQK十分保守,C端为锌指结构。根据WRKY结构域的数目和锌指结构的组成,可将WRKY蛋白分成3组:第1组含两个WRKY结构域,锌指模式为C2H2;第2和3组含1个WRKY结构域,前者的锌指模式为C2H2,后者则为C2HC[9]。WRKY基因在植物抗热、冷、高盐、干旱、渗透和营养饥饿等非生物逆境中具有重要的调节功能[10]。近来研究表明,WRKY基因还可参与植物对金属或类金属胁迫反应及转运的调节。水稻在过量的Fe处理下表达上调,暗示其在植物Fe胁迫反应中可能发挥一定的调节作用[11]。拟南芥的表达对砷(As)十分敏感,功能获得和功能丧失突变体的遗传与生理分析表明,该因子通过调节As/Pi转运体基因的表达以及抑制As诱导的转座子活化,从而实现对As吸收的控制[12]。拟南芥WRKY46通过抑制苹果酸转运体基因的表达,在Al吸收过程中起负调控作用[13]。
WRKY转录因子介导植物生理过程是通过不同的信号途径来实现的。在这些复杂信号网络中,除了一系列正、负调节子的交互作用外,水杨酸(SA)、茉莉酸(JA)和脱落酸(ABA)等激素参与了上游调控[14]。一氧化氮(Nitric oxide,NO)广泛参与植物的许多发育与生理过程[15],也是植物体内一种重要的抗逆相关激素,在包括金属抗性中发挥重要的调节功能。NO通过直接清除ROS、提高细胞抗氧化酶活力、调节植物对金属的吸收与在细胞内的分布等机制,减轻Cd、Al、Cu、Ni、Pb等金属对植物的毒性[16]。Hong等[17]发现,Cd处理下,玉米()与超氧化物歧化酶(SOD)、抗坏血酸过氧化物酶(APX)基因的表达同时被诱导;原生质体瞬间表达分析表明,RNA干扰阻断了ABA诱导的和基因的表达与酶活性,而超表达则起促进作用。这些结果提示,ZmWRKY4可能通过调节表达在Cd胁迫反应中发挥功能。然而,WRKY在植物Cd响应和抗性中的调节作用以及NO信号是否参与其中,仍不清晰。
前期我们采用cDNA芯片(Agilent Rice Oligo Microarray,含40 000个基因或转录本)对NO处理下水稻叶片的全基因组表达谱进行了分析。该芯片含有112个探针,代表71个基因,涵盖了目前预测的水稻家族[18]70%的成员。结果表明,至少在一个时间点有两倍或以上的表达变化的基因有42个;至少在两个时间点有两倍或以上表达变化的基因17个(定义为NO响应基因)[19]。这些表达变化得到了实时荧光定量PCR(qRT-PCR)的印证。我们分析了17个NO响应的基因在Cd处理下的诱导表达情况,发现水稻基因()可被Cd显著诱导,推测其可能通过NO信号途径在水稻对Cd胁迫反应和抗性中发挥作用。
本研究基于基因注释,分离完整的编码序列,运用生物信息学软件分析其编码蛋白的结构特征,并检测的空间(器官)特异性及诱导表达模式,拟为的生物学功能研究积累基础性资料。
1 材料与方法
1.1 水稻培养与处理
在人工气候室中培养水稻日本晴(L.cv. Nipponbare)至3叶1心期。人工气候室培养条件如下:光强100 µmol/(m2·s),光周期14 h光照/10 h黑暗,28℃/22℃,相对湿度85%。用100 µmol/L硝普钠溶液(NO供体)、1 mmol/L水杨酸(SA)、100 µmol/L 茉莉酸甲酯(MeJA,溶于0.1%甲醇)、100 µmol/L脱落酸(ABA)、1 mmol/L 乙烯利(乙烯供体)对水稻幼苗进行叶面喷施,各处理溶液中含0.1%吐温80,以蒸馏水或0.1%甲醇喷施为对照。在木村B营养液中添加30 µmol/LCd2SO4作为Cd处理,以未加Cd2SO4的营养液作为对照。
1.2 OsWRKY15 cDNA的分离
基于水稻基因组注释计划(http://rice.Plant biology.msu.edu/)注释的LOC_01g46800序列设计引物:5′-GGCATGGTGAGGCAACTGG-3′和5′-GGCTGGCAACGTGTAGGAAA-3′,用逆转录PCR从NO处理的水稻幼苗叶片RNA中扩增。PCR产物纯化后,连接到pUCmT载体上,测序验证。
1.3 序列分析
采用DNAStar软件推断基因的开放读码框(ORF)及其所编码的氨基酸序列,计算等电点和分子量。蛋白质同源序列搜索用NCBI(http://ncbi. nlm.nih.gov/)的Protein BLAST工具。采用Mega 4.0软件基于邻接法构建系统进化树。用PROSITE (http://www.expasy.org/prosite) 预测保守结构域和活性位点,用WoLF PSORT (https://wolfpsort.hgc.jp/)预测亚细胞定位信号。
1.4 RNA提取与实时荧光定量PCR(qRT-PCR)
采用TRIZOL试剂抽提总RNA。用FastQuant逆转录试剂盒(北京天根)合成cDNA第1链。qRT-PCR在CFX96 PCR仪(美国伯乐)上进行。以作为内参。设阴性对照和3次重复。结果利用相对定量方法(2―△△CT)计算。反应体系与程序参照参考文献[18]。引物:5′-GTCG TCGCCCTTCGTGTC-3′, 5′-ATGAACTCCATG TCGTCTCCC-3′。引物:5′-ATCGCCC TGGACTATGAC-3′, 5′-GAAACGCTCAGCAC CAAT-3′。
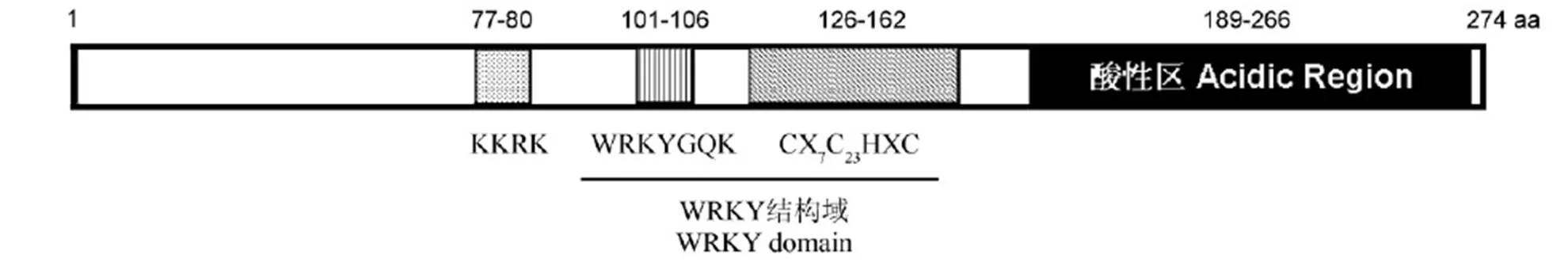
填充点、竖线、斜线的框和实框分别代表核定位信号、WRKYGQK肽、锌指和酸性区。图中显示了保守的WRKY结构域和锌指类型。数字表示OsWRKY15中的氨基酸位置。
Fig. 1. Schematic diagram of the deduced protein of thegene.
1.5 转录激活分析
用引物5′-CGGGCATGGTGAGGC AACTGG-3′(下划线部分为RI酶切位点)和5′-ACGCGGCTGGCAACGTGTAGGAAA -3′(下划线部分为Ⅰ酶切位点)扩增的完整编码区(不含终止密码子),用RI/I酶切,插入到PGBKT7(pBD),构建pBD-OsWRKY15。转化酵母菌株AH109,在SD-Trp、SD-Trp-Ade-His选择培养基上30℃培养3 d。b-半乳糖苷酶活性测定按供应商说明书进行。分别设pBD空载体和pBD-OsWRKY30[20]转化子为阴性和阳性对照。
2 结果与分析
2.1 OsWRKY15 cDNA的克隆与序列分析
从NO处理的水稻幼苗叶片RNA中通过逆转录PCR扩增,获得与预期长度(988 bp)一致的cDNA序列,将该基因命名为。其编码序列最大的ORF长825 bp,推测编码1个由274个氨基酸组成、分子量为29.1 kD、等电点(pI)为7.3的蛋白质。
利用PROSITE对的编码蛋白进行结构域分析,结果表明OsWRKY15具有WRKY蛋白家族的典型结构特征:87~162位为WRKY结构域,其锌指模式为CX7CX23HXC(图1)。根据WRKY蛋白的分组原则[9],归于第3组。OsWRKY15具有3个酪蛋白磷酸化位点、1 个cAMP 和cGMP依赖的蛋白激酶磷酸化位点、3 个蛋白激酶C磷酸化位点。用WoLF PSORT预测,OsWRKY15在77~80位有核定位信号KKRK,提示其定位于细胞核中的可能性最大。189~266位的理论pI为3.4,其中酸性氨基酸(Asp,D和Glu,E)的比例达14.1%(11/78),远大于酸性氨基酸在序列中的随机分布比例,提示OsWRKY15可能具有转录激活活性[20],符合作为WRKY类转录因子的结构特征。
为了解OsWRKY15与不同物种的同源序列之间的进化关系,利用BLAST在线分析工具对GenBank 的非冗余蛋白数据库进行同源序列搜索。结果表明,同源性最高的前8个序列均来源于单子叶植物,序列同一性均在50%以上。OsWRKY15与短花药野生稻() WRKY41 (XP_006664979)在氨基酸水平上的同一性最高(65.3%),其次为高粱()中推定的WRKY蛋白(XP_002458250)(53.1%)和玉米()WRKY54(XP_008656713)(52.1%)。这些蛋白的WRKY结构域十分保守,然而WRKY结构域之外存在较大分歧,反映了这些同源序列在结构上的多样性,也暗示它们可能具有不同的生物学功能。在多重序列比对的基础上,采用邻接法构建系统进化树(图2)。这些序列分成两个大的进化分支:OsWRKY15与来自单子叶植物的同源序列聚类在一组,而双子叶植物麻风树()、川桑()和拟南芥的同源序列聚类在另一组,说明了它们在单、双子叶植物之间的进化分歧。
2.2 OsWRKY15在不同器官中的表达分析
qRT-PCR表明,在所分析的6种器官中均有表达,其中根中的表达量最高,其次是叶、茎,在颖果、花和干种子中表达量较低(图3)。

分支上的数字表示1000次重复的Bootstrap值。
Fig. 2. Phylogenetic tree of OsWRKY15 and WRKY proteins from other species.
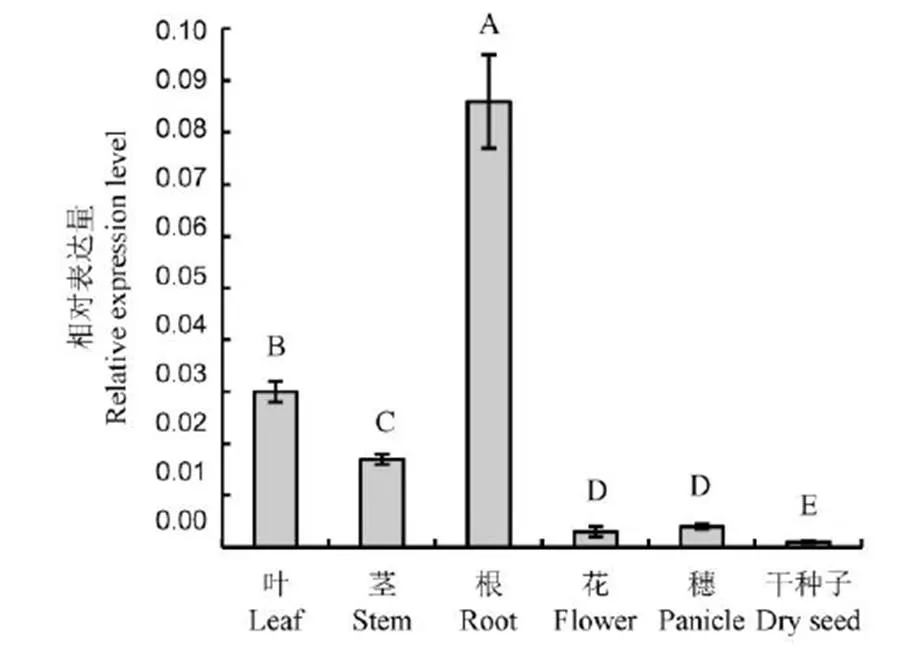
不同字母表示在0.01水平差异显著 (n=6;邓肯多重范围检验)。
Fig. 3. Expression patterns ofin different rice organs.
2.3 OsWRKY15在Cd和抗逆相关激素处理下的表达分析
采用qRT-PCR对水稻叶片和根在Cd处理下的表达动态进行了分析。结果表明,叶和根中的表达均被Cd诱导,在根中诱导的幅度大于叶。在叶中,Cd处理6 h时表达水平最高,为对照的4.0倍;在根中,Cd处理后1 h,表达至最高值,为对照的8.7倍,然后降低,但12 h的表达量仍显著高于对照(图4-A)。提示OsWRKY15可能参与水稻对Cd胁迫的响应和抗性。
一氧化氮(NO)、水杨酸(SA)、茉莉酸甲酯(JA)、脱落酸(ABA)和乙烯利(ET)是与Cd胁迫响应和抗性相关的植物激素[21]。为了了解参与Cd胁迫响应或抗性所依赖的信号途径,对在上述5种激素处理后的表达变化进行了检测。结果表明,的表达受NO快速且显著诱导。在根中,NO处理后6 h前表达量呈明显上升趋势,6 h达最大值,表达量为0 h对照的15.4倍;在叶中,在处理后1 h达到最大值,此时的表达量为对照的9.9倍,6 h时回复至与对照相当的水平,然后又显著上升至接近1 h的水平(图4-B)。同样,受ABA快速且显著诱导。处理后1~12 h,叶中的表达量持续上升;在根中,ABA处理后6 h前呈显著上升趋势,然后回落(图4-E)。从总体上看,无论在根还是叶中,被NO诱导的程度比被ABA诱导的要大。然而,SA、JA和ET处理后,根和叶中的表达无明显变化, 各时间点表达量均与0 h 对照相当(图4-C,D,F)。
NO、ABA和Cd处理下,在根中受诱导表达的程度明显高于叶。
以上表明,OsWRKY15可能通过依赖于NO和ABA的信号途径参与水稻对Cd胁迫的反应。
2.4 OsWRKY15的转录激活活性分析
从一级结构分析来看,锌指结构后的区域含有较多的酸性氨基酸, 提示OsWRKY15可能为一转录激活子[20]。为验证此假说,将cDNA的完整编码序列插入至pGBKT7中Gal4 BD的C端,构建与Gal4 BD融合的酵母转化载体,然后转化至酵母AH109中,进行酵母单杂交分析。空载体pGBKT7(负对照)、pBD-OsWRKY15和pBD- OsWRKY30(正对照)[19]均在SD-Trp培养基上生长良好,而在SD-Trp-Ade-His选择培养基上只有pBD-OsWRKY15和正对照能够生长(图5-A),说明OsWRKY15的确具有转录激活的能力。b-半乳糖酶活性测定的结果也证明了这一点(图5-B)。
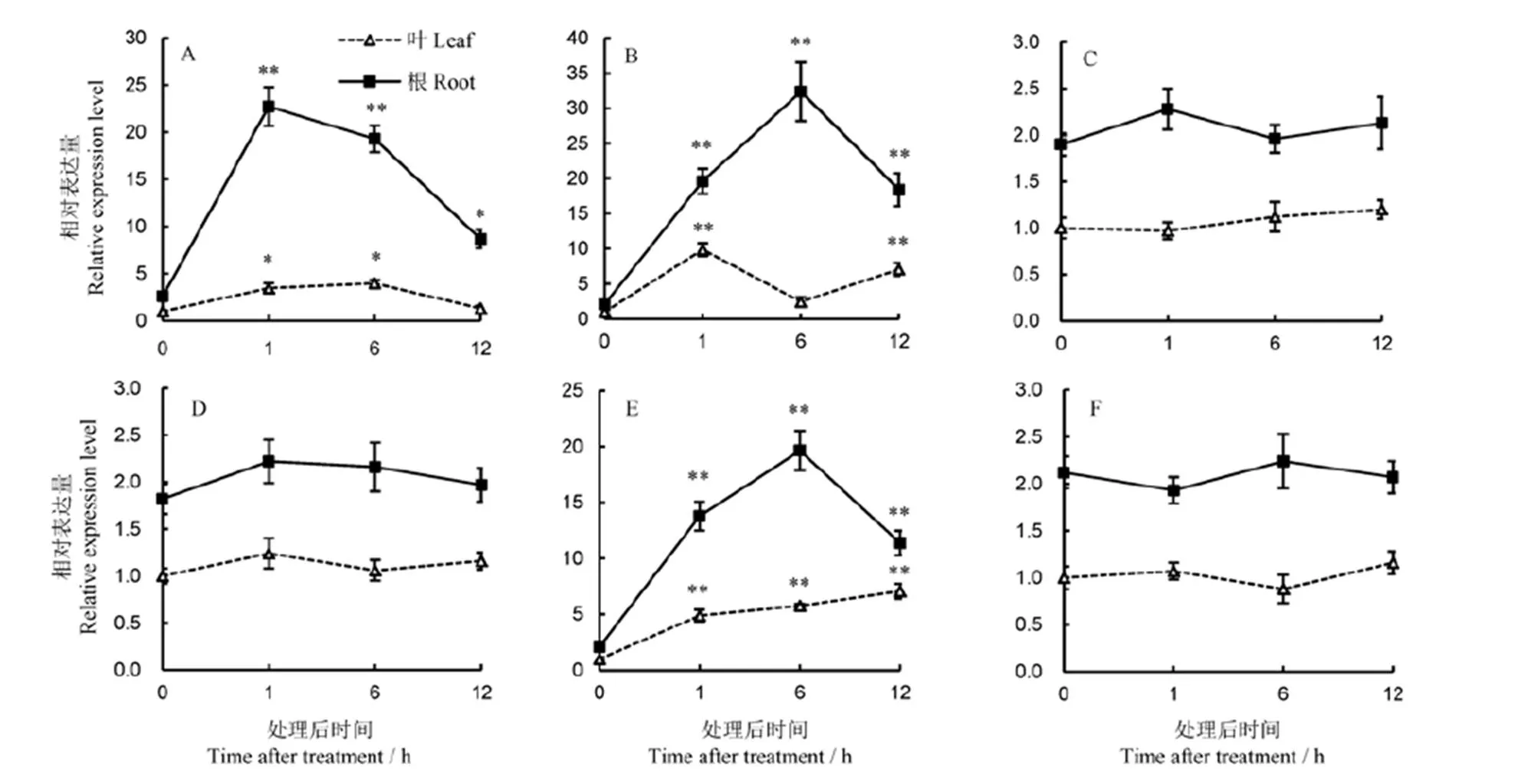
A-镉;B-一氧化氮;C-水杨酸;D-茉莉酸甲酯;E-脱落酸;F-乙烯利。*,**分别表示与0 h对照相比在0.05、0.01水平上有显著差异(n=6;邓肯多重范围检验法)。
Fig. 4.expressionin response to different treatments with hormones and Cd exposure.
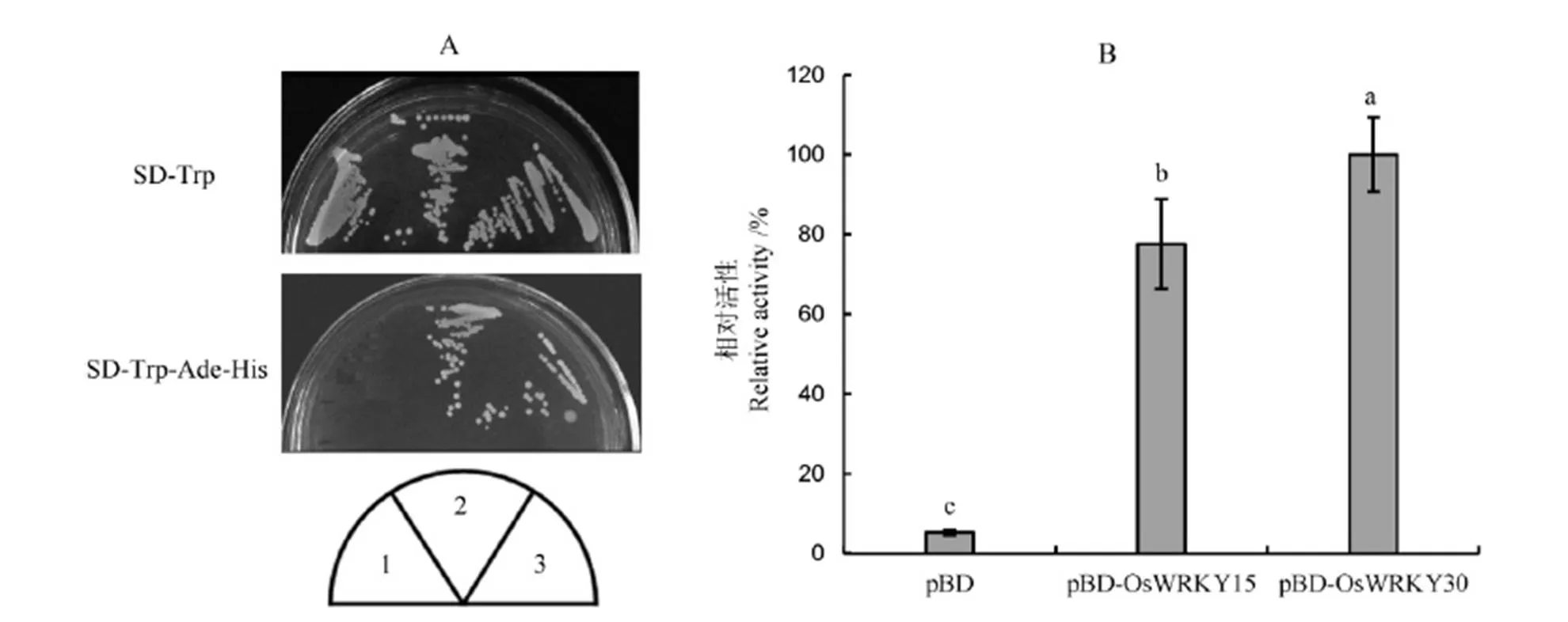
A-生长在SD-Trp或SD-Trp-Ade-His培养基上的酵母转化子。1-空载体pGBKT7(负对照);2-pGBKT7-OsWRKY15;3-pGBKT7-30(正对照)。B-酵母转化子的β-半乳糖苷酶相对活性分析。不同小写字母表示在P<0.05水平上有显著差异(邓肯多重范围检验法)。
Fig. 5. Assay of transcriptional activation activity of OsWRKY15 in yeast cells.
3 讨论
植物对Cd的响应和抗性涉及到许多吸收、转运、解毒相关基因的表达调控[4]。转录是基因表达的第1步,转录水平的调控体现了经济与灵活的原则,在基因表达调控中处于关键环节。另外,从潜在的应用层面上看,转录因子在提高作物抗逆方面可能更加有效。因为,作物抗性通常由多基因控制,单个基因的遗传转化只能部分提高抗性;而一个转录因子可以调控表达多个性状或同一性状的多个基因。因此,分离和鉴定信号途径中的转录因子基因对阐明植物适应Cd胁迫的生理与分子机理至关重要,同时可能在Cd污染土壤的植物修复和低金属积累作物品种选育中具有一定的应用前景。
基因表达分析可为基因功能解析提供基础信息。基于cDNA芯片杂交和第2代RNA-Seq测序技术的基因组尺度上的转录表分析初步揭示了转录因子在植物Cd应答中起重要的调节作用[5, 6]。水稻地上部的表达在Cd处理后24 h提高超过90倍[6];在Cd超富集植物天蓝遏蓝菜中,的表达同样被Cd诱导[23],提示它们可能参与植物对Cd胁迫的应答或抗性。最近,Yang等[24]通过启动子顺式元件分析、酵母单杂交以及基因表达模式分析,发现刚毛柽柳() WRKY7可能作为液泡膜膜V型质子泵基因的上游调节子,在Cd抗性中起重要的调节作用。本研究从NO处理的水稻叶片中分离了完整的编码序列,推定编码含1个WRKY结构域的蛋白,其锌指具有水稻第3亚组典型的结构模式[9],含KKRK典型的核定位信号,预测定位于细胞核中。转录因子的转录激活域一般富含酸性氨基酸[21]。很多WRKY具有符合上述特征的转录激活域[9]。OsWRKY15的C端为酸性结构区,含有4个Glu、7个Asp。酵母单杂交分析表明,OsWRKY15的确具有转录激活活性。这些结果提示,OsWRKY15是一个有功能的核调节蛋白。
NO、SA、JA、ABA和ET等几种重要的逆境适应相关激素均参与植物对Cd抗性的建立、维持与活化[22],因此Cd胁迫应答与其他非生物胁迫的抗性反应可能享有相似的信号传递机制,这也反映了植物对Cd的应答、抵御机制的复杂多样性。一方面,Cd处理可以诱导这些激素在植物组织中的生物合成,改变它们在各器官或组织中积累水平与分布,另一方面这些激素的施用可以通过不同的机制提高植物对Cd的抗性。药物试验证明,NO可以降低Cd胁迫下苜蓿的根部对Cd的吸收速率,同时通过激活活性氧清除系统缓解Cd对根细胞的氧化损伤,从而有效地削弱Cd伤害[25]。ABA可以整合不同的胁迫信号,控制下游胁迫反应,在植物对干旱、盐、低温等多种非生物逆境的抗性中发挥重要功能[22]。在水稻中,ABA抑制Cd从根向地上部运输,从而赋予水稻对Cd的抗性[26]。Oono等[6]发现,Cd胁迫下水稻中ABA依赖的转录因子(如bZIP、NAC)基因以及许多抗旱相关基因被Cd显著诱导,提示Cd与干旱胁迫的信号通路存在“对话”机制。本研究发现,被Cd快速而显著诱导,提示它可能参与了水稻对Cd胁迫的响应和抗性;尽管诱导时序与程度不同,都能被NO和ABA诱导,提示它可能位于NO和ABA信号途径的交叉点实现对Cd胁迫反应的调节,也不能排除它参与水稻对其他非生物胁迫抗性调节的可能性,这尚需进一步证实。SA、JA和ET不影响的表达水平,说明它们可能不参与OsWRKY15介导的对Cd胁迫的应答或抗性调节。在根、茎、叶等6种器官中表达丰度不一,且根中的表达水平高于其他器官,这与Ramamoorthy等[27]报道的结果基本一致。有趣的是,Cd、NO和ABA处理下,根部的表达受诱导的程度高于叶。若证明OsWRKY15果真在水稻Cd抗性中具有调节功能的话,这些结果将不难理解,因为植物对Cd吸收以及Cd对植物伤害的原初部位在根部。至于OsWRKY15在水稻Cd胁迫响应和抗性中是否具有重要的生物学功能有待下一步研究证明。
[1] Cosio C, Vollenweider P, Keller C. Localization and effects of cadmium in leaves of a cadmium-tolerant willow (L.): I. Macrolocalization and phytotoxic effects of cadmium., 2006, 58: 64-74.
[2] Grant C A, Clarke J M, Duguid S, Chaney R L. Selection and breeding of plant cultivars to minimize cadmium accumulation., 2008, 390: 301-310.
[3] Folgar S, Torres E, Pérez-Rama M, Cid A, Herrero C, Abalde J.as marine microalga highly tolerant to but a poor remover of cadmium., 2009, 165: 486-493.
[4] Verbruggen N, Hermans C, Schat H. Mechanisms to cope with arsenic or cadmium excess in plants., 2009, 12: 364-372.
[5] Tang M F, Mao D H , Xu L W, Li D, Song S, Chen C. Integrated analysis of miRNA and mRNA expression profiles in response to Cd exposure in rice seedlings., 2014, 15: 835.
[6] Oono Y, Yazawa T, Kawahara Y, Kanamori H, Kobayashi F, Sasaki H, Mori S, Wu J, Handa H, Itoh T, Matsumoto T. Genome-wide transcriptome analysis reveals that cadmium stress signaling controls the expression of genes in drought stress signal pathways in rice., 2014, 9(5): e96946.
[7] Farinati S, DalCorso G, Varotto S, Furini A. TheBjCdR15, an ortholog ofTGA3, is a regulator of cadmium uptake, transport and accumulation in shoots and confers cadmium tolerance in transgenic plants., 2010,185: 964-978.
[8] van de Mortel J E, Schat H, Moerland P D, Ver Loren van Themaat E, van der Ent S, Blankestijn H, Ghandilyan A, Tsiatsiani S, Aarts M G. Expression differences for genes involved in lignin, glutathione and sulphate metabolism in response to cadmium inand the related Zn/Cd-hyperaccumulators., 2008, 31: 301-324.
[9] Eulgem T, Rushton P J, Robatzek S, Somssich I E. The WRKY superfamily of plant transcription factors., 2000, 5, 199-206.
[10] Chen L, Song Y, Li S, Zhang L, Zou C, Yu D. The role of WRKY transcription factors in plant abiotic stresses., 2012, 819(2): 120-128.
[11] Ricachenevsky F K, Sperotto R A, Menguer P K, Fett J P. Identification of Fe-excess-induced genes in rice shoots reveals a WRKY transcription factor responsive to Fe, drought and senescence., 2010, 37: 3735-3745.
[12] Castrillo G, Sánchez-Bermejo E, de Lorenzo L, Crevillén P, Fraile-Escanciano A, Tc M, Mouriz A, Catarecha P, Sobrino-Plata J, Olsson S, Leo Del Puerto Y, Mateos I, Rojo E, Hernández L E, Jarillo J A, Piñeiro M, Paz-Ares J, Leyva A. WRKY6 transcription factor restricts arsenate uptake and transposon activation in., 2013, 25: 2944-2957.
[13] Ding Z J, Yan J Y, Xu X Y, Li G X, Zheng S J. WRKY46 functions as a transcriptional repressor of ALMT1, regulating aluminum-induced malate secretion in., 2013, 76: 825-835.
[14] Jiang Y J, Yu D Q. WRKY transcription factors: Links between phytohormones and plant processes., 2015, 58: 501-502.
[15] Lamotte O, Courtois C, Barnavon L, Pugin A, Wendehenne D. Nitric oxide in plants: The biosynthesis and cell signalling properties of a fascinating molecule., 2005, 221: 1-4.
[16] Xiong J, Fu G, Tao L, Zhu C. Roles of nitric oxide in alleviating heavy metal toxicity in plants., 2010, 497: 13-20.
[17] Hong C Y, Cheng D, Zhang G Q, Zhu D, Chen Y, Tan M. The role of ZmWRKY4 in regulating maize antioxidant defense under cadmium stress., 2017, 482: 1504-1510.
[18] Wu K L, Guo Z J, Wang H H, Li J. The WRKY family of transcription factors in rice andand their origins., 2005, 12: 9-26.
[19] 孟姣, 王海华, 向建华, 蒋丹, 彭喜旭, 贺欢欢. 水稻WRKY转录因子基因家族响应外源一氧化氮的表达谱分析. 中国水稻科学, 2016, 30(2): 111-120.
Meng J, Wang H H, Xiang J H, Jiang D, Peng X X, He H H. Expression profiles of rice WRKY transcription factor gene family responsive to exogenous nitric oxide application., 2016, 30(2): 111-120. (in Chinese with English abstract)
[20] Peng X X, Hu Y, Tang X, Zhou P, Deng X, Wang H H, Guo Z. Constitutive expression of ricegene increases the endogenous jasmonic acid accumulation, PR gene expression and resistance to fungal pathogens in rice., 2012,236: 1485-1498.
[21] Schwechheimer C, Bevan M. The regulation of transcription factor activity in plants., 1998, 3: 378-383.
[22] Asgher M, Khan M I, Anjum N A, Khan N A. Minimising toxicity of cadmium in plants–role of plant growth regulators., 2015, 252: 399-413.
[23] Wei W, Zhang Y, Han L, Guan Z, Chai T. A novel WRKY transcriptional factor fromnegatively regulates the osmotic stress tolerance of transgenic tobacco., 2008,27: 795-803.
[24] Yang G, Wang C, Wang Y, Guo Y, Zhao Y, Yang C, Gao C. Overexpression ofand its potential upstream regulator,, improved plant tolerance of cadmium stress., 2016, 6: 18752.
[25] Li L, Wang Y, Shen W. Roles of hydrogen sulfide and nitric oxide in the alleviation of cadmium-induced oxidative damage in alfalfa seedling roots., 2012, 25: 617e631.
[26] Uraguchi S, Mori S, Kuramata M, Kawasaki A, Arao T, Ishikawa S. Root-to-shoot Cd translocation via the xylem is the major process determining shoot and grain cadmium accumulation in rice., 2009, 60: 2677-2688.
[27] Ramamoorthy R, Jiang S Y, Kumar N, Venkatesh P N, Ramachandran S. A comprehensive transcriptional profiling of thegene family in rice under various abiotic and phytohormone treatments., 2008, 49: 865-879.
Isolation and Expression Profiles of Cadmium Stress-Responsive Rice WRKY15 Transcription Factor Gene
PENG Xixu1, 2, BAI Ningning1, WANG Haihua1, 2, *
(1School of Life Science, Hunan University of Science and Technology, Xiangtan 411201, China;2Key Laboratory of Ecological Remediation and Safe Utilization of Heavy Metal-polluted Soils, College of Hunan Province, Xiangtan 411201, China;)
【Objective】Cadmium (Cd) is one of the most toxic heavy metal elements to growth and development of plants and human health. WRKY transcription factors play important regulatory roles in the resistance against stresses. But so far, the regulatory functions of WRKY proteins (WRKYs) in the resistant responses to Cd stress in plants remain unclear so far. 【Methods】Full-length coding sequence ofwas amplified by RT-PCR with gene-specific primers designed according to gene prediction. Structural characteristics of OsWRKY15 were analyzed by bioinformatics software; Organ-specific and induced expression patterns ofwere analyzed by qRT-PCR. Transcriptional activation activity of OsWRKY15 was tested by yeast one-hybrid assay.【Results】15,988 bp in length, contained an entire ORF in length of 825 bp, encoding a protein of 274 amino acid residues consisting of one WRKY domain with a zinc finger motif of C2HC, belonging to the WRKY subgroup III. OsWRKY15 had a nuclear localization signal and was predicted to be localized in nucleus. Yeast one-hybrid assay revealed that OsWRKY15 had transcriptional activation activity. The transcript levels ofwere higher in roots than those in stems and leaves, and the least was in panicles, flowers and dry seeds. Its expression was rapidly and significantly induced in response to Cd exposure, nitric oxide (NO) and abscisic acid (ABA) application with more increase folds in roots than in leaves. However, salicylic acid, jasmonic acid and ethylene exerted no obvious effects on the expression of. 【Conclusion】OsWRKY15 may be involved in the regulation of rice resistance response to Cd stress through NO- and ABA-dependent signal pathways.
WRKY transcription factor; cadmium; gene isolation; gene expression profiles;
Corresponding author, E-mail: hhwang@hnust.edu.cn
Q945.78; Q786; S511.032
A
1001-7216(2018)02-0103-08
2017-05-20;
2017-09-15。
国家自然科学基金资助项目(31301617);湖南省自然科学基金资助项目(2016JJ3060);湖南省教育厅重点科研平台开放基金资助项目(15K045)。
通讯联系人,E-mail: hhwang@hnust.edu.cn
10.16819/j.1001-7216.2018.7056
