水稻纹枯病菌RsPhm基因的克隆及其表达分析
2018-04-09江绍锋王陈骄子舒灿伟周而勋
江绍锋 王陈骄子 舒灿伟 周而勋
水稻纹枯病菌基因的克隆及其表达分析
江绍锋 王陈骄子 舒灿伟 周而勋*
(华南农业大学 农学院/广东省微生物信号与作物病害防控重点实验室, 广州 510642;)
【目的】为了阐明苯酚2-单加氧酶基因()在水稻纹枯病菌(AG-1ⅠA)黑化中的功能,【方法】采用常规PCR和RT-PCR技术对该基因进行克隆和生物信息学分析,通过荧光定量PCR(qRT-PCR)技术检测在儿茶酚胁迫下该基因的相对表达量。【结果】生物信息学分析结果表明,基因的DNA和cDNA全长序列分别为2 628 bp和1 983 bp,编码660个氨基酸。系统进化树分析显示,基因在立枯丝核菌()不同融合群中具有较近的亲缘关系,在不同真菌之间在进化上具有一定保守性。通过qRT-PCR技术分析了在不同浓度儿茶酚胁迫下水稻纹枯病菌基因的转录表达情况。外源儿茶酚能提高基因的表达量,在12.5 µg/mL浓度下表达量最高,极显著上调35.7倍,在25 µg/mL和50 µg/mL浓度下表达量分别上调19.1倍和28.4倍,但在100 µg/mL浓度下表达量仅上调2.1倍。【结论】获得了基因全长序列,了解了其基本生物学信息,明确了其在儿茶酚胁迫下的表达模式。研究结果为科学、系统地阐明水稻纹枯病菌基因调控黑色素形成机制奠定了理论基础。
水稻纹枯病菌;苯酚2-单加氧酶基因;基因克隆;表达分析
由立枯丝核菌(Kühn) AG-1 ⅠA融合亚群引起的水稻纹枯病是世界范围内分布最为广泛的水稻三大真菌病害之一。立枯丝核菌()是一种经济上非常重要的土传性病原真菌,其分布范围广泛,寄主类型多种多样,除为害水稻外,还可为害马铃薯、玉米、小麦、大豆和甘蓝等260多种植物[1-4]。
加氧酶指能催化氧分子加入到有机物质中的酶,是芳香化合物降解过程中的重要酶类,它广泛存在于各种生命活动的新陈代谢过程中。加氧酶按照催化氧原子的个数可以划分为两类:将两个氧原子都催化反应进入底物的双加氧酶和只催化一个氧原子进入底物的单加氧酶[5]。苯酚2-单加氧酶(phenol 2-monooxygenase,Phm)是一种单加氧的氧化还原酶,能催化苯酚、NADPH和H+在有氧条件生产儿茶酚、NADP+和水[6]。微生物对芳香族化合物的降解可以分为苯环的激活以及对被激活苯环的开环两个过程,加氧酶参与芳香族化合物、多环芳烃、农药等多个种类的污染物(如六六六、甲苯、二甲苯、萘和蒽等)的降解代谢途径[6-8]。苯酚2-单加氧酶是苯酚降解中的关键芳环加氧酶。首先,通过苯酚羟基化作用下生成儿茶酚;然后儿茶酚在C12O和C23O作用下分别通过邻位开环和间位开环形式被进一步降解[9]。
黑色素是植物病原真菌的主要毒力因子和抗逆因子。许多植物病原真菌的菌丝、分生孢子和菌核都能产生黑色素,从而以多种方式增强真菌的毒力和抗逆性[10-11]。大多数致病真菌可通过内源性前体物质代谢合成黑色素,但新生隐球菌()需要添加外源性左旋多巴(-DOPA)才能形成黑色素[12]。儿茶酚是合成黑色素的前体物质,已经在玉蜀黍黑粉菌()的厚垣孢子内发现[13]。本实验室在前期研究中发现在培养基中添加儿茶酚有利于促进水稻纹枯病菌黑色素的生物合成和积累,从而加快细胞壁的黑化和增厚[14]。目前,尚未见到关于水稻纹枯病菌苯酚2-单加氧酶()基因的研究报道。本研究通过对基因的克隆及其在儿茶酚诱导下的表达分析,为深入研究基因调控水稻纹枯病菌黑色素形成机制奠定理论基础。
1 材料与方法
1.1 供试菌株和培养基配制
水稻纹枯病菌(AG-1ⅠA) GD-118菌株是本实验室分离和保存的强致病力菌株[15]。
马铃薯葡萄糖琼脂培养基(potato dextrose agar,PDA):马铃薯200.0 g,葡萄糖20.0 g,琼脂粉18.0 g,双蒸水1 000.0 mL。马铃薯葡萄糖液体培养基(potato dextrose broth,PDB):马铃薯200.0 g,葡萄糖20.0 g,双蒸水1 000.0 mL。
LBA固体培养基(luria-bertani agar,LBA):胰蛋白胨10.0 g,酵母提取物5.0 g,NaCl 10.0 g,调pH至7.4,琼脂粉15.0 g,双蒸水1 000.0 mL。LBB液体培养基(luria-bertani broth,LBB):胰蛋白胨10.0 g,酵母提取物5.0 g,NaCl 10.0 g,调pH值至7.4,双蒸水1 000.0 mL。
1.2 主要试剂
真菌DNA提取试剂盒、RNA提取试剂盒、克隆载体-T1、-T1感受态细胞、RT-PCR试剂盒、普通酶和高保真酶均购自北京全式金生物技术有限公司。儿茶酚、氨苄青霉素钠、IPTG和X-Gal购自Sigma公司。引物(表1)合成和测序由生工生物工程(上海)股份有限公司完成。
1.3 菌丝体培养与收集
水稻纹枯病菌GD-118菌株在PDA平板上培养2 d后,用内径5.0 mm的打孔器在菌落边沿打取菌丝块,在每个装有150 mL PDB培养液(分别含0,12.5,25,50,100 μg/mL儿茶酚)的三角瓶中接入10块菌丝块,28℃恒温下摇床振荡培养3 d后,用无菌滤纸过滤收集菌丝体,无菌水将菌丝体洗涤2~3次,菌丝体用多层灭菌滤纸吸干表面水分后,放入―20℃冰箱中保存备用。
1.4 DNA和RNA的提取
水稻纹枯病菌GD-118 DNA和RNA的提取按照真菌DNA提取试剂盒和RNA提取试剂盒的说明书进行。在采用琼脂糖凝胶电泳检测其完整性、紫外分光光度测定其纯度和含量,提纯后的DNA和RNA样品分别保存于―20℃冰箱和―80℃超低温冰箱中,备用。
1.5 RsPhm基因DNA和cDNA克隆
根据水稻纹枯病菌基因组和转录组数据库[16],用Vector NTI 软件设计一对水稻纹枯病菌基因特异性引物,引物序列为DF01905和DR01905(表1)。以总RNA为模板,利用RT-PCR试剂盒进行RT-PCR扩增得到cDNA。以基因组DNA和cDNA为模板,分别采用北京全式金生物技术有限公司的普通酶和高保真酶进行PCR扩增,扩增体系如下:PCR混合液25 μL,10 μmol/L DF01905和DR01905引物各1 μL,模板1 μL,普通酶或高保真酶1 μL,再加双蒸水22 μL。PCR程序如下:94℃下预变性3 min;94℃下变性30 s,55℃下退火30 s,72℃下延伸3 min,35个循环后72℃下延伸10 min。PCR产物保存于4℃冰箱。PCR产物经回收、连接,化学法转入到-T1感受态细胞,经过蓝白斑筛选及菌液PCR电泳鉴定,筛选阳性克隆。取5 µL PCR产物在1%琼脂糖凝胶上进行电泳,加入1 µL 6×上样缓冲液,在5~8 V/cm电压条件下电泳30 min,于凝胶成像系统下观察分析并拍照留存。阳性克隆的测序由生工生物工程(上海)股份有限公司完成。测序结果利用Conting Express软件进行拼接,并利用NCBI在线工具对水稻纹枯病菌基因进行序列基本结构和特征分析。

表1 本研究使用的引物序列
1.6 RsPhm基因生物信息学分析
通过在线程序和软件对水稻纹枯病菌基因所编码的蛋白质氨基酸序列进行生物信息学预测和分析,预测和分析参数有RsPhm蛋白质理化性质、信号肽、跨膜结构、二级结构、三维结构和系统进化树分析,具体分析软件如下:
1)蛋白质理化性质预测
http://web.expasy.org/protparam/;
2)信号肽的预测
http://www.cbs.dtu.dk/services/SignalP/;
3)跨膜结构预测与分析
http://www.ch.embnet.org/software/TMPRED_form.html;
4)蛋白质二级结构预测
http://imtech.res.in/raghava/apssp/;
5)蛋白质三维结构的预测
https://swissmodel.expasy.org/interactive;
6)系统进化树分析
采用MEGA 4对水稻纹枯病菌RsPhm蛋白质与其他真菌RsPhm蛋白质的进化关系进行分析。
1.7 RsPhm基因定量表达分析
以水稻纹枯病菌甘油醛3-磷酸()基因作为内参基因,检测水稻纹枯病菌在不同浓度儿茶酚处理下基因在转录水平上的相对表达量。RNA样品用DNaseⅠ进行预处理后,用反转录试剂盒合成单链cDNA作为模板。基于已克隆的水稻纹枯病菌基因的cDNA序列,设计的一对引物为F01905和R01905;以基因为内参,引物为GAPDH和GAPDHR(表1)。qRT-PCR体系如下:SYBR Green PCR Master Mix为10 μL、10 μmol/L F01905和R01905引物各1 μL、不同样本的cDNA(稀释5倍)为2.0 μL,再加双蒸水6 μL,包括不加cDNA模板为阴性对照。在Bio-Rad CFX仪器上进行实时定量(qRT)PCR,反应程序如下:预变性95℃ 2 min;95℃变性15 s;60℃退火15 s,72℃延伸30 s,40个循环收集荧光。内参基因qRT-PCR体系,除引物不同外,其余参数同基因。数据收集和分析采用Bio-Rad CFX Manager Sofware 2.0进行分析,每个样品3次重复。
2 结果与分析
2.1 RsPhm基因核苷酸和氨基酸序列分析
将PCR产物纯化回收、连接转化、测序,对测序结果进行拼接并去掉载体序列,得到DNA和cDNA全长序列分别为2 628 bp和1 983 bp,与琼脂糖凝胶电泳结果一致(图1)。用DNAStar软件分析筛选获得的基因cDNA序列及其推导的氨基酸序列,以ATG为起始密码子,TAA为终止密码子,共编码660个氨基酸(图2)。经生物信息学分析,基因编码蛋白质分子式为C3226H5056N908O970S23;相对分子质量为72 818.51 ku,理论等电点为5.94,含碱性氨基酸74个,酸性氨基酸83个,疏水性氨基酸230个,极性氨基酸149个,属于酸性亲水性蛋白。RsPhm蛋白不含信号肽,预测其为非分泌蛋白。RsPhm蛋白存在5个跨膜螺旋结构域,由3个内到外和2个外到内的双向跨膜区域组成,属于跨膜蛋白。利用SWISS-MODEL网站对基因编码的蛋白质进行三维结构预测,发现RsPhm蛋白的三维结构主要由α-螺旋、β-折叠和不规则卷曲组成,并呈较均匀分布(图3)。
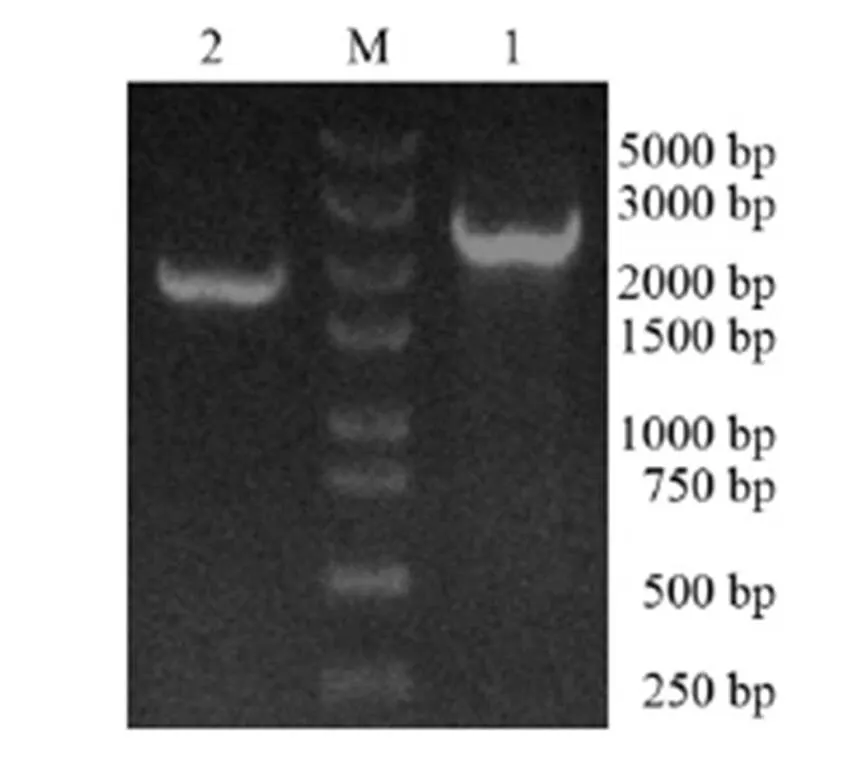
M―250 bp DNA标记; 1―以DNA为模板的RsPhm基因PCR产物; 2―以cDNA为模板的RsPhm基因PCR产物。
Fig. 1. PCR products ofgene in.

RsPhm为本研究结果,R. solani AG-1ⅠA、R. solani AG-1ⅠB、R. solani AG 22ⅢB、R. solani AG-3、R. solani AG-1ⅠB和R. solani 123E的NCBI GenBank注册号分别为ELU44059.1、CEL56393.1、CUA74266.1、EUC54794.1、CCO31161.1和KEP48781.1。
Fig. 2. Comparison of amino acid sequences of RsPhm proteins in different anastomosis groups of
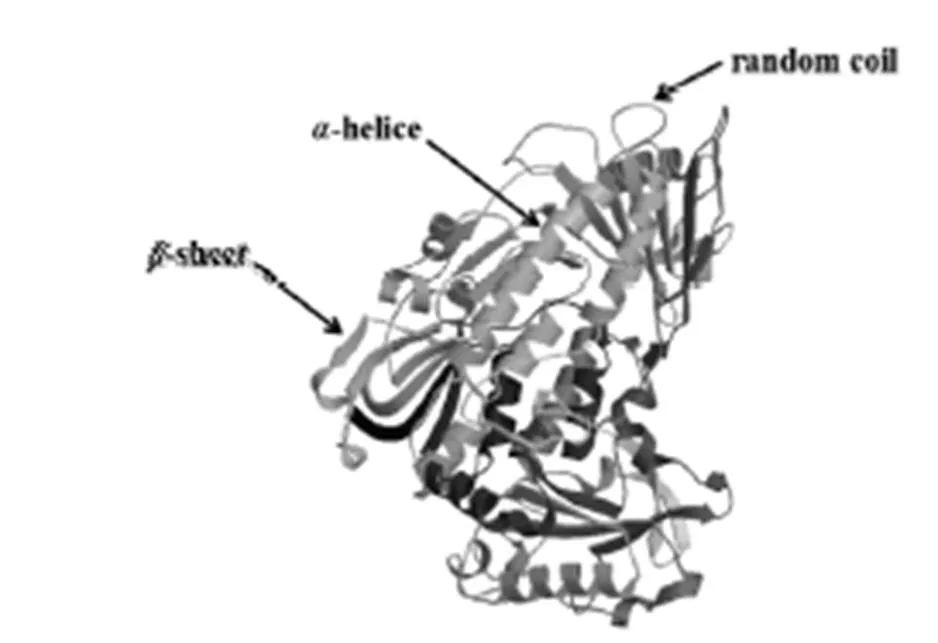
图3 水稻纹枯病菌RsPhm蛋白三维结构预测
Fig. 3. Three-dimensional structure prediction of RsPhm protein inAG-1 IA.
2.2 RsPhm蛋白氨基酸序列系统进化树分析
通过NCBI网站分析工具,对立枯丝核菌与其他近缘真菌之间的RsPhm蛋白氨基酸序列同源性进行比较。结果显示,本研究的水稻纹枯病菌(AG-1ⅠA)与立枯丝核菌()其他融合群或亚群的氨基酸同源性最高,均达到91%以上;其中与同一融合亚群(AG-1ⅠA, ELU44059.1)另一个菌株的同源性达94 %,与其他菌株或融合群的(123E、AG-1ⅠB、AG22ⅢB和AG-3)的同源性分别为93%、93%、91%和91%。而与离心射脉革菌()、多叶奇果菌()、白腐菌()、白环菇(sp. SymC. cos)、真姬菇()的氨基酸同源性分别为54%~59%、57%、55%,56%和54%,同源性较低。
为比较立枯丝核菌RsPhm蛋白氨基酸序列与其他近缘真菌RsPhm蛋白氨基酸序列的亲缘关系,本研究从GeneBank中查询得到立枯丝核菌不同融合群菌株与离心射脉革菌、多叶奇果菌、白腐菌、白环菇和真姬菇的RsPhm蛋白氨基酸序列,与本研究克隆出来的RsPhm蛋白氨基酸序列进行比对,随后利用MEGA 4软件N-J法构建系统进化树,Bootstrap自举值取1 000 次,显示不同种属真菌的进化及亲缘关系(图4)。系统进化树分析结果表明本研究克隆的RsPhm蛋白氨基酸序列和水稻纹枯病菌AG-1ⅠA其他菌株RsPhm蛋白氨基酸的序列同源性最高,同属担子菌门(Basidiomycota),同时立枯丝核菌不同的融合群菌株独立进化为一支,表现出的亲缘关系较其他真菌门的真菌更近,而与亲缘关系较远的其他真菌同源性则较低,与分类学地位及传统形态学分类结果一致,因而推测不同真菌种类的基因在进化上具有一定的保守性。
2.2 儿茶酚诱导下RsPhm基因相对定量表达分析
对水稻纹枯病菌基因在不同浓度儿茶酚诱导下的转录表达情况进行了qRT-PCR分析,结果表明,在12.5~100 µg/mL浓度范围内的儿茶酚普遍能诱导基因上调表达。与对照相比,在12.5 µg/mL儿茶酚诱导下表达量相对最高,极显著上调35.7倍;在25 µg/mL和50 µg/mL儿茶酚处理下上调表达量分别为19.1倍和28.4倍;但在100 µg/mL儿茶酚处理下上调表达量仅2.1倍。究其原因,可能是高浓度儿茶酚抑制水稻纹枯病菌生长,进而负调控基因的表达(图5)。儿茶酚是水稻纹枯病菌黑色素形成的前体合成物质,推测基因表达水平与黑色素形成关系密切。
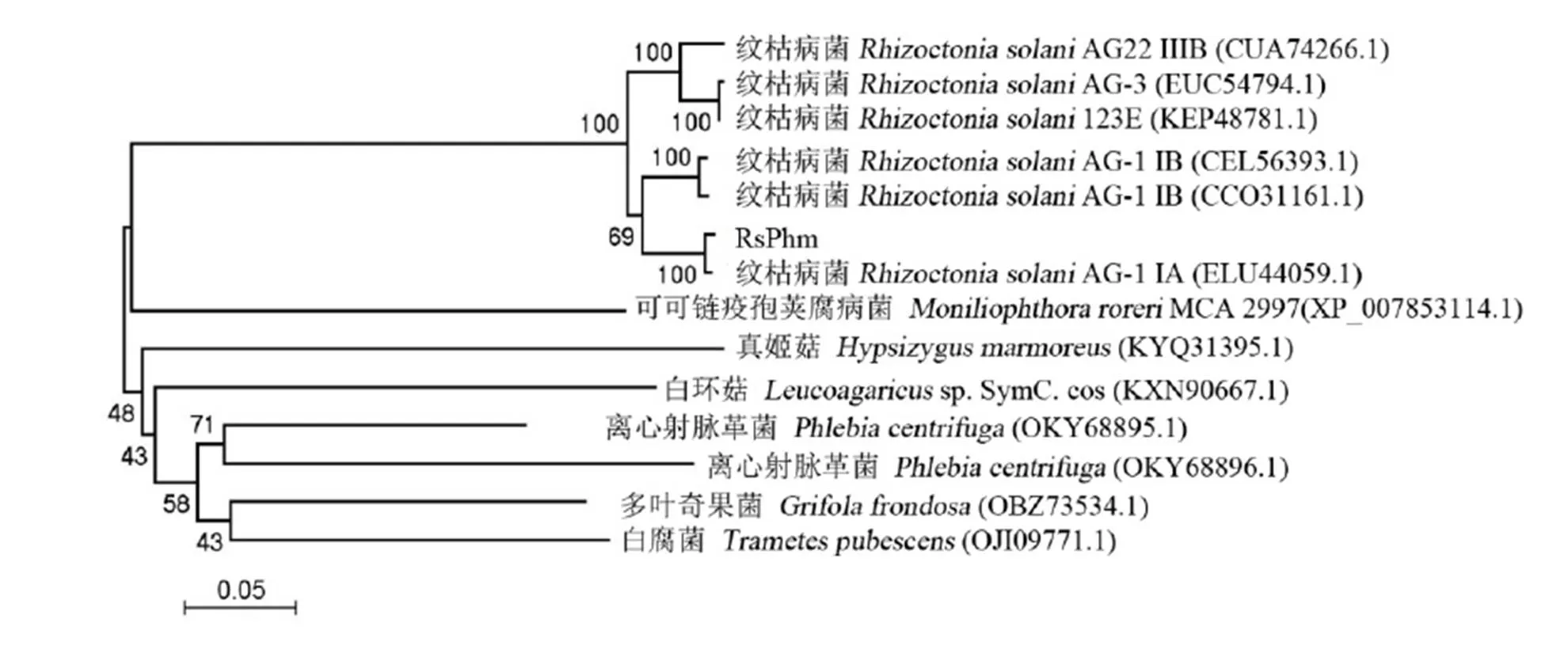
图4 立枯丝核菌与其他近缘真菌的RsPhm蛋白氨基酸序列的系统进化树
Fig. 4. Phylogenetic tree of amino acid sequences of RsPhm proteins fromand other related fungi.
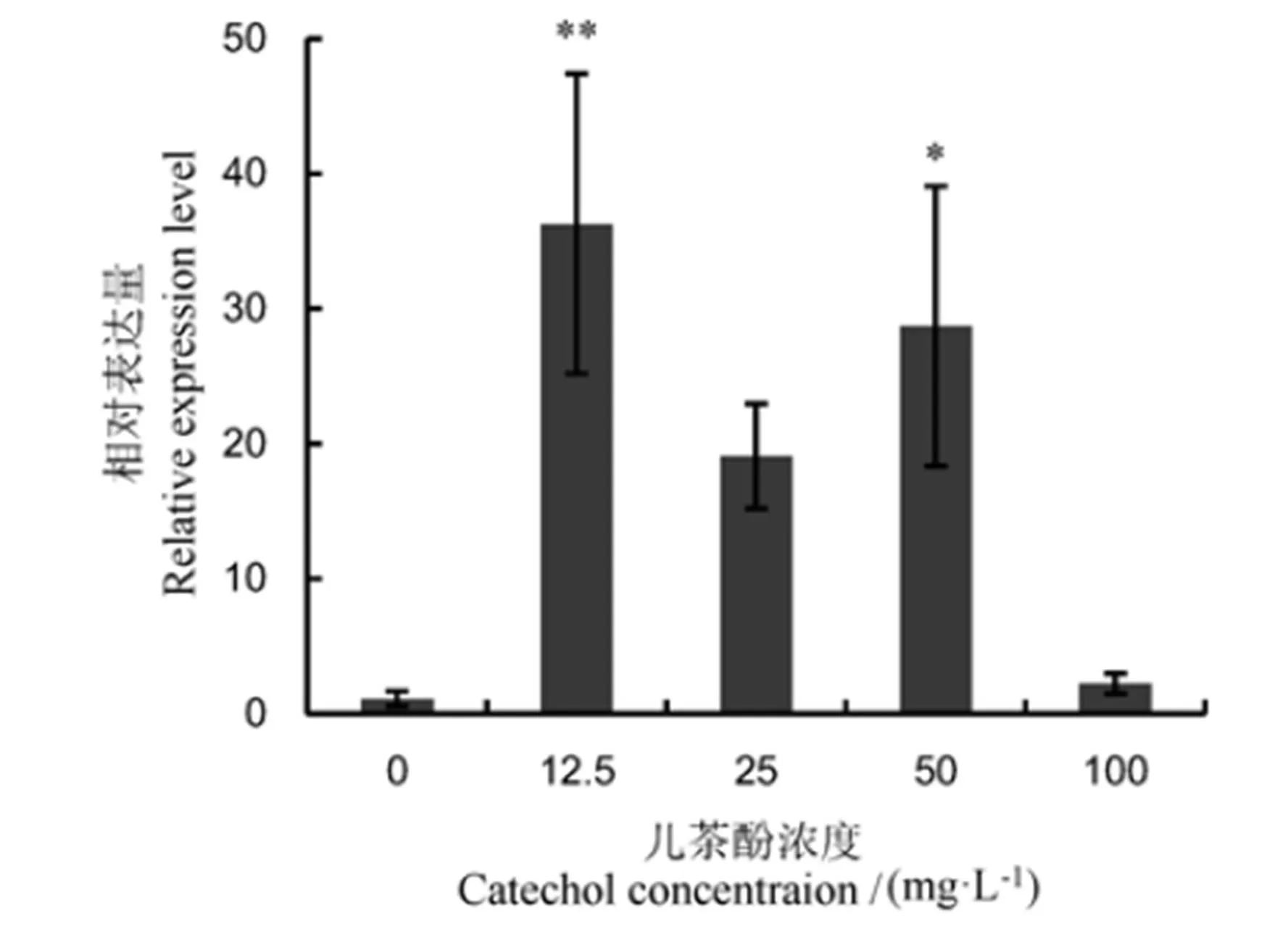
表中数据为3次重复的平均值±标准误。*和**分别表示相对于对照在5%和1%上差异显著。
Fig. 5. Expression level ofgeneinAG-1 IA at different concentrations of catechol.
3 讨论
大多数的微生物都具有多个单加氧酶和双加氧酶。苯酚2-单加氧酶属于加氧酶家族,它是电子传递链上最关键的蛋白,通常含有黄素腺嘌呤二核苷酸(FAD)和铁硫簇[2Fe-2S],通过辅基负责将电子从NAD(P)H传递给羟化酶的双铁中心。本研究中RsPhm蛋白具有FAD结构域,跟其他立枯丝核菌的二级结构大致相同(图2)。在己烷、乙醚和抗坏血酸的存在下,能提高嗜麦芽窄食单胞菌() KB2菌株的苯酚2-单加氧酶的酶活[17]。嗜酸硫化芽孢杆菌()可以将苯酚羟化成低毒的中间物质,因此在降解污染物苯酚中发挥着重要的作用[18]。恶臭假单胞菌菌株DLL-E4(DLL-E4) 的偏三苯酚1, 2-双加氧酶基因() 能够对硝基苯酚和对苯二酚进行降解,而敲除菌株DLL-Δ仍然具有利用硝基苯酚和对苯二酚的能力,表明恶臭假单胞菌DLL-E4中除参与PNP降解代谢过程外,还存在另一个双加氧酶能够代谢PNP,进而部分恢复了敲除的的功能[19]。恶臭假单胞菌PaW85(PaW85)的包含儿茶酚1,2-双加氧酶()和苯酚2-单加氧酶()参与苯酚的降解途径[20]。恶臭假单胞菌()和假单胞菌()都含有儿茶酚1,2-双加氧酶基因和邻苯二酚2,3-双加氧酶基因,能通过多元苯酚羟化酶和邻位裂解途径降解长链烷基酚[21]。由此可见,单加氧酶和双加氧酶对微生物代谢有机污染物具有重要作用。水稻纹枯病菌基因在儿茶酚诱导下的表达模式结果表明,随着儿茶酚浓度升高,基因表达水平提高,同时儿茶酚是RsPhm酶催化的底物,说明基因起到降解儿茶酚的作用。实验室前期发现儿茶酚和硫脲等抗氧化剂显著减少了菌核质量和数量[22]。儿茶酚作为菌丝和菌核黑色素形成的前体合成物质,促进黑色素的合成,从而使细胞壁和细胞膜黑化和加厚[14]。这些结果说明基因在水稻纹枯病菌菌核发育和黑色素形成中起到重要作用。
黑色素的合成和形成过程十分复杂。近年对生物体内黑色素合成途径的研究明确了黑色素起源于4种不同的中间产物:γ-谷氨酰胺酰-3,4-对苯二酚(γ-glutaminyl-3, 4-dihydroxybenzene, GDBH)、多巴(DOPA)、1,8-二羟基萘(DHN)和儿茶酚[23]。核盘菌()能够不断产生DHN黑色素,当共同培养核盘菌与白腐菌()时,白腐菌释放的黑色素降解酶能使核盘菌的黑色素层降解,从而使失去保护层的核盘菌遭受其他溶菌酶的降解,原因是核盘菌黑色素层的存在能帮助其抵御-葡聚糖酶和几丁质酶的降解[24]。白腐菌产生木质素降解酶,通过过氧化酶代谢途径可降解黑酵母()黑色素[25]。人类致病真菌新生隐球菌()合成黑色素与毒力密切相关,可以控制黑色素的合成从而降低致病力[26, 27]。立枯丝核菌不同融合群菌丝细胞壁黑色素含量与微生物裂解的敏感性或抗性之间存在相关性,同时也跟致病力密切相关[28, 29]。
本研究结果表明,添加外源儿茶酚可以提高基因的表达量,说明水稻纹枯病菌在儿茶酚胁迫下被诱导表达,但不同的儿茶酚浓度诱导表达量上调倍数不同。因此,水稻纹枯病菌苯酚2-单加氧酶基因表达水平与黑色素形成和菌核发育关系密切。对RsPhm蛋白氨基酸序列的系统进化树分析表明,立枯丝核菌不同的融合群菌株独立进化为一支,说明不同的融合群的菌株具有较近的亲缘关系,而与离心射脉革菌、多叶奇果菌、白腐菌、白环菇、真姬菇的氨基酸同源性较低,亲缘关系的远近和本身的分类学地位及传统形态学分类结果一致。因此,不同种属真菌之间基因在进化上具有一定的保守性。该结果为进一步深入研究水稻纹枯病菌黑色素形成和菌核发育机理奠定了基础。
[1] Webb K M, Freeman C, Broeckling C D. Metabolome profiling to understand the defense response of sugar beet () toAG 2-2 IIIB., 2016, 94: 108-117.
[2] Hannukkala A O, Rastas M, Laitinen P, Latvala S.injuries in oilseed crops in Finland and impacts of different crop management practices on disease incidence and severity., 2016, 169(2): 257-273.
[3] 邹成佳, 唐芳, 杨媚, 贺晓霞, 李献军, 周而勋. 华南3省(区)水稻纹枯病菌的生物学性状与致病力分化研究. 中国水稻科学, 2011, 25(2): 206-212.
Zou C J, Tang F, Yang M, He X X, Li X J, Zhou E X. Studies on biological characteristics and pathogenicity differentiation of rice sheath blight pathogen from three provinces in South China.,2011, 25(2): 206-212. (in Chinese with English abstract)
[4] Feng S J, Shu C W, Wang C J Z, Jiang S H, Zhou E X. Survival ofAG-1 IA, the causal agent of rice sheath blight, under different environmental conditions., 2017, 165(1): 44-52.
[5] 刘卫东.DLL-E4 1,2,4 -苯三酚1,2-双加氧酶的晶体结构及两种农药降解相关酶的蛋白质晶体学研究. 南京: 南京农业大学, 2010.
Liu W D. Structural analysis of hydroxyquinol 1, 2-dioxygenase fromDLL-E4 and crystallographic study on two pesticide degradation related enzymes. Nanjing: Nanjing Agricultural University,2010. (in Chinese with English abstract)
[6] Neujahr H Y, Gaal A. Phenol hydroxylase from yeast. Sulfhydryl groups in phenol hydroxylase from., 1975, 58(2): 351-357.
[7] Yotinov I, Todorova Y, Schneider I, Daskalova E, Topalova Y. The effect of nanodiamonds on phenol biodegradation bysp. strain isolated from polluted sediments., 2016, 16(7): 7696-7706.
[8] Nakagawa H, Takeda Y. Phenol hydroxylase., 1962, 62(2): 423-426.
[9] Yang R D, Humphrey A E. Dynamic and steady state studies of phenol degradation in pure and mixed cultures., 1975, 17(8): 1211-1235.
[10] Hamada T, Asanagi M, Satozawa T, Araki N, Banba S, Higashimura N, Akase T, Hirase K. Action mechanism of the novel rice blast fungicide tolprocarb distinct from that of conventional melanin biosynthesis inhibitors., 2014, 39(3): 152-158.
[11] Chai L Y A, Netea M G, Sugui J, Vonk A G, van de Sande W W J, Warris A, Kwon-Chung K J, Jan Kullberg B.conidial melanin modulates host cytokine response., 2010, 215(11): 915-920.
[12] Soares A R, de Lourdes Lucio Ferrarese M, de Cássia Siqueira-Soares R, Marchiosi R, Finger-Teixeira A, Ferrarese-Filho O. The allelochemical 1-dopa increases melanin production and reduces reactive oxygen species in soybean roots., 2011, 37(8): 891-898.
[13] Piattelli M, Fattorusso E, Magno S, Nicolaus R A.melanin, a naturally occurring catechol melanin., 1963, 4(15): 997-998.
[14] Chen J Y, Wang C J Z, Shu C W, Zhu M H, Zhou E X. Isolation and characterization of a melanin from, the causal agent of rice sheath blight., 2015, 142(2): 281-290.
[15] Yang Y Q, Yang M, Li M H, Zhou E X. Cloning and functional analysis of an endo-PG-encoding geneof, the causal agent of rice sheath blight., 2012, 34(3): 1-12.
[16] Zheng A P, Lin R M, Zhang D H, Qin P G, Xu L Z, Ai P, Ding L, Wang Y R, Chen Y, Liu Y, Sun Z G, Feng H T, Liang X X, Fu R G, Tang C Q, Li Q, Zhang J, Xie Z L, Deng Q M, Li S C, Wang S Q, Zhu J, Wang L X, Liu H N, Li P. The evolution and pathogenic mechanisms of the rice sheath blight pathogen., 2013, 4: 1424.
[17] Wojcieszynska D, Gren I, Labuzek S, Respondek M. Substrate specificity and sensitiveness of phenol monooxygenase fromstrain KB2 versus their potential application to bioremediation of the environment., 2007, 2: 181-191.
[18] 李朦. 嗜酸硫化芽孢杆菌苯酚羟化酶还原酶组分的重组表达与性质研究. 厦门: 国家海洋局第三海洋研究所, 2016.
Li M. Expression and characterization of the phenol hydroxylase reductase fromTPY. Xiamen: The Third Institute of Oceanography, State Oceanic Administration, 2016. (in Chinese with English abstract)
[19] 沈文静, 张静, 曹慧, 崔中利. 恶臭假单胞菌DLL-E4对硝基苯酚降解途径关键基因的突变分析. 生态与农村环境学报, 2008, 24(4): 77-82.
Shen W J, Zhang J, Cao H, Cui Z L. p-nitrophenol degradation characteristics of hydroxyquinol1, 2-D ioxygenase gene () knock-out mutant ofDLL-E4., 2008, 24(4): 77-82. (in Chinese with English abstract)
[20] Kasak L, Hôrak R, Nurk A, Talvik K, Kivisaar M. Regulation of the catechol 1, 2-dioxygenase- and phenol monooxygenase-encodingoperon inPaW85., 1993, 175(24): 8038-8042.
[21] Tuan N N, Hsieh H C, Lin Y W, Huang S L. Analysis of bacterial degradation pathways for long-chain alkylphenols involving phenol hydroxylase, alkylphenol monooxygenase and catechol dioxygenase genes., 2011, 102(5): 4232-4240.
[22] Lu L, Shu C W, Liu C J Z, Zhou E X. The impacts of natural antioxidants on sclerotial differentiation and development inAG-1 IA., 2016, 146(4): 729-740.
[23] Weijn A, Bastiaan-Net S, Wichers H J, Mes J J. Melanin biosynthesis pathway inmushrooms., 2013, 55(6): 42-53.
[24] Butler M J, Gardiner R B, Day A W. Melanin synthesis by, 2009, 101(3): 296.
[25] Butler M J, Day A W. Destruction of fungal melanins by ligninases ofand other white rot fungi., 1998, 159(6): 989-995.
[26] Casadevall A, Rosas A L, Nosanchuk J D. Melanin and virulence in., 2000, 3(4): 354-358.
[27] Eisenman H C, Chow S, Tsé K K, McClelland E, Casadevall A. The effect of L-DOPA ongrowth and gene expression., 2014, 2(4): 329-336.
[28] Hyakumachi M, Yokoyama K, Ui T. Role of melanin in susceptibility and resistance ofto microbial lysis., 1987, 89(1): 27-33.
[29] Kim H T, Chung Y R, Cho K Y. Mycelial melanization ofAG1 affecting pathogenicity in rice., 2001, 17: 210-215.
Cloning and Expression Analysis ofGene inAG-1ⅠA of Rice Sheath Blight Pathogen
JIANG Shaofeng, WANG Chenjiaozi, SHU Canwei, ZHOU Erxun*
(Guangdong Province Key Laboratory of Microbial Signals and Disease Control/College of Agriculture, South China Agricultural University, Guangzhou 510642, China;)
【Objective】In order to elucidate the functions of phenol 2-monooxygenase()gene in melanization ofKühn AG-1ⅠA, the causal agent of rice sheath blight,【Method】the gene was cloned by routine PCR andRT-PCR techniques, and the bioinformatics analysis of this gene was conducted; furthermore, therelative expression levelunder catecholstresswas determinedby using fluorescence quantitative real-time PCR (qRT-PCR) technique.【Result】Bioinformatics analysis showed that the full-lengthDNA and cDNA sequences ofgene were 2628 bp and 1983 bp, respectively, which encode660 amino acids. The phylogenetic tree analysis showed thatgene hada close relationship in different anastomosis groups (AGs) of, and a certain evolutionary conservation among different fungal species. Results of qRT-PCR indicated that the exposure to exogenous catecholcould improvethe expression level ofgene, and which peaked at 12.5 µg/mL of catechol,with a significant increase of 35.7 times, 19.1times and 28.4 timesup-regulated at 25 µg/mL and 50 g/mL, respectively, but only 2.1 times up-regulated at 100 g/mL.【Conclusion】The full-length sequence ofgene was obtained, its basic biological information was understood, and its expression pattern under catechol stress was clarified.Thesefindings will lay a basis for the scientific and systematic elucidation of regulatorymechanism of melanin formation bygene ofAG-1ⅠA.
Kühn AG-1ⅠA;gene; gene clone; expression analysis
Corresponding author, E-mail: exzhou@scau.edu.cn
Q785; S435.111.4+2
A
1001-7216(2018)02-0111-08
2017-08-10;
2017-08-25。
国家自然科学基金资助项目(31271994, 31470247)。
通讯联系人, E-mail: exzhou@scau.edu.cn
10.16819/j.1001-7216.2018.7094
