拟南芥WRKY61转录因子的转录活性与互作蛋白分析
2018-04-08范晓江郭小华牛芳芳江元清
范晓江,郭小华,牛芳芳,杨 博,江元清
(旱区作物逆境生物学国家重点实验室,西北农林科技大学 生命科学学院,陕西杨陵 712100)
植物WRKY基因家族是较大的转录因子家族之一,在拟南芥中有72个成员[1]。WRKY蛋白的N端具有保守的WRKY结构域,内含高度保守的7残基WRKYGQK序列, C端有非典型锌指结构。根据WRKY结构域序列的相似性和锌指结构类型,可以将WRKY转录因子家族成员分为3个亚族[2]。据报道,WRKY结构域能够与下游靶基因启动子区的W-box(TTGACC/T)结合并调节下游基因表达[3]。
研究表明,转录因子很少能单独发挥调控功能,而往往是通过彼此间瞬时或永久性的物理联系来实现其调控功能[4]。在过去的几年中,已经有大量与植物WRKY蛋白相互作用的WRKY转录因子被鉴定出来,这些转录因子与植物体内调控逆境信号网络、染色质重建、衰老进程或与其他细胞进程相关[4]。例如,在拟南芥中,AtWRKY18不仅可以对自身实现调控作用,还可以与AtWRKY40和AtWRKY60通过存在N端的亮氨酸拉链发生互作,这三者的相互作用在植物疾病防御过程中发挥了重要作用[5]。AtWRKY6与AtWRKY42可能存在互作,并调控PHO1基因表达以促进植物对低磷逆境的适应[6]。同样的,在拟南芥中,AtWRKY53、AtWRKY54与AtWRKY70会参与叶片衰老过程的调控,AtWRKY54与AtWRKY70对衰老起负调控作用,而且两者是与衰老的正调控转录因子AtWRKY53共同参与到植物的衰老过程中,并且三者很可能与AtWRKY30 发生互作后调控植物衰老[7]。而在水稻中,脱落酸(ABA)诱导的WRKY转录因子OsWRKY51会增强OsWRKY71与下游由赤霉素诱导的Amy32b基因启动子的结合能力,过表达相互作用的OsWRKY51与OsWRKY71会协同并特异地抑制下游基因Amy32b的表达,从而为脱落酸与赤霉素之间的交谈(cross-talk)提供了一个新的分子机制[8]。上述研究表明,WRKY转录因子间直接或间接的物理与功能联系,在应对外界环境胁迫、调控植物衰老进程等方面发挥着重要作用。但目前仍未见对AtWRKY61在这方面的报道。
本研究首先利用双荧光素酶报告系统得出AtWRKY61具有转录抑制活性,然后利用生物信息学软件分析并获知AtWRKY61、AtWRKY9与AtWRKY72具有高度相似的保守结构域,继而通过酵母双杂交和双分子荧光互补实验发现AtWRKY61与自身、AtWRKY9以及AtWRKY72存在互作。此外,qRT-PCR表明AtWRKY61对多种非生物逆境具有响应。这些发现为深入阐明AtWRKY61的功能与分子调控机制提供了坚实的基础。
1 材料和方法
1.1 试验材料
拟南芥和本氏烟草种子经常规消毒后播种于2 MS培养基(Caission labs)上,4 ℃黑暗层积处理2~3 d后移入22 ℃(光照)/20 ℃(黑暗)的温室中生长7 d,光周期为 14 h(光照)/10 h(黑暗)。然后移栽到营养土中。
1.2 试验方法
1.2.1亚细胞定位为了检测AtWRKY61在植物细胞内的定位情况,利用引物(表1)并通过高保真酶Pfu扩增出WRKY61的编码区,然后构建到pYJGFP载体GFP报告基因的上游。按照参考文献[9]描述方法进行烟草叶片注射。2 d后,在激光共聚焦显微镜(Olympus)下观察叶片荧光。
1.2.2WRKY转录因子氨基酸序列分析利用ClutsalX1.83与Boxshade(http://www.ch.embnet.org/software/BOX_form.html)进行多重序列比对分析。
1.2.3拟南芥原生质体分离与瞬时表达利用引物(表1)通过高保真酶Pfu扩增出WRKY61的编码区并构建到载体pRT107-GAL4BD中,内参为pTRL。由35S启动子启动表达的WRKY61会结合到报告基因上游的5xWbox上,驱动报告基因LUC的表达,然后根据建议利用试剂测定荧光值。拟南芥原生质体提取与PEG转化参考本室之前的方法进行[10]。转化后的原生质体通过200 μL裂解缓冲液提取上清,利用Dual Luciferase Reporter Assay试剂盒(Promega)测定上清中FLUC与RLCU的信号强度,FLUC表示AtWRKY61结合到5xWbox上启动LUC基因表达后测定的荧光值,RLUC表示在内参中由35S启动子启动LUC基因表达后测定的荧光值。AtWRKY61与启动子的结合能力用FLUC对RLUC的比值表示,每个配对进行3个生物学重复实验。
1.2.4实时荧光定量RT-PCR拟南芥种子经常规消毒后播种于2 MS培养基上,4 ℃黑暗层积处理2~3 d后移入22 ℃(光照)/20 ℃(黑暗)的温室中生长7 d,光周期为 14 h(光照)/10 h(黑暗)。然后将7 d幼苗转移至正常2 MS培养基或包含不同逆境处理的培养基平板上,包括200 mmol/L NaCl(MP Biomedicals)、50 μmol/L 脱落酸(Sigma, USA)、10 μmol/L 甲基紫精(MV,Sigma)和12.5%PEG8000(MP Biomedicals)。同时,将同批的7 d幼苗转移到2 MS培养基平板后,进行4 ℃与37 ℃的冷害和热害处理。另外,还进行低钾胁迫处理,把MS培养基中的大部分KNO3替换为等摩尔的NH4NO3,配制K+终浓度为100 μmol/L培养基平板,所有配制低钾试剂均购买自Alfa Aesar(France)。各个处理1、3和12 h收样保存至-80 ℃。照此进行3次生物学重复,RNA提取以及qRT-PCR方法参考本室已发表文章[11]。内参基因采用UBQ10与UBC21,最后计算几何平均值并进行统计分析。
1.2.5酵母双杂交实验(Y2H)将AtWRKY61的编码区通过亚克隆到pGBKT7与pGADT7载体的NdeI与BamH I位点间。 酵母AH109菌株的感受态细胞的制备参考Clontech 公司的Yeast Protocol Handbook手册,将构建成功的重组质粒通过PEG4000介导的热激方法顺序转入到感受态细胞中。随后,将100 μL 重悬菌液涂布于缺陷型酵母合成培养基(SD-LW)上,于30 ℃恒温箱内倒置培养2~3 d。然后,挑选二缺陷型酵母合成培养基(SD-LW)上的菌落接种到约5 mL YEPD培养基中,于30 ℃恒温振荡培养14~16 h,检测菌液的OD600值,再将菌液用无菌的双蒸水稀释至OD600等于0.5, 再进行梯度稀释,即1/10、1/100、1/1 000。最后,分别取菌液2 μL点样至二缺陷型(SD-LW)、三缺陷型(SD-LWH)和四缺陷型(SD-LWHA)酵母合成培养基,倒置于30 ℃恒温培养,检测互作强度并对四缺陷型酵母合成培养基(SD-LWHA)进行X-gal染色,及时拍照记录[9]。
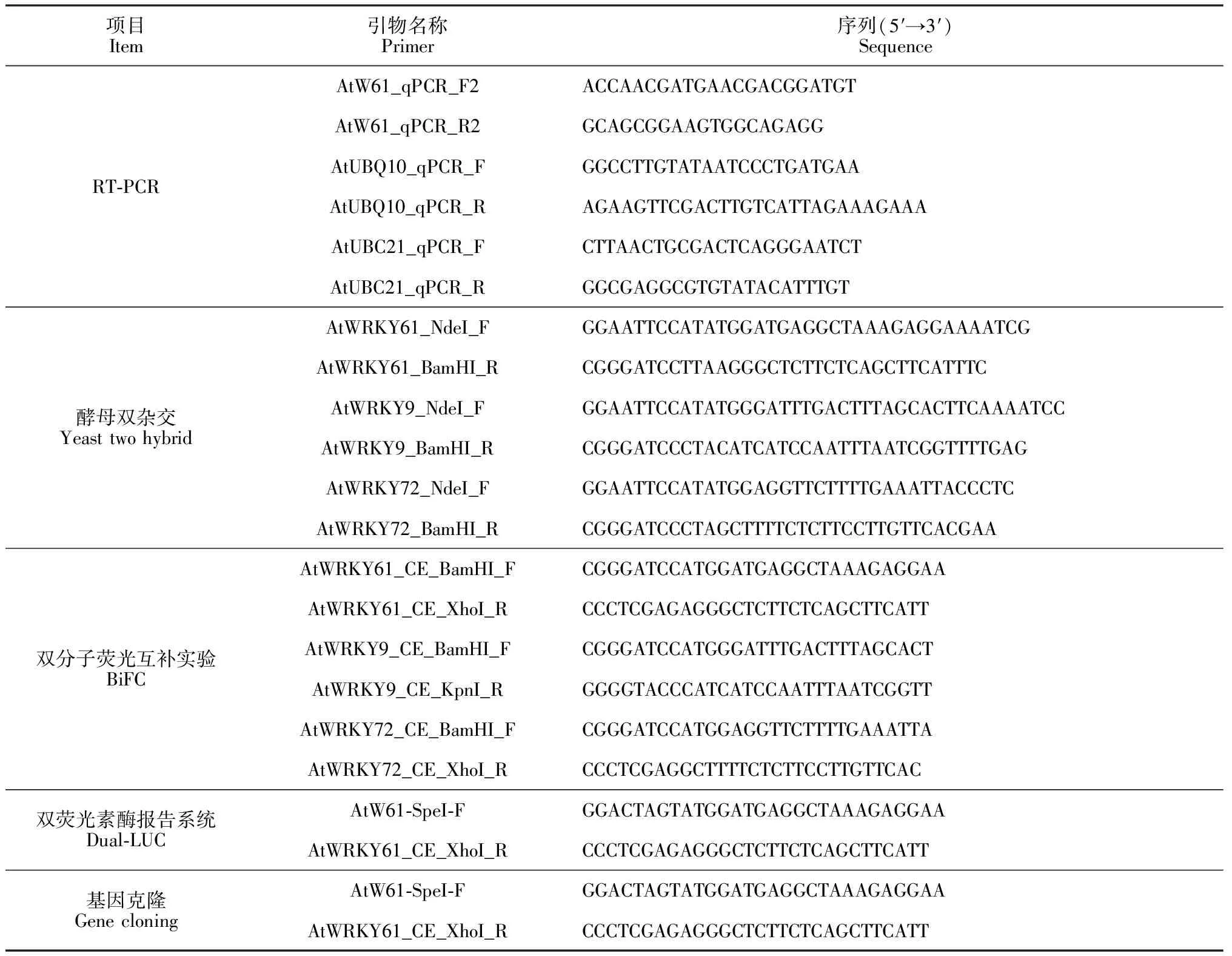
表1 实验所用引物
1.2.6双分子荧光互补实验(BiFC)利用引物(表1)并通过高保真酶Pfu扩增出WRKY61、WRKY9和WRKY72的编码区。然后将WRKY61编码区构建到35S-SPYNE(R)173和35S-SPYCE(M)载体中,把WRKY9和WRKY72构建到35S-SPYCE(M)。通过冻融法转化入农杆菌GV3101,28 ℃生长2 d后挑取单菌落于28 ℃震荡培养16~18 h,利用紫外分光光度计测量菌液OD值,之后利用AS将菌液稀释到OD为0.5,并将WRKY61、WRKY9、P19与WRKY61、WRKY9、P19配对按1∶1∶1混合黑暗培养3~4 h,注射32 d的烟草叶片。48 h后,在激光共聚焦显微镜(Olympus)下观察叶片表皮细胞的黄色荧光蛋白的信号[12]。
2 结果与分析
2.1 AtWRKY61基因cDNA克隆与亚细胞定位
首先利用TAIR网站公布的At1g18860的序列信息,设计了基因特异的正反向引物,通过RT-PCR扩增得到AtWRKY61的编码区(CDS)序列,并构建到含有GFP报告基因的pYJGFP载体中。经过测序验证,确认获得了AtWRKY61的CDS序列,长度为1 440 bp。 软件分析结果(图1)表明,At-WRKY61编码的蛋白含有一个WRKY结构域,具有C2H2型锌指结构,分类上属于WRKY基因家族的第二亚家族中的b组(Group IIb)。Blastp分析结果(图1)表明,AtWRKY61与同组的AtWRKY9以及AtWRKY72的序列同源性最高,尤其是WRKY结构域的一致性最高,而N-末端以及C-末端的相似性很低(图1)。
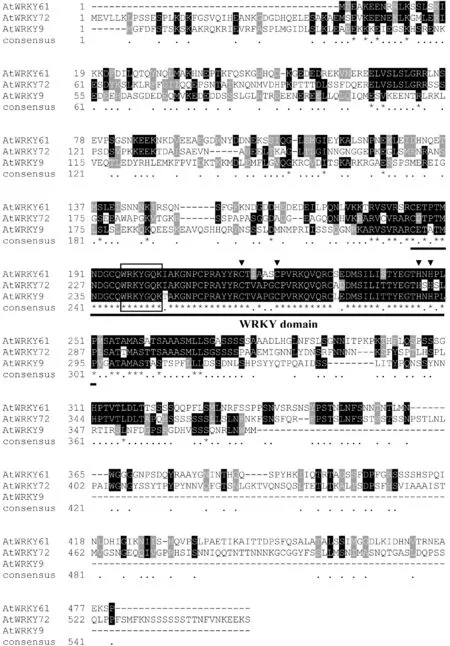
黑色和灰色阴影表示保守氨基酸区域,下划线表示WRKY结构域,WRKYGQK区用黑色方框画出,序列上方的黑色三角形表示锌指结构图1 拟南芥3个IIb亚族WRKY转录因子蛋白序列比对The conserved and less conserved amino acids are shaded in black and grey, respectively. The conserve WRKY domain (~60 aa.) was underlined with peptide stretch WRKYGQK boxed. The four conserved amino acid residues of the potential zinc ligands are indicated by black triangles above the sequencesFig.1 Comparison of amino acid sequences of three Group IIb WRKY transcription factors

图2 AtWRKY61蛋白在烟草叶片中的亚细胞定位Fig.2 Subcellular localization of AtWRKY61 in N. benthamiana cells
为了研究AtWRKY61蛋白的亚细胞定位情况,把AtWRKY61编码区构建到pYJGFP载体GFP报告基因的上游,并在本氏烟草叶片中表达。48 h后观察发现融合蛋白AtWRKY61 GFP的信号只定位在烟草叶片细胞核中(图 2),与其作为转录因子的核定位结论是一致的。
2.2 AtWRKY61 转录抑制活性检测
为了确定AtWRKY61蛋白的功能特点,很有必要了解AtWRKY61蛋白是否对转录具有激活或抑制作用。为此,利用拟南芥原生质体的瞬时表达系统[13]来进行研究。WRKY转录因子通常可以与下游靶基因的w-box(TTGCA/T)结合从而调节下游基因表达水平,所以将AtWRKY61的编码区构建到效应质粒pRT107-GAL4BD中,利用串联重复5次的W-box和CaMV35S最小启动子驱动FLUC基因作为报告基因表达框架,并利用CaMV35S启动子驱动RLUC基因作为内参(图 3,A)。结果表明AtWRKY61具有显著的转录抑制活性,表现在FLUC/RLUC的比值显著低于空载体的对照(图 3,B)。此外,利用串联重复5次的W-box和CaMV35S启动子驱动FLUC基因作为报告基因表达框架,类似地进行了转录活性分析。结果表明,AtWRKY61表达所调节的FLUC/RLUC比值也显著低于空载体的对照,说明AtWRKY61起到转录抑制作用。
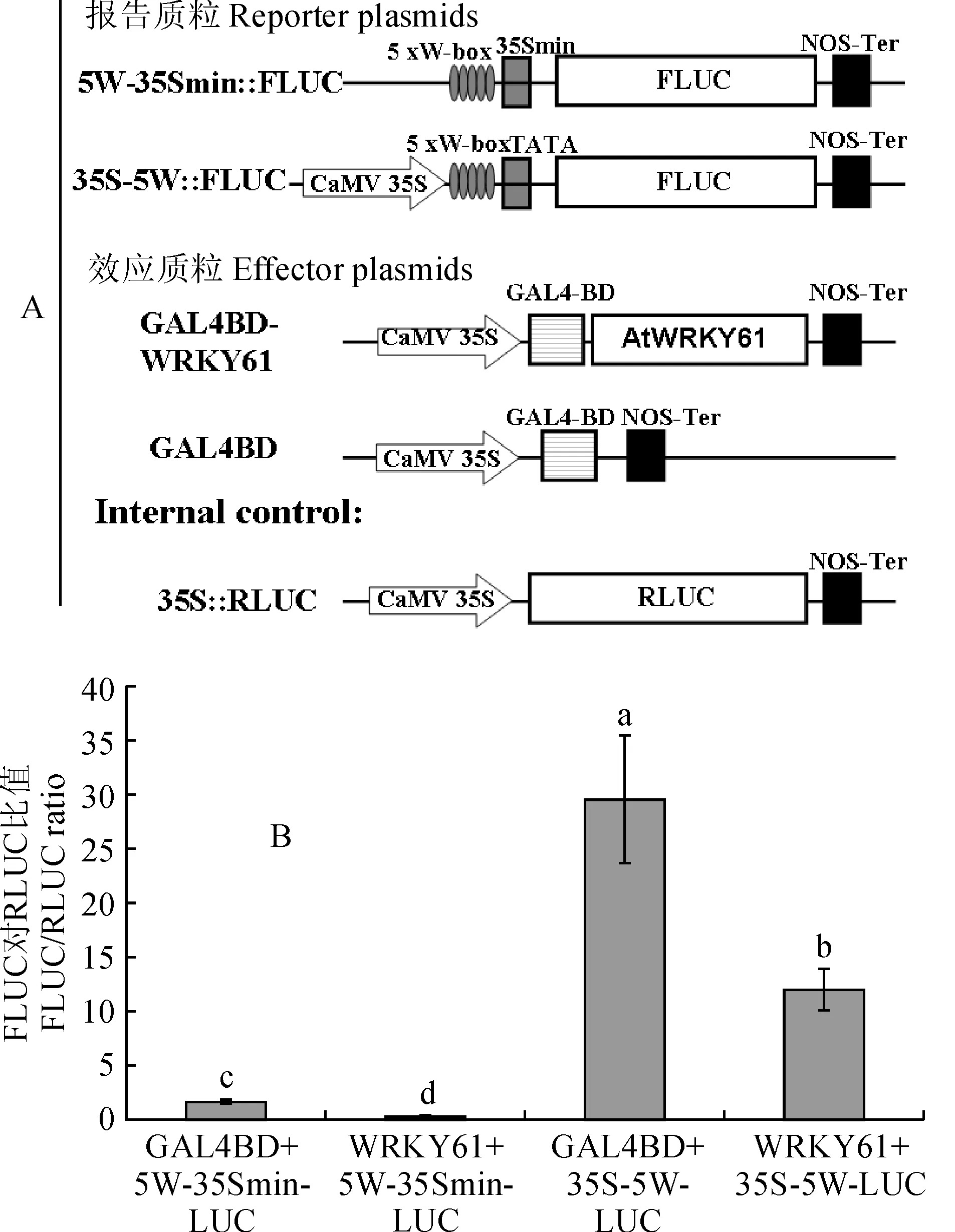
A.瞬时表达载体构建示意图; B. WRKY61与对照GAL4BD对LUC基因表达水平的影响。柱状图表示3个生物学重复的平均值±标准误差(SE),利用Student t test进行显著性分析(P<0.05)图3 AtWRKY61蛋白的转录活性分析A.The schemes of transient expression plasmids construction. B. Effect of AtWRKY61 and GAL4BD control on LUC gene expression level. Data is the mean of three biological replicates ±SE. Different normal letters denote significant differences by Student t test analysis (P<0.05)Fig.3 Transcriptional activity analysis of AtWRKY61
2.3 AtWRKY61基因应答非生物逆境处理的表达水平变化分析
利用qRT-PCR分析了AtWRKY61转录因子基因在冷害、热害、盐害、ABA、干旱等逆境下的表达水平变化,结果(图4)显示,以AtWRKY61在各逆境处理后表达量倍数变化值 1为对照,发现在冷害、ABA、PEG、MV及LK处理1、3和12 h后,AtWRKY61基因的表达量显著上升,但是在LP与LN以及Glu条件下没有明显变化。相反地,在热害与盐害逆境胁迫下处理1、3和12 h后,AtWRKY61基因的表达量被显著抑制。总之,AtWRKY61基因参与了包括非生物胁迫与激素刺激下的信号转导网络。
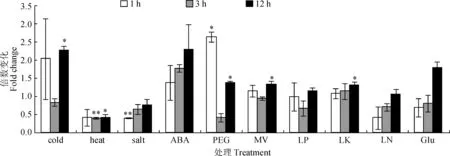
星号表示同一处理间AtWRKY61表达量与倍数变化1相比具有显著差异( * P<0.05; * * P<0.01)图4 AtWRKY61在多种非生物逆境处理条件下的表达变化Asterisks denote significant differences under same treatment (compared to 1) by Student t test analysis (* P<0.05; ** P<0.01)Fig.4 Expression analysis of AtWRKY61 gene in response to a variety of stress treatments

图5 酵母双杂交分析AtWRKY61蛋白的互作蛋白Fig.5 Yeast two-hybrid-based identification of interacting partners of AtWRKY61
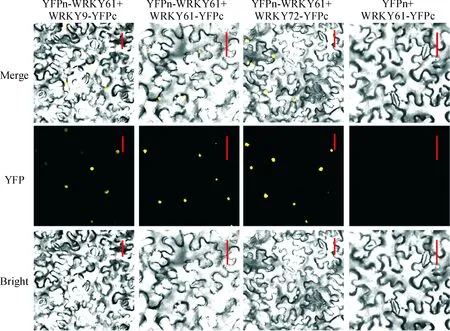
图6 AtWRKY61蛋白与互作蛋白的双分子荧光互补验证(标尺=50 μm)Fig.6 Confirmation of interactions between AtWRKY61 and other AtWRKYs through bimolecular fluorescence complementation (BiFC; Bar=50 μm)
2.4 AtWRKY61互作蛋白鉴定与验证
鉴于AtWRKY61是一个转录抑制因子,为了更好地理解AtWRKY61如何发挥作用,我们决定利用酵母双杂交(Y2H)实验来探究与WRKY61具有互作效应的蛋白。
首先分别把AtWRKYs编码区构建到pGBKT7与pGADT7中,并且将AtWRKY9与AtWRKY72编码区构建到pGADT7载体中,顺序并转化到AH109感受态细胞中,利用缺少亮氨酸、色氨酸、组氨酸与腺嘌呤氨酸的培养基平板进行互作测试。发现AtWRKY61除了可以与AtWRKY9、AtWRKY72发生互作外,还可以自身形成同源二聚体(图 5);通过X-gal染色分析,确认报告基因LacZ确实被互作蛋白配对激活。
为了验证上述互作的真实性,采用双分子荧光互补(BiFC)技术,在烟草体内进行了验证。为此,将上述3个AtWRKY基因的编码区分别构建到35S-SPYNE(R)173与35S-SPYCE(M)中,通过农杆菌共注射到烟草叶片中进行共表达,然后在激光共聚焦显微镜下观察YFP荧光,结果与Y2H是一致的,AtWRKY61既可以与AtWRKY9、AtWRKY72发生互作,也可以自身形成同源二聚体(图 6)。
3 讨 论
WRKY转录因子是植物最大的转录因子家族之一,在调控植物对生物、非生物逆境的响应以及生长发育等方面扮演者重要角色[14]。最近Gao[15]通过RNA-Seq研究表明AtWRKY61对萝卜皱纹病毒有负调控作用,所以AtWRKY61有可能参与植物免疫信号通路。此外,有研究发现AtWRKY9与cytochrome BC1 synthesi (BCS1)、NAD(P)H dehydrogenase B2(NDB2)发生互作,BCS1是位于线粒体外膜上与细胞死亡相关的蛋白,NDB2参与植物体内的氧化还原过程,表明AtWRKY61可能通过与AtWRKY9互作,对非生物胁迫作出响应[16]。WRKY72的抗病功能在拟南芥和番茄中具有部分保守性,并且这种抗病功能是依赖于抗病基因Mi-1的,暗示AtWRKY61可能通过与AtWRKY72共同参与植物的抗病信号通路[17]。所以探明AtWRKY61蛋白的功能特点以及作用机制对完善植物逆境信号通路具有重要意义。
本研究首先发现AtWRKY61定位在细胞核中,经生物信息学分析发现AtWRKY61具有保守的WRKY结构域。转录活性测试表明AtWRKY61具有转录抑制活性,同时qRT-PCR结果发现AtWRKY61对多种胁迫都有响应,这种对逆境胁迫的响应很可能通过AtWRKY61抑制相关基因表达而实现。之后,通过Y2H和BiFC实验,发现AtWRKY61与AtWRKY9、AtWRKY72互作。所以,AtWRKY61对多种胁迫的应答反应很可能与AtWRKY9、AtWRKY72的互作相关,为我们研究AtWRKY61如何参与调控逆境信号通路奠定了基础,同时本研究也丰富了我们对WRKY蛋白间互作的认识。
致谢:感谢德国明斯特大学Kudla Jorg教授提供的BiFC载体;感谢Profs. Yoko Nishizawa (National Institute of Agrobiological Sciences, Japan), 张劲松研究员(中国科学院遗传与发育生物学研究所)提供的LUC载体以及质粒。
参考文献:
[1]RUSHTON D L, TRIPATHI P, RABARA R C,etal. WRKY transcription factors: key components in abscisic acid signalling[J].PlantBiotechnologyJournal, 2012,10(1): 2-11.
[2]EULGEM T, RUSHTON P J, ROBATZEK S,etal. The WRKY superfamily of plant transcription factors[J].TrendsinPlantScience, 2000,5(5): 199-206.
[3]RUSHTON P J, SOMSSICH I E, RINGLER P,etal. WRKY transcription factors[J].TrendsinPlantScience, 2010,15(5): 247-258.
[4]CHI Y, YANG Y, ZHOU Y,etal. Protein-protein interactions in the regulation of WRKY transcription factors[J].MolecularPlant, 2013,6(2): 287-300.
[5]XU X, CHEN C, FAN B,etal. Physical and functional interactions between pathogen-inducedArabidopsisWRKY18, WRKY40, and WRKY60 transcription factors[J].PlantCell, 2006,18(5): 1 310-1 326.
[6]CHEN Y F, LI L Q, XU Q,etal. The WRKY6 transcription factor modulates PHOSPHATE1 expression in response to low Pi stress inArabidopsis[J].PlantCell, 2009,21(11): 3 554-3 566.
[7]BESSEAU S, LI J, PALVA E T. WRKY54 and WRKY70 co-operate as negative regulators of leaf senescence inArabidopsisthaliana[J].JournalofExperimentalBotany, 2012,63(7): 2 667-2 679.
[8]XIE Z, ZHANG Z L, ZOU X,etal. Interactions of two abscisic-acid induced WRKY genes in repressing gibberellin signaling in aleurone cells[J].PlantJournal, 2006,46(2): 231-242.
[9]LIANG W, YANG B, YU B J,etal. Identification and analysis of MKK and MPK gene families in canola (BrassicanapusL.)[J].BMCGenomics, 2013,14: 392.
[10]CHEN B, NIU F, LIU W Z,etal. Identification, cloning and characterization of R2R3-MYB gene family in canola (BrassicanapusL.) identify a novel member modulating ROS accumulation and hypersensitive-like cell death[J].DNAResearch, 2016,23(2): 101-114.
[11]ZHANG H, YANG B, LIU W Z,etal. Identification and characterization of CBL and CIPK gene families in canola (BrassicanapusL.)[J].BMCPlantBiology, 2014,14: 8.
[12]NIU F, WANG W, YAN J,etal. Functional characterization of NAC55 transcription factor from oilseed rape (BrassicanapusL.) as a novel transcriptional activator modulating reactive oxygen species accumulation and cell death[J].PlantMolecularBiology, 2016,92(1-2): 89-104.
[13]YOO S D, CHO Y H, SHEEN J.Arabidopsismesophyll protoplasts: a versatile cell system for transient gene expression analysis[J].NatureProtocols, 2007,2(7): 1 565-1 572.
[14]PHUKAN U J, JEENA G S, SHUKLA R K. WRKY transcription factors: molecular regulation and stress responses in plants[J].FrontPlantScience, 2016,7: 760.
[15]GAO R, LIU P, YONG Y,etal. Genome-wide transcriptomic analysis reveals correlation between higher WRKY61 expression and reduced symptom severity in turnip crinkle virus infectedArabidopsisthaliana[J].ScientificReports2016,6: 24 604.
[16]VAN AKEN O, ZHANG B, LAW S,etal. AtWRKY40 and AtWRKY63 modulate the expression of stress-responsive nuclear genes encoding mitochondrial and chloroplast proteins[J].PlantPhysiology, 2013,162(1): 254-271.
[17]BHATTARAI K K, ATAMIAN H S, KALOSHIAN I,etal. WRKY72-type transcription factors contribute to basal immunity in tomato andArabidopsisas well as gene-for-gene resistance mediated by the tomato R gene Mi-1[J].PlantJournal, 2010,63(2): 229-240.
