吉非替尼致肝毒性后非小细胞肺癌1例并文献复习
2018-04-08蒋梅郭然
蒋梅,郭然
广州中医药大学第一附属医院肿瘤中心一区,广州5104050
1 病例资料
患者,男性,58岁,于2015年1月因“活动后气促”到广州中医药大学第一附属医院就诊,检查胸部X线正位片提示:左侧中量胸腔积液,详见图1。入院行胸腔穿刺置管引流术,共引流出血性胸腔积液约2400 ml,症状好转后出院。胸膜活检病理提示:中分化腺癌浸润,考虑源于肺。确诊为非小细胞肺癌。免疫组化标记:细胞角蛋白(cytoker‐atin,CK)(+)、甲状腺转录因子‐1(thyroid transcrip‐tion factor‐1,TTF‐1)(±)、间皮瘤相关抗原 MC(-)。胸部增强CT诊断:左侧肺上叶前段周围型肺癌且向左侧胸膜转移,左侧胸腔积液,左侧肺部散在多发小结节影。既往无肝炎病史和输血史。血清肝炎病毒感染标志物均为阴性。
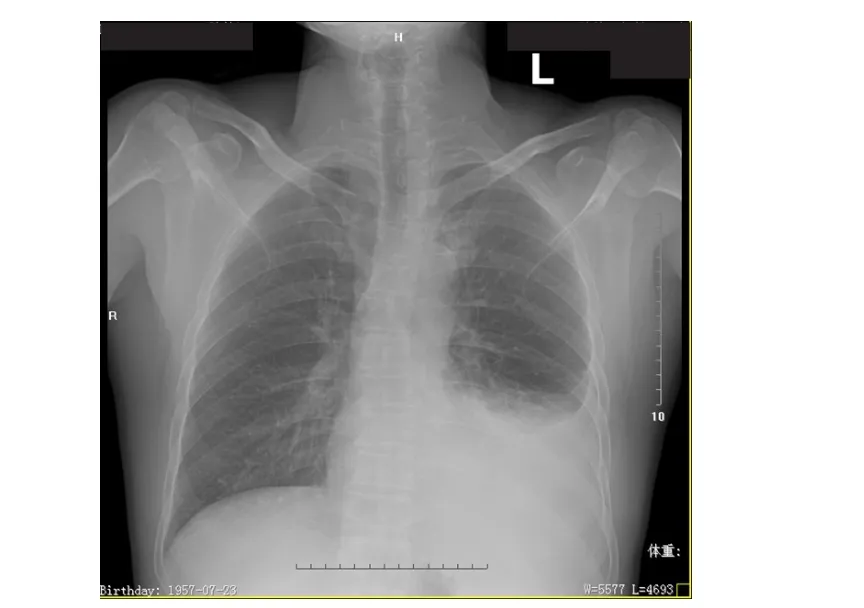
图1 2015年 1月6日胸部 X线正位片
2015年4 月,患者再次因“活动后气促”就诊,检查胸部X线片提示“左侧大量胸腔积液”入院。行胸腔穿刺置管引流术,引出血性胸腔积液约2000 ml。行胸膜活检组织基因检测提示:EGFR基因突变,21号外显子L858R错义突变。患者于2015年4月7日开始口服吉非替尼,每次250 mg,qd。于5月6日检测血清癌胚抗原(carcinoembry‐onic antigen,CEA)水平,由服药前69.3 μg/L降至10.21 μg/L;同时检查胸部CT,与4月CT比较,左侧肺上叶前段主动脉弓旁见一结节状软组织影,呈浅分叶,较前稍减小,现肿物大小约为24 mm×16 mm×19 mm(原约为28 mm×21 mm×24 mm),左侧胸腔积液明显减少。血清谷草转氨酶(aspartate aminotransferase,AST)为215 U/L,谷丙转氨酶(al‐anine aminotransferase,ALT)为396 U/L,胆红素系列正常,提示3级肝毒性(依据美国国立癌症研究所通用毒性标准NCⅠ‐CTC 3.0版),嘱停服吉非替尼,加服还原型谷胱甘肽片,每次400 mg,tid。
停服吉非替尼20 d后,患者血清AST和ALT恢复正常。患者于2015年5月26日再次口服吉非替尼,每次250 mg,qd。服药1个半月,于7月7日复查血清AST为38 U/L,ALT为42 U/L,肝功能轻度损害;血清CEA水平继续下降,至4.86 μg/L。7月8日复查胸部CT,与5月6日CT比较,左侧肺上叶肿物减小,大小约为19 mm×17 mm×17 mm(原约为24 mm×16 mm×19 mm);左侧胸膜厚度减小,左侧斜裂胸膜处厚约为5 mm(原约为10 mm),左侧肺胸膜和左侧肺部散在多发小结节影减少。口服吉非替尼3个月后(中途因3级肝毒性停药20 d),疗效评价为部分缓解(依据实体瘤疗效评价标准RECⅠST)。
继续口服吉非替尼3个月,9月1日复查血清AST为83 U/L,ALT为126 U/L,肝功能2级损害;同时复查胸部CT,与7月8日CT比较,左侧肺上叶肿物大小约为18 mm×15 mm×17 mm(原约为19 mm×17 mm×17 mm),左侧胸膜多发局灶性增厚,与之前比较变化不明显,详见图2。嘱患者减少吉非替尼的剂量,隔日250 mg;2周后(9月14日)复查血清AST为87 U/L,ALT为117 U/L,仍为肝功能2级损害,未见改善,再次停服吉非替尼。
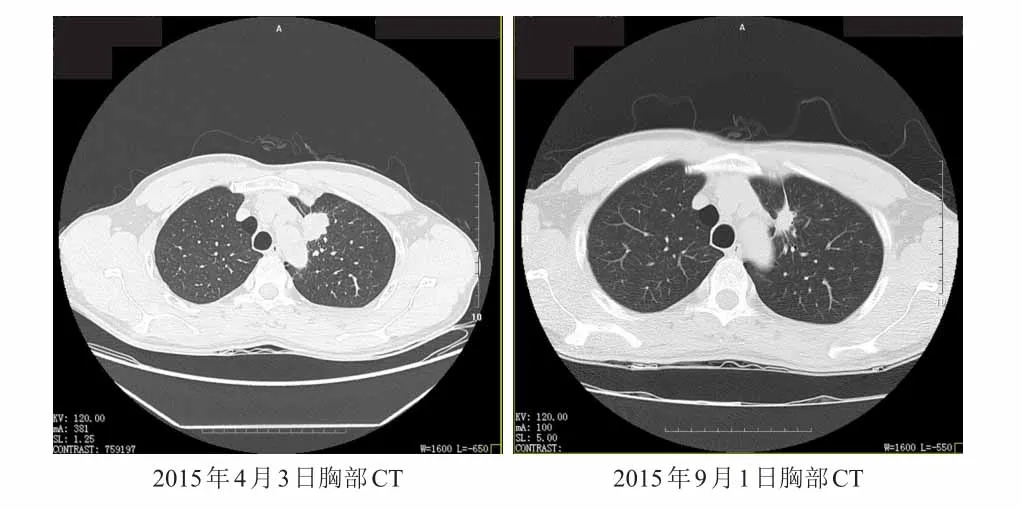
图2 吉非替尼治疗前后胸部CT比较
停药1个月余,于11月4日复查血清AST为58 U/L,ALT为64 U/L,较停药前有所恢复;但CEA为77.40 μg/L,明显升高。11月4日复查胸部CT,与9月1日CT比较,左侧肺上叶结节较前增大,呈浅分叶,见多发长毛刺,肿物大小约为21 mm×17 mm×23 mm(原约为18 mm×15 mm×17 mm),左侧胸腔积液明显增多。考虑口服吉非替尼近半年,疗效为部分缓解,但因肝毒性已减量、停药多次,病情进展,遂于2015年11月至2016年1月行吉西他滨+顺铂方案化疗4个疗程,化疗期间肝功能逐渐恢复。2月24日复查血清AST和ALT均在正常范围;CEA降至5.03 μg/L;同时复查胸部CT,与2015年12月18日CT比较,左侧肺上叶病灶变化不明显,大小约为25 mm×15 mm×21 mm,左侧胸腔积液减少。
3月3日,在局麻下行左侧肺上叶肿物穿刺活检+射频消融术,检查结果显示,肺组织内见上皮异型增生,呈腺样和乳头状结构,考虑“左肺”高分化腺癌。基因检测结果仍为EGFR突变,21号外显子L858R错义突变。
消融术后1个月,复查血清CEA为5.99 μg/L。患者于4月8日开始口服埃克替尼,每次125 mg,tid,连续口服3个月余,每月复查肝功能均正常。7月19日复查血清CEA降至3.36 μg/L。7月21日复查胸部CT提示,左侧肺上叶软组织影呈消融术后改变,大小约为32 mm×30 mm×29 mm,左侧胸腔积液少量。
嘱患者继续按照原剂量口服埃克替尼治疗,每月复查肝功能均正常。9月18日复查胸部CT,与7月21日CT比较,左侧肺上叶结节状软组织影缩小,大小约为30 mm×23 mm×28 mm(原约为32 mm×30 mm×29 mm),左侧胸腔积液稍增多,详见图3。至此,患者已连续口服埃克替尼5个月,未见肝功能异常,肿瘤疗效总体评价为稳定(依据实体瘤疗效评价标准RECⅠST);按照ECOG评分标准,患者的体力状况为1分,随诊中。
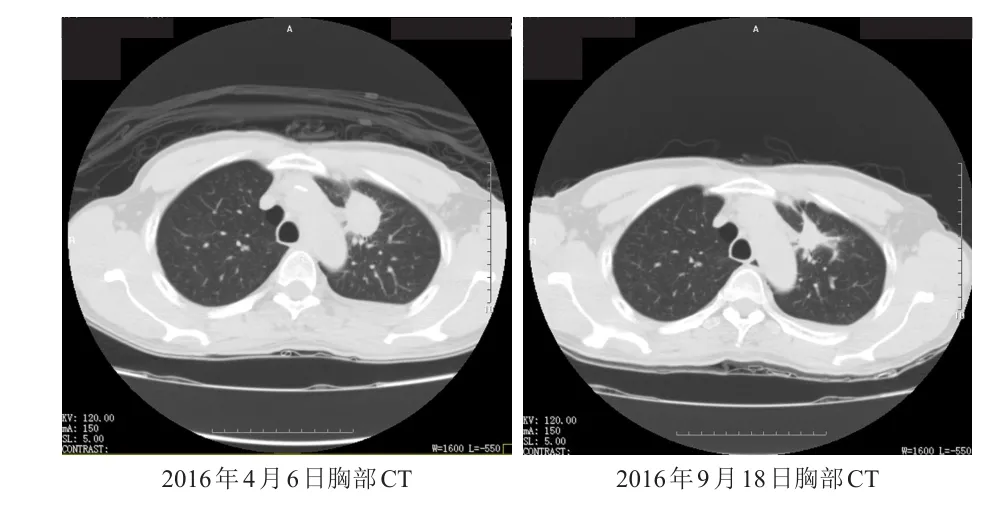
图3 射频消融术后,埃克替尼治疗前后胸部CT比较
2 讨论
对于表皮生长因子受体(epidermal growth fac‐tor receptor,EGFR)基因突变的晚期非小细胞肺癌(non‐small cell lung cancer,NSCLC)患者,采用EG‐FR‐酪氨酸激酶抑制剂(tyrosine kinase inhibitor,TKⅠ)靶向治疗,可以明显延长患者的生存期,目前报道的累计生存期已达3.5年[1]。
TKⅠ与传统的细胞毒化疗药物显著不同,被认为毒性极小,方便服用;然而,伴随其在晚期NSCLC患者一线、二线以及维持治疗中的广泛应用,EGFR‐TKⅠ的新毒性也逐渐引起人们重视。多项Ⅲ/Ⅳ期临床研究发现,一代EGFR‐TKⅠ(厄洛替尼和吉非替尼)的肝毒性发生较为常见,尤其是吉非替尼,在3级及以上的肝毒性发生率为1.0%~27.6%,明显高于化疗[2]。厄洛替尼所致的3级以上的肝损害发生率≤8.0%,低于吉非替尼,但仍明显高于化疗[3‐4]。多项病例报告显示,晚期肺癌患者口服吉非替尼或厄洛替尼治疗,可以导致重症肝衰竭甚至死亡[5‐7]。这可能是源于化学结构和代谢途径的差异,不同TKⅠ的肝毒性发生率存在差别。有研究显示,吉非替尼组患者的肝毒性发生率明显高于厄洛替尼组,差异有统计学意义[8]。有报道显示,晚期NSCLC患者口服埃克替尼治疗后,肝功能异常的发生率为7.4%,停药并予以保肝治疗后肝功能恢复正常,可以继续口服埃克替尼治疗[9]。
对于EGFR基因突变的NSCLC患者,一代TKⅠ获益显著,而二、三代TKⅠ如阿法替尼和AZD‐9291等价格昂贵,国内获取途径有限;因此,肝毒性停药后治疗策略的选择十分重要。有报道称,吉非替尼诱导肝毒性后成功转换到厄洛替尼治疗,可能是因为厄洛替尼对代谢酶CYP2D6和CYP3A5的敏感性弱于吉非替尼[10]。目前,EGFR‐TKⅠ停药后再暴露仅见于病例报告,没有大样本的研究数据支持。
本病例的患者口服吉非替尼治疗半年余,疗效达部分缓解,控制胸积液效果明显,但患者服药1个月余出现3级血清转氨酶升高,停药2周余迅速恢复,提示:吉非替尼导致药物性肝损害。考虑肿瘤治疗的效果显著,予再次用药,同时加用还原性谷胱甘肽护肝治疗,患者的耐受性尚可。3个月后患者逐渐出现轻、中度肝损害,降低吉非替尼的剂量2周后,未见缓解,予以停药。
药物性肝损害发生的机制复杂,主要与药物的体内代谢方式及宿主的遗传因素有关。多西他赛、吉西他滨、培美曲塞联合铂类的双药联合化疗方案被认为是治疗晚期NSCLC的标准治疗方案,但这3种治疗方案的肝毒性比较,缺乏数据分析,仅从药物动力学方面分析,多西他赛导致的肝毒性可能与抑制肝脏细胞色素P450酶活性有关[11],说明书注意事项中明确指出:血清转氨酶[ALT和(或)AST]超过正常值上限1.5倍,同时伴有碱性磷酸酶超过正常值上限2.5倍,存在发生严重不良反应的高度危险……这些患者不应使用,并且在基线和每个化疗周期前要检测肝功能;吉西他滨在肝脏、肾脏、血液和其他组织中被胞苷脱氨酶快速代谢,给药后一周内,吉西他滨给药剂量的92%~98%被检出,其中99%主要以dFdU形式经尿排泄,1%经粪便排泄;培美曲塞不经肝脏代谢,体外肝微粒体蛋白的研究结果显示,培美曲塞未导致CYP3A酶、CYP2D6酶、CYP2C9酶和CYP1A2酶代谢的药物清除率降低。推测对于曾经出现过药物性肝损害的患者,培美曲塞、吉西他滨联合铂类的化疗方案可能更安全。由于经济原因,本病例选用了吉西他滨+顺铂方案化疗,治疗4个疗程,肝功能逐渐恢复正常,肿瘤控制良好。肺肿物射频消融后,患者按照埃克替尼的标准剂量口服5个月余,未见肝毒性,肿瘤疗效评价为稳定。2015年4月至2016年9月,治疗时间为17个月,患者的总体耐受性良好;按照ECOG评分标准,患者的体力状况保持在0~1分。这提示吉非替尼导致肝毒性后,可以根据损伤程度采用停药、减量和换用其他类型EGFR‐TKⅠ药物,如厄罗替尼和埃克替尼等,吉西他滨+顺铂方案化疗和局部消融治疗也可以作为替代方案以赢得肝功能的恢复时间。本病例患者无病毒性肝炎和其他肝病病史,由吉非替尼导致的肝损害均可以恢复,提示选用吉非替尼治疗时应该定期检测肝功能,尤其是有基础肝病的患者,应该及时发现,尽早预防,避免发展为重症肝衰竭。
[1]Sholl LM,Aisner DL,Varella‐Garcia M,et al.Multi‐institu‐tional oncogenic driver mutation analysis in lung adenocar‐cinoma:the lung cancer uutation consortium experience[J].J Thorac Oncol,2015,10(5):768‐777.
[2]Mitsudomi T,Morita S,Yatabe Y,et al.Gefitinib versus cis‐platin plus docetaxel in patients with non‐small‐cell lung cancer harbouring mutations of the epidermal growth factor receptor(WJTOG3405):an open label,randomised phase 3 trial[J].Lancet Oncol,2010,11(2):121‐128.
[3]Zhou C,Wu YL,Chen G,et al.Erlotinib versus chemother‐apy as first‐line treatment for patients with advanced EGFR mutation‐positive non‐small‐cell lung cancer(OPTⅠMAL,CTONG‐0802):a multicentre,open‐label,randomised,phase 3 study[J].Lancet Oncol,2011,12(8):735‐742.
[4]Rosell R,Carcereny E,Gervais R,et al.Erlotinib versus standard chemotherapy as first‐line treatment for European patients with advanced EGFR mutation‐positive non‐small‐cell lung cancer(EURTAC):a multicentre,open‐label,ran‐domised phase 3 trial[J].Lancet Oncol,2012,13(3):239‐246.
[5]Kim YH,Mio T,Mishima M.Gefitinib for non‐small cell lung cancer patients with liver cirrhosis[J].Ⅰntern Med,2009,48(18):1677‐1679.
[6]Ramanarayanan J,Scarpace SL.Acute drug induced hepati‐tis due to erlotinib[J].JOP,2007,8(1):39‐43.
[7]Schacher‐Kaufmann S,Pless M.Acute fatal liver toxicity under erlotinib[J].Case Rep Oncol,2010,3(2):182‐188.
[8]Urata Y,Katakami N,Morita S,et al.Randomized phaseⅢstudy comparing gefitinib with erlotinib in patients with previously treated advanced lung adenocarcinoma:WJOG 5108L[J].J Clin Oncol,2016,34(27):3248‐3257.
[9]刘俊,王韡旻,潘峰,等.埃克替尼治疗215例复治晚期非小细胞肺癌[J].肿瘤学杂志,2017,23(1):25‐29.
[10]Kitade H,Yamada T,Ⅰgarashi S,et al.Efficacy of low‐dose erlotinib against gefitinib‐induced hepatotoxicity in a patient with lung adenocarcinoma harboring EGFR muta‐tions[J].Gan To Kagaku Ryoho,2013,40(1):79‐81.
[11]周艳刚,刘朝敏,姜鹤群,等.多西紫杉醇致持续肝损害1例[J].四川医学,2013,34(5):786.
