硼替佐米对骨髓瘤细胞株RPMI8226增殖和凋亡影响的研究
2018-04-08李录克时艳荣赵文华
李录克,时艳荣,赵文华
平煤神马医疗集团总医院血液科,河南 平顶山4670000
多发性骨髓瘤,又称骨髓瘤、浆细胞骨髓瘤、Kaher病,是一种来源于浆细胞的恶性肿瘤[1],是因骨髓原始浆细胞过度增殖导致的疾病,具有较高的发病率和病死率[2‐4]。多发性骨髓瘤是最为常见的血液系统恶性肿瘤之一,也是目前仍不可治愈的一种疾病。硼替佐米(bortezomib)是一种新型抗肿瘤药物,获美国食品药品监督管理局(FDA)批准上市[5],用于难治性、复发性、多发性骨髓瘤的治疗[6‐7],目前仍是多发性骨髓瘤的首选治疗药物。但随着硼替佐米在临床中的长期使用,其治疗多发性骨髓瘤的效果越来越不理想,追其原因是由于多发性骨髓瘤细胞对硼替佐米产生了高度耐药性使其复发[8],其作用机制迄今仍不完全清楚。本实验通过对骨髓瘤细胞株RPMⅠ8226进行体外培养,并采用增殖和凋亡实验,观察细胞Wnt/β‐catenin 信号通路相关蛋白β‐catenin 和 c‐myc及PⅠ3K/AKT信号通路相关蛋白Bcl‐2和Bax的表达情况,进一步探讨硼替佐米对多发性骨髓瘤的调控机制,现报道如下。
1 材料与方法
1.1 试剂与仪器
多发性骨髓瘤细胞株RPMⅠ8226购自美国模式菌种收集中心(American Type Culture Collec‐tion,ATCC);硼替佐米购自西安杨森制药有限公司;10%胎牛血清购自浙江四季青公司;RPMⅠ1640培养基购自美国Hyclone公司;MTT和DMSO购自美国Sigma公司;磷酸盐缓冲液(PBS)购自上海艾睿生物Gibco公司;Trizol购自上海Ⅰnvitrogen公司。RNA PCR Kit Ver.3.0、SYBR Premix Ex TaqⅡ和 Annexin V‐FⅠTC/PⅠ试剂盒购自德国 Bender公司;Western Blot试剂盒购自美国KPL公司;酶标仪购自上海BⅠO‐TEK公司。流式细胞仪购自美国BD 公司;β‐actin、β‐catenin、c‐myc、Bcl‐2和 Bax 鼠抗人一抗多克隆抗体购自上海Santa Cruz公司;兔抗鼠二抗多克隆抗体购自中杉金桥生物技术有限公司。引物由上海生工生物工程技术服务有限公司合成。低温高速离心机和二氧化碳细胞培养箱(GBB‐16)均购自上海Heraeus公司。
1.2 细胞培养
在含10%胎牛血清、100 U/ml青霉素和100 μg/ml链霉素的RPMⅠ1640培养基中进行多发性骨髓瘤细胞株RPMⅠ8226的悬浮培养。在37℃、5%CO2的培养箱中培养2 d后换液进行传代培养,收集对数生长期的细胞进行实验。
1.3 细胞增殖实验
使用MTT法检测RPMⅠ8226细胞的增殖能力。将上述培养的对数期细胞浓度调至每孔5×103/ml后接种于96孔培养板上,每孔接种100 μl。设5个处理组,分别加入终浓度为20、40、60、80及100 nmol/L的硼替佐米,每组设置3个复孔,以不含硼替佐米的细胞作为对照组,以空白孔调零,培养 24 h,每 孔 加 入 MTT 100 μl作 用 4 h,加 入DMSO 100 μl孵育30 min。在酶标仪570 nm处测吸光度A值,根据公式计算细胞增殖抑制率:抑制率=([A对照组-A处理组)(/A对照组-A空白组)]×100%。
1.4 细胞凋亡实验
设硼替佐米浓度分别为20、40、60、80和100nmol/L的5个处理组和1个不含硼替佐米的对照组,取对数期生长的细胞,分别处理24 h采用后胰酶消化收集细胞,PBS洗涤,离心。取100 μl细胞悬浮液加入5 μl Annexin V‐FⅠTC和5 μl PⅠ,置于室内避光处理15 min。按照Annexin V FⅠTC/PⅠ试剂盒说明书对细胞进行染色,采用流式细胞仪检测细胞凋亡,计算细胞凋亡率。每组重复3次,计算平均值。
1.5 β-catenin、c-myc、Bcl- 2和Bax mRNA表达
处理24 h后,收集各组细胞于1.5 ml离心管中,加入1 ml Trizol,提取总RNA。逆转录过程按照RNA PCR Kit Ver.3.0试剂盒说明书进行。根据SYBR Premix Ex TaqⅡ试剂盒说明书配制PCR反应体系25 μl,在荧光定量PCR仪中进行扩增,于2%琼脂糖凝胶中对PCR产物进行电泳,凝胶成像观察、照相。使用Gel‐pro Analyzer软件进行灰度分析,以灰度反映mRNA的表达量,以β‐actin为内参,mRNA的相对含量=目的基因条带灰度值/内参基因条带灰度值,每组重复3次,计算平均值。各基因的引物序列,详见表1。

表1 各基因的引物序列
1.6 WesternBlot法检测蛋白表达
收集经0、20、40、60、80和100 nmol/L硼替佐米处理24 h后的RPMⅠ8226细胞,置于1.5 ml的离心管中,经PBS洗涤,充分裂解后,离心,提取总蛋白。其中以0 nmol/L的硼替佐米为对照组,其他为处理组。电泳结束后,转膜,封闭,特异性一抗(鼠抗人 c‐myc、β‐catenin、Bcl‐2、Bax 和β‐actin 抗体)4℃孵育过夜。然后室温二抗(兔抗鼠)反应1 h,ECL显色,显影,定影。以β‐actin为内参,计算各组蛋白的相对表达量。
1.7 统计学方法
采用SPSS 19.0软件对-数据进行统计分析,计量资料以均数±标准差(±s)表示,多组间比较采用单因素方差分析,两组间比较采用LSD‐t检验,以P<0.05为差异有统计学意义。
2 结果
2.1 硼替佐米对RPMI8226细胞的增殖抑制作用
与对照组(0 nmol/L硼替佐米)相比,不同浓度(20、40、60、80和100 nmol/L)硼替佐米处理组的RPMⅠ8226细胞增殖抑制率均升高,差异均有统计学意义(P<0.05);且细胞增殖抑制率随硼替佐米浓度的增加而增大,详见图1。经计算,硼替佐米的半抑制浓度(half maximal inhibitory concentra‐tion,ⅠC50)为31.95 nmol/L。
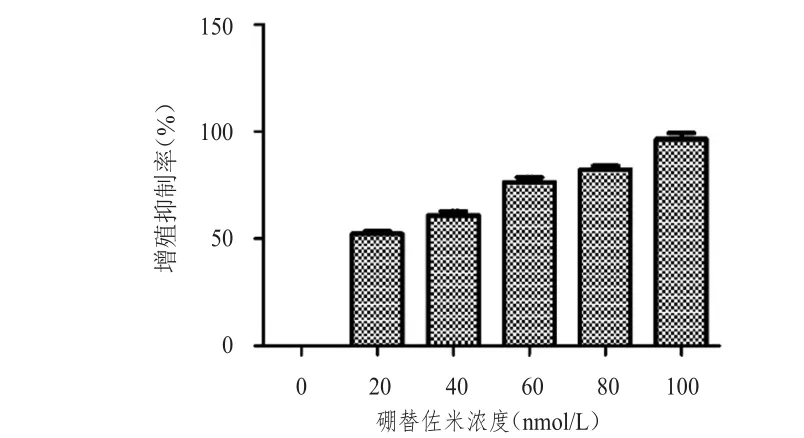
图1 不同浓度的硼替佐米对RPMⅠ8226细胞的增殖抑制作用
2.2 硼替佐米对RPMI8226细胞的凋亡促进作用
不同浓度(20、40、60、80和100 nmol/L)硼替佐米处理组的RPMⅠ8226细胞凋亡率分别为(11.80±0.56)%、(19.45±1.25)%、(36.82±2.26)%、(43.56±3.50)%和(56.62±5.02)%,均高于对照组的(8.02±0.45)%,差异均有统计学意义(P<0.05)。(图2)
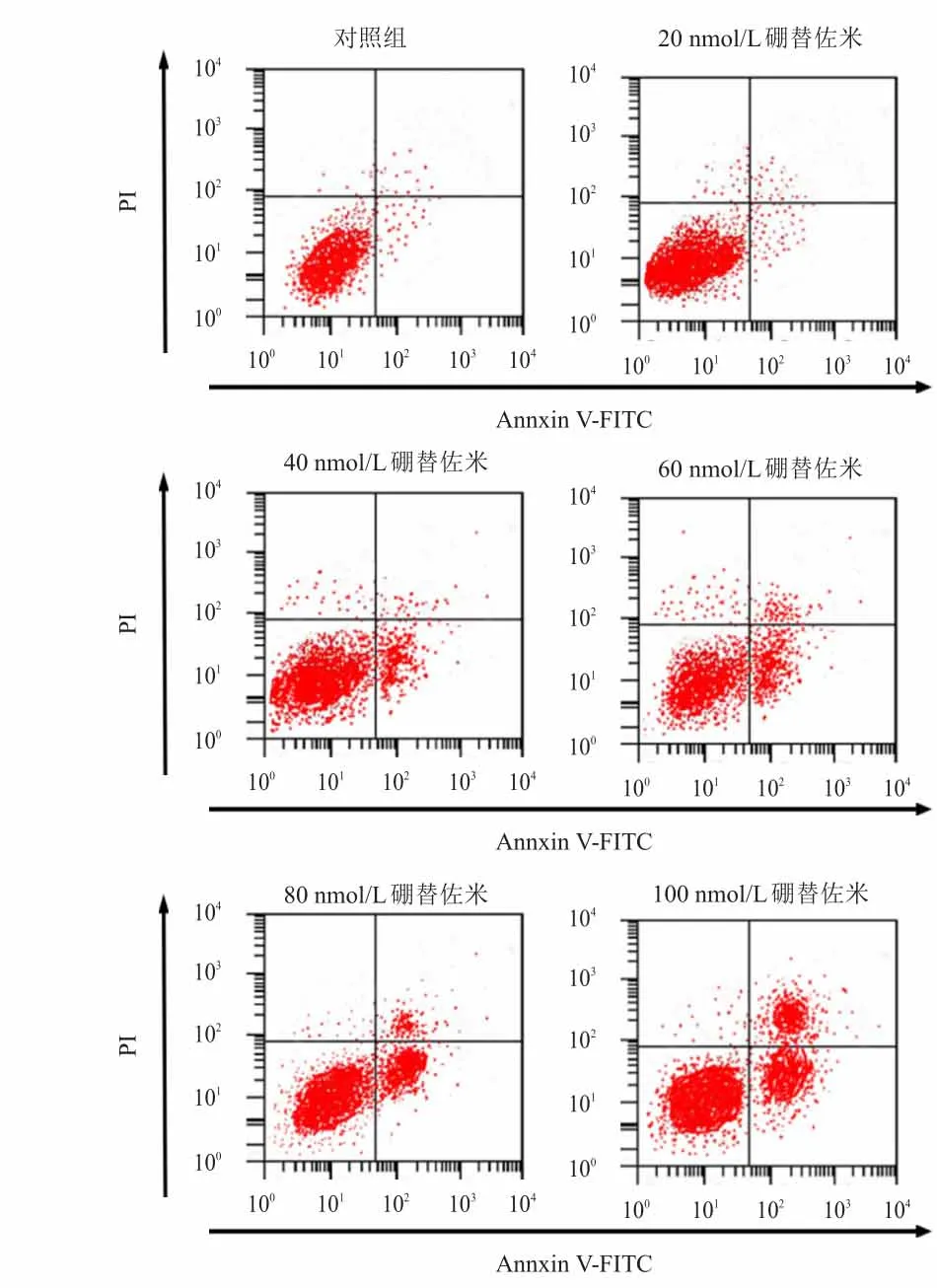
图2 硼替佐米对RPMⅠ8226细胞的凋亡促进作用
2.3 硼替佐米对 β-catenin、c-myc、Bcl- 2 和 Bax mRNA表达水平的影响
处理组c-myc、β-catenin和Bcl-2mRNA的表达水平低于对照组,且随硼替佐米浓度的增加而下降;而BaxmRNA的表达水平高于对照组,且随硼替佐米浓度的增加而升高。(表2)
2.4 硼替佐米对 β-catenin、c-myc、Bcl- 2和Bax蛋白表达水平的影响
处理组β‐catentin、c‐myc和Bcl‐2蛋白的表达水平低于对照组,且随硼替佐米浓度的增加而下降;而Bax蛋白的表达水平高于对照组,且随硼替佐米浓度的增加而升高。(图3、表3)
表2 不同浓度的硼替佐米处理后各基因的mRNA表达水平(± s)
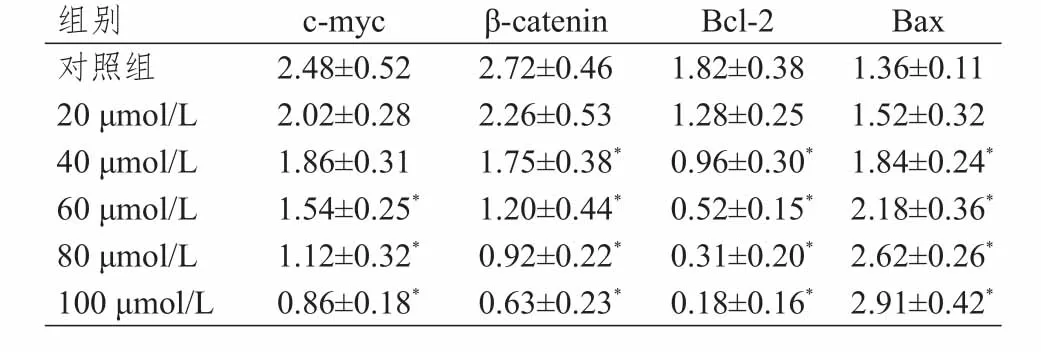
表2 不同浓度的硼替佐米处理后各基因的mRNA表达水平(± s)
注:与对照组比较,P<0.05
组别对照组20 μmol/L 40 μmol/L 60 μl/L 80 μmol/L 100 μmol/L 2.48±0.52 2.02±0.28 1.86±0.31 1.54±0.25*1.12±0.32*0.86±0.18*2.72±0.46 2.26±0.53 1.75±0.38*1.20±0.44*0.92±0.22*0.63±0.23*1.82±0.38 1.28±0.25 0.96±0.30*0.52±0.15*0.31±0.20*0.18±0.16*1.36±0.11 1.52±0.32 1.84±0.24*2.18±0.36*2.62±0.26*2.91±0.42**c‐mycβ‐cateninBcl‐2Bax

图3 硼替佐米对 β‐catenin、c‐myc、Bcl‐ 2和Bax蛋白表达水平的影响
表3 不同浓度的硼替佐米处理后各蛋白的表达水平(± s)
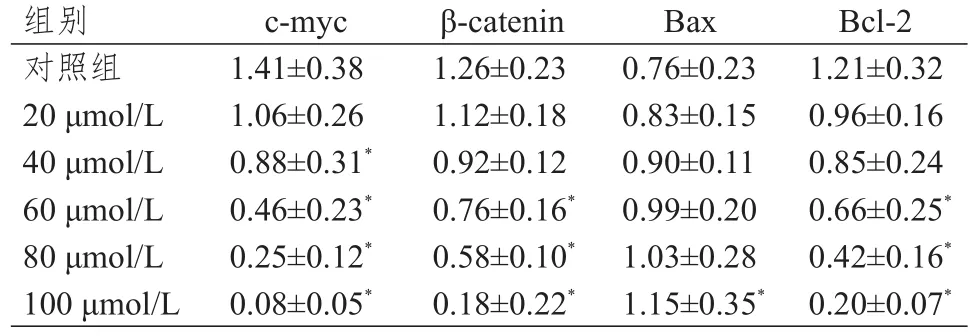
表3 不同浓度的硼替佐米处理后各蛋白的表达水平(± s)
注:*与对照组比较,P<0.05
组别对照组20 μmol/L 40 μmol/L 60 μmol/L 80 μmol/L 100 μmol/L c‐myc 1.41±0.38 1.06±0.26 0.88±0.31*0.46±0.23*0.25±0.12*0.08±0.05*β‐catenin 1.26±0.23 1.12±0.18 0.92±0.12 0.76±0.16*0.58±0.10*0.18±0.22*Bax 0.76±0.23 0.83±0.15 0.90±0.11 0.99±0.20 1.03±0.28 1.15±0.35*Bcl‐2 1.21±0.32 0.96±0.16 0.85±0.24 0.66±0.25*0.42±0.16*0.20±0.07*
3 讨论
多发性骨髓瘤多发于65岁左右的老年人,发病率与性别无关,随着社会老龄化的进展,多发性骨髓瘤的发病率呈逐年增加趋势[4,9]。多发性骨髓瘤的主要特征是骨髓中浆细胞克隆性增殖,分泌片段或单克隆免疫球蛋白,伴有广泛的感染、贫血、肾功能损害及溶骨病变等临床表现[10]。多发性骨髓瘤的治疗包括初始治疗、干细胞移植(stem cell transplantation,SCT)、维持治疗和复发的治疗。目前,多发性骨髓瘤的病因和发病机制尚未研究清楚。针对多发性骨髓瘤的难治、复发等情况,大多采用联合用药方案[11‐14],但均以硼替佐米为主,硼替佐米是26S蛋白酶体抑制剂,通过阻断细胞内多种调控细胞凋亡及信号传导的蛋白质的降解,以及多个通路发挥着抗肿瘤作用。
本实验采用MTT法检测硼替佐米对骨髓瘤细胞株RPMⅠ8226的增殖抑制作用,与对照组相比,不同浓度(20、40、60、80和100 nmol/L)硼替佐米处理组的RPMⅠ8226细胞增殖抑制率均升高,差异有统计学意义(P<0.05);且细胞增殖抑制率随硼替佐米浓度的增加而增大,呈剂量效应。不同浓度(20、40、60、80和100 nmol/L)硼替佐米处理组的RPMⅠ8226细胞凋亡率均高于对照组,差异均有统计学意义(P<0.05)。处理组 c‐myc、β‐catenin 及Bcl‐2的mRNA和蛋白表达水平均低于对照组,且随硼替佐米浓度的增加而下降;而Bax的mRNA和蛋白表达水平均高于对照组,且随硼替佐米浓度的增加而升高。
研究表明,Wnt/β‐catenin信号通路中c-myc和β-catenin基因的异常变化与多发性骨髓瘤的发生和发展密切相关[15]。硼替佐米通过抑制NF‐ƘB信号通路中Bax和Bcl‐2的活性阻止多发性骨髓瘤的发展[8]。这说明,在多发性骨髓瘤发生和发展的过程中,Wnt/β‐catenin和NF‐κB信号通路发挥重要作用。孙红生[16]在研究硼替佐米对多发性骨髓瘤细胞凋亡的影响及机制中也得出,硼替佐米可诱导多发性骨髓瘤细胞凋亡,抑制Wnt/β‐catenin信号通路可能是其作用机制之一。研究已证实联合用药可提高多发性骨髓瘤的疗效[17],联合用药的作用机制不尽相同,了解硼替佐米对骨髓瘤的作用机制是寻找最好、最有效的治疗方案的前提,而其对骨髓瘤细胞的作用机制还需要进一步更深入的研究。
综上所述,硼替佐米可抑制多发性骨髓瘤细胞的增殖,促进其凋亡,作用机制可能与调控Wnt/β‐catenin和PⅠ3K/AKT信号通路有关。
[1]Wang L,Zhang YZ.Research progress on multiple myelo‐ma with extramedullary disease[J].Zhongguo Shi Yan Xue Ye Xue Za Zhi,2016,24(3):945‐948.
[2]刘斯佳,杜新,蔡云,等.硼替佐米为主治疗多发性骨髓瘤的疗效与安全性临床观察[J].临床血液学杂志,2016,29(4):563‐566.
[3]李颖,肖海军,薛锋.唑来膦酸注射液治疗脊柱多发性骨髓瘤的疗效[J].中国老年学杂志,2014,34(15):4375‐4376.
[4]王欢,赵真,张滔,等.硼替佐米联合地塞米松治疗老年多发性骨髓瘤的疗效及对免疫抑制因子、免疫细胞水平的影响[J].海南医学院学报,2017,23(2):232‐235.
[5]楚松林,张连生.泊马度胺治疗难治复发性多发性骨髓瘤的研究进展[J].白血病·淋巴瘤,2014,23(3):179‐181.
[6]Bao T,Goloubeva O,Pelser C,et al.A pilot study of acu‐puncture in treating bortezomib‐induced peripheral neuropa‐thy in patients with multiple myeloma[J].Ⅰntegr Cancer Ther,2014,13(5):396‐404.
[7]冯小虎,于水涛,夏正君,等.硼替佐米的波谱学数据解析[J].波谱学杂志,2017,34(1):43‐51.
[8]刘琼,蒲业迪,代广霞,等.硼替佐米耐药多发性骨髓瘤细胞基因表达谱分析[J].山东大学学报(医学版),2015,53(6):33‐38..
[9]孙春艳,胡豫.初治多发性骨髓瘤治疗进展[J].中国实用内科杂志,2016,36(2):121‐125.
[10]翁翔,顾超,翟丽娜,等.硼替佐米在多发性骨髓瘤治疗中的应用[J].中国肿瘤,2014,23(8):674‐679.
[11]张丽,罗文达,沈健,等.含硼替佐米的联合化疗对多发性骨髓瘤的治疗效果及不良反应[J].中华全科医学,2016,14(11):1826‐1828.
[12]Dimopoulos M,Siegel DS,Lonial S,et al.Vorinostat or placebo in combination with bortezomib in patients with multiple myeloma(VANTAGE 088):a multicentre,ran‐domised,double‐blind study[J].Lancet Oncol,2013,14(11):1129‐1140.
[13]Mateos MV,Oriol A,Martínez‐López J,et al.Outcomes with two different schedules of bortezomib,melphalan,and prednisone(VMP)for previously untreated multiple myeloma:matched pair analysis using long‐term follow‐up data from the phase 3 VⅠSTA and PETHEMA/GEM05 trials[J].Ann Hematol,2016,95(12):2033‐2041.
[14]Turner JG,Kashyap T,Dawson JL,et al.XPO1 inhibitor combination therapy with bortezomib or carfilzomib in‐duces nuclear localization ofⅠκBα and overcomes ac‐quired proteasome inhibitor resistance in human multiple myeloma[J].Oncotarget,2016,7(48):78896‐78909.
[15]张嘉美,赵宁,吴晓玲,等.Wnt/β‐catenin信号通路对细胞凋亡和坏死的调控研究进展[J].中国细胞生物学学报,2015,37(9):1309‐1316.
[16]孙红生.硼替佐米对多发性骨髓瘤细胞凋亡的影响及机制[J].山东医学,2016,56(12):33‐35.
[17]任金海,郭晓楠.多发性骨髓瘤诊断与治疗的研究进展[J].临床荟萃,2017,32(2):177‐180.
