工程化学电化学教学的思考
2018-04-04赵桂花
赵桂花
(南通理工学院,江苏 南通 226002)
《工程化学》是高等院校非化学专业学习的一门公共基础必修课,教学目的主要旨在培养工程类学生具备必要的化学基本理论,基本知识和基本技能,从而更好地学习其专业课程;其次是扩充学生的知识面。
本校使用的是周祖新主编的《工程化学》。该教材内容比较宽泛,涉及到了化学热力学、水溶液中的化学、电化学基础、物质结构基础、化学与材料科学。其中电化学基础是较重要的章节。在此章节中有个重要的关系式是能斯特方程,这也是学生的薄弱环节,在书写时会出现各种各样的问题,本人对这些问题进行总结并提出了解决措施。
1 能斯特方程
1.1 能斯特方程的意义
标准电极电势[1]是在标准状态下测定的,所谓的标准状态指的是温度为298.15 K,溶液中离子浓度为1.0 mol·L-1,若为气体,气体压力为100kPa。而氧化还原反应不一定都是在标准状态下进行的。对于任意状态下,原电池中电极电势的大小除了与电极材料本身的性质(体现为标准电极电势)有关外,还与系统的温度、参加电极反应的各物种的浓度(严格地说应为活度)密切相关[2]。德国化学家能斯特(Nernst)从理论上推导出了电极电势与溶液中离子浓度、温度、标准电极电势的关系。
1.2 能斯特方程的型式
本教材[1]中对能斯特方程进行如下表述。
对于一般的化学反应:

其电极电势E与标准电极电势E⊖间的关系可用Nernst方程表示为:
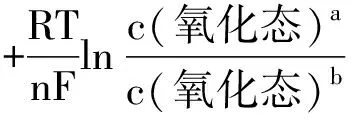
(1)
式中,E为电对中离子在某一浓度(气体为某一分压)时的电极电势;E⊖为该电极的标准电极电势;n为电极反应的得失电子数;F称为法拉第常数,其值为96500C·mol-1;R为通用气体常数,其值为8.31 Pa·m3·mol-1·K-1;T为开尔文温度;c(氧化态)、c(还原态)分别为电对中氧化态物质和还原态物质的相对浓度c/c (或相对分压p/p );a、b分别为电极反应中氧化态物质和还原态物质的计量系数。
在298.15K时,将上述三个常数F、R、T的值代入式(1)中,并进行对数换底计算,则式(1)可简化为:
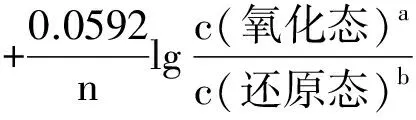
(2)
在应用Nernst方程式时,应注意以下几点:
①电极反应中各物质的计量系数为其相对浓度或相对分压的指数。
②电极反应中的纯固体或纯液体,不列入Nernst方程式中。由于反应常在稀的水溶液中进行,H2O也可作为纯物质看待而不列入式中。
③若在电极反应中有H+或OH-参加反应,则这些离子的相对浓度应根据反应式计入Nernst方程式中。
2 学生理解误区及示例
实际计算中,大多是用公式(2)来计算在298.15K下的电极电势。在该公式的应用中,初学者往往受到公式表面形式的影响,形成思维定势,甚至照葫芦画瓢也会出现错误。主要体现在以下几个方面。
2.1 有H+或OH-参与电极反应的情况

由于c⊖数值上等于1,所以在Nernst方程中常可省略[3]。因此正确的Nernst方程表达式应该是:
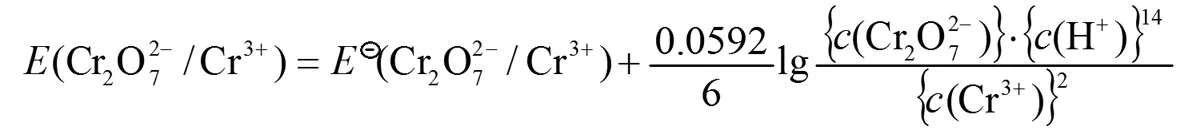
在课堂上会要求学生练习写出298.15K上述电极反应式中电对的Nernst方程表达式,根据学生容易出现的错误总结如下:
(1)c(氧化态)、c(还原态)不能正确的理解。虽然教材公式(2)下面的注意事项中强调“若在电极反应中有H+或OH-参加反应,则这些离子的相对浓度应根据反应式计入Nernst方程式中”,但学生还会仅从字面上来理解,认为对数相中的“氧化态”、“ 还原态”只是与氧化数发生变化的物质有关,因此参与反应的其它物质,例如H+或OH-等常常被忽略。表现为:
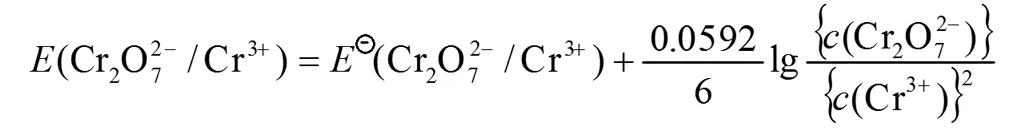
(2)浓度的指数常忘记(浓度项的指数是相应的电极反应式中的计量系数)。还有一种情况是c(氧化态)、c(还原态)的指数正确的书写了,但是参与反应的其它物质浓度的指数却又忘记。如:

2.2 有气体参与或固体存在的电极反应
对于此类型的反应,学生在书写时常常会出现如下问题:
(1)对于气体不清楚如何列入方程式中。有的同学还会使用浓度来表示,或者写成了实际压力而不是相对压力p/p⊖。

本教材在讲述时说明“c(氧化态)、c(还原态)分别为电对中氧化态物质和还原态物质的相对浓度c/c⊖(或相对分压p/p⊖)”;其中相对分压p/p⊖就是针对气体来说的。上述电极反应式中电对的Nernst方程表达式应该是:
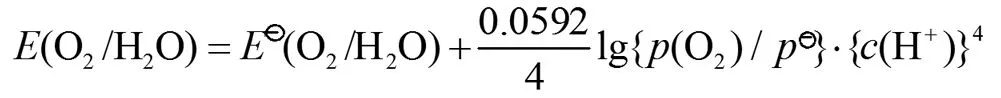
而学生经常会写成下列形式:
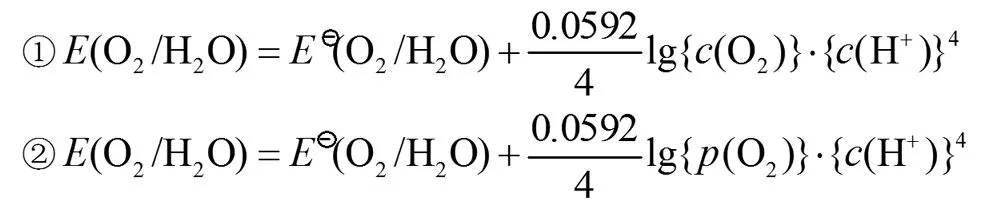
由于c⊖数值上等于1,所以在Nernst方程中常可省略。但是由于p⊖数值上等于100kPa,是不可以省略的。
(2)对“电极反应中的纯固体或纯液体,不列入Nernst方程式中”这句话的理解有误。


正确的Nernst方程表达式应该是:
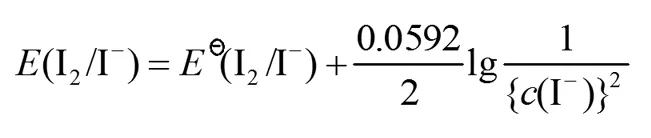
而学生经常会写出下列形式:
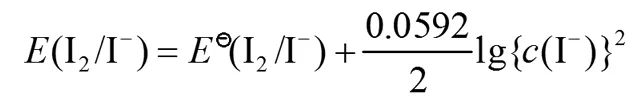
这就是因为误解了“电极反应中的纯固体或纯液体[4],不列入Nernst方程式中”这句话,实际上并非不列入,而是看成“1”,需要根据分子、分母的实际情况掌握“1”是否需要写,像上述例题,分子上只有“1”,如果不写的话结果就是错的。
2.3 电极反应方程式形式改变

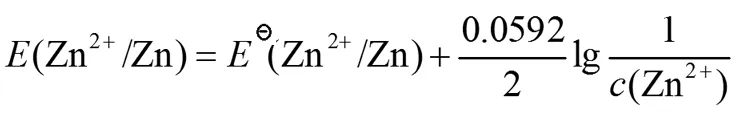
3 教学中的改进
3.1 电极电势的符号问题
我们使用的教材[1]中电极电势和电动势都是用“E”来表示的。对于初学者而言,很容易混淆。虽然文中有相应的解说,也采用增加电对的型式加以区分,比如E(Zn2+/Zn)表示电对Zn2+/Zn的电极电势。但是有些学生在书写时往往忽略书写电对,所以造成教师批改时难以理解其真正要表达的意思。
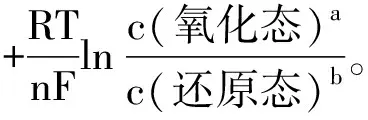
为了加以区分,在教学过程中可以参考教材《无机化学》的表示方法[5],用“φ”来表示电极电势,用“E”来表示电动势。本文以下内容用“φ”来表示电极电势,用“E”来表示电动势。
3.2 统一书写电极反应式


3.3 正确理解“氧化态”和“还原态”
在写Nernst方程时常常出现参与反应的其它物质,例如H+或OH-等被忽略的主要原因是没有正确的理解“氧化态”和“还原态”这几个汉字的意义。教材中解释“c(氧化态)、c(还原态)分别为电对中氧化态物质和还原态物质的相对浓度c/c⊖(或相对分压p/p⊖)”,让学生会误解为仅是指氧化数发生改变的物质。虽然在注意事项说明“若在电极反应中有H+或OH-参加反应,则这些离子的相对浓度应根据反应式计入Nernst方程式中”,然而很多学生并不去理解说明的文字,仅从公式表面去理解。再加上此句解释并没有提及浓度指数,所以在写Nernst方程时容易出现2.1节所说的错误。
在讲解时可以参考教材[5]引入Nernst方程的另一种表达方式来解释。
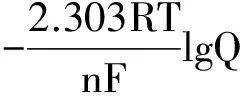
(3)
式中Q为电池反应的反应商(各生成物相对浓度c/cӨ的乘积与各反应物相对浓度的乘积之比,若是气体就用相对压力p/pӨ,各物种浓度的指数应等于反应式中相应各物种的计量数);E为电池反应在任意浓度时的电动势;EӨ为电池反应在标准态时的电动势;n为电池反应中得失电子的计量数,其它字母的意义同1.2节所述。
在298.15K时,将上述三个常数F、R、T的值代入式(3)中,并进行对数换底计算,则式(3)可简化为:
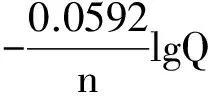
(4)
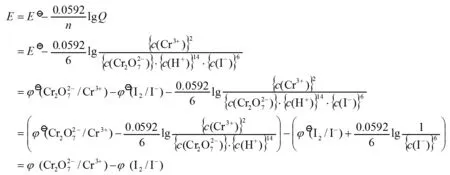
从上式可以看出,对于电极反应来说,298.15K时电极电势的Nernst方程也可以写成:
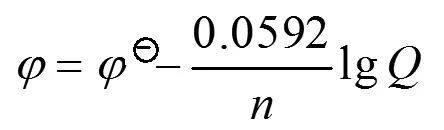
(5)
式中φ为电极在任意浓度(气体为某一分压)时的电极电势;φӨ为电极在标准状态时的电极电势,Q为电极反应的反应商[5](不计入电子)。
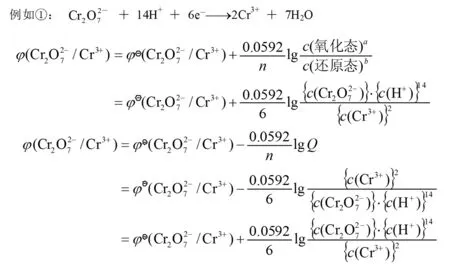

用公式(5)引入Q而不用c(氧化态)、c(还原态)来表达Nernst方程中的对数相,就简捷、准确地包括了所有参与电极反应的物质,如H+或OH-等,这就有助于从本质上理解电极电势的能斯特方程,而不仅仅局限于氧化数发生改变的物质。
在此基础上,如果是纯固体、纯液体,这些物质的浓度视为“1”即可,在稀的水溶液中,H2O也可作为纯物质看待。
4 结论
采用反应商的Nernst表达式,能从根本上解决学生对“氧化态”和“还原态”难以理解的现象,能帮助学生正确书写出电极反应的Nernst方程式,为学好本教材后续章节,如“电极电势的应用”等打下了基础。
[1] 周祖新.工程化学[M].北京:化学工业出版社,2013:57-59.
[2] 王淑涛,刘春英.能斯特方程式教学中一个重要关系的理解--电极电势与反应商[J].高等函授学报(自然科学版),2012,25(2):45-47.
[3] 上海大学《工程化学》教材编写组.工程化学[M].上海:上海大学出版社,1999:160-161.
[4] 天津大学物理化学教研室.物理化学(下册)[M].北京:高等教育出版社,1993:44-47.
[5] 大连理工大学无机化学教研室.无机化学(上册)[M].北京:高等教育出版社,1990:222-223.
