谷氨酰转肽酶基因工程菌发酵条件优化的研究
2018-04-04王梦婷徐礼生柴存宝
王梦婷,徐礼生,柴存宝,彭 静,孙 玥,王 昕
(宿州学院 生物与食品工程学院,安徽 宿州 234000)
谷氨酰胺转肽酶,简称GGT,GGT是生物体内谷胱甘肽代谢途径的关键酶之一,大部分主要存在于肾、肝和脾等组织中[1-2]。正常人的血清中的谷氨酰胺转肽酶来自于肝脏,用谷氨酰对硝基苯胺法测得正常的含量为3到50 U/L。谷氨酰胺转肽酶是食管癌病变的标记酶[3-5]。谷氨酰胺转肽酶对生物体内氨基酸转运过程起着重要的作用,因此可以作为生物体代谢情况的指标[6]。本实验利用前期筛选出性能较稳定的谷氨酰胺转肽酶基因工程菌,通过建立一系列单因素实验优化发酵培养基组成成分,以提高培养基发酵菌种的能力,通过提高大肠杆菌谷氨酰胺转肽酶基因工程菌的产量进而来提高谷氨酰胺转肽酶的产量,为谷氨酰胺转肽酶的生产提供参考。
1 材料与方法
1.1 主要试剂和仪器设备
主要试剂: 鱼粉蛋白胨、酵母浸粉均为生化试剂;乳糖、氯化钠、氢氧化钠;抗生素氨苄(AMP)。主要仪器: 电子天平,上海雷韵试验仪器制造有限公司;PHS-3C Ph计,上海仪电科学仪器股份有限公司;立式自动压力蒸汽灭菌锅,上海博讯实业有限公司;恒温振荡培养箱,上海智城分析仪器制造有限公司;WT-ZNO无菌操作台,郑州中旺实验室设备有限公司;可见分光光度计721型,上海仪电科学仪器股份有限公司。
1.2 方法
1.2.1菌种的活化
菌种活化是将上述冻藏的原始菌种按照3%的接种量接种于LB液体培养基中,经计算本实验需要用微量进样器吸取100微升原始菌种于每支装有3 mL LB液体培养基的试管中,之后还要加入7μL 的抗生素氨苄,以上操作在无菌操作台进行,然后在37℃、170 r/min下于振荡培养箱中培养10 h。重复上述操作活化两代,即共活化三代即可。
1.2.2菌种的发酵
菌种的振荡摇瓶培养是将活化后的菌种按照20%的接种量接入乳糖发酵培养基中,经计算本实验将2 mL活化后的菌种接入100 mL的乳糖发酵培养基中。在37℃、170 r/min下于振荡培养箱中培养发酵4 h后再调节温度使其降至30℃继续于振荡培养箱中培养发酵8 h。
1.2.3菌量的测定
菌量的测定是将经摇床培养完成后的所得菌液20倍稀释,用721型可见分光光度计在660 nm处,测定发酵培养所得菌液的光密度值OD660,上清液做等量稀释作为空白对照。
1.2.4上清液的制备
上清液的制备是将上述发酵后所得菌液在5000 r/min下于4℃离心机中离心10min得到的上清液。
1.2.5发酵培养基的优化
1.2.5.1乳糖
本实验用乳糖作为碳源,在保持原发酵培养基成分比例的基础上,改变乳糖的含量,设置8个培养基,乳糖含量分别替换为0.35%(w/v),0.4%(w/v),0.45%(w/v), 0.5%(w/v),0.55%(w/v),0.6%(w/v),0.65%(w/v), 0.7%(w/v)。
1.2.5.2酵母浸粉
本菌最佳发酵培养基氮源为酵母浸粉和鱼粉蛋白胨,所以要分别对其进行优化建立。酵母浸粉的优化是设置8个酵母浸粉含量不同的培养基,分别把基础发酵培养基的酵母浸粉替换为0.35%(w/v),0.4%(w/v),0.45%(w/v), 0.5%(w/v),0.55%(w/v),0.6%(w/v),0.65%(w/v), 0.7%(w/v)。
1.2.5.3鱼粉蛋白胨
鱼粉蛋白胨的优化是在初始培养基的基础上设置8个培养基,鱼粉蛋白胨含量分别为分别换成0.7%(w/v), 0.8%(w/v), 0.9%(w/v), 1.0%(w/v), 1.1%(w/v), 1.2%(w/v),1.3%(w/v), 1.4%(w/v)。
1.2.5.4无机盐氯化钠
无机盐对微生物的生长很有意义,本实验以氯化钠做为无机盐,在初始发酵培养基的基础上,把其中的氯化钠成分含量替换成0.35%(w/v),0.4%(w/v),0.45%(w/v), 0.5%(w/v),0.55%(w/v),0.6%(w/v),0.65%(w/v), 0.7%(w/v)。
1.2.6显微镜观察
将没有优化发酵培养基发酵得到的菌液与优化发酵培养基后发酵得到的菌体经20倍稀释后放在倒置显微镜下观察。
1.2.7统计学分析
采用SPSS11.5软件对数据进行统计分析,以均数±标准差来表示数据,组间采用t检验比较[7]。
2 实验结果与分析
2.1 单一碳源乳糖不同含量对发酵培养基产菌量的影响
乳糖为菌株发酵生长的良好碳源,本实验设置8个培养基,乳糖含量分别为0.35%(w/v),0.4%(w/v),0.45%(w/v), 0.5%(w/v),0.55%(w/v),0.6%(w/v),0.65%(w/v), 0.7%(w/v)。。发酵后于721型分光光度计下660nm处测得不同乳糖含量下发酵所得菌液光密度OD660值如图1所示(*表示差异显著)。
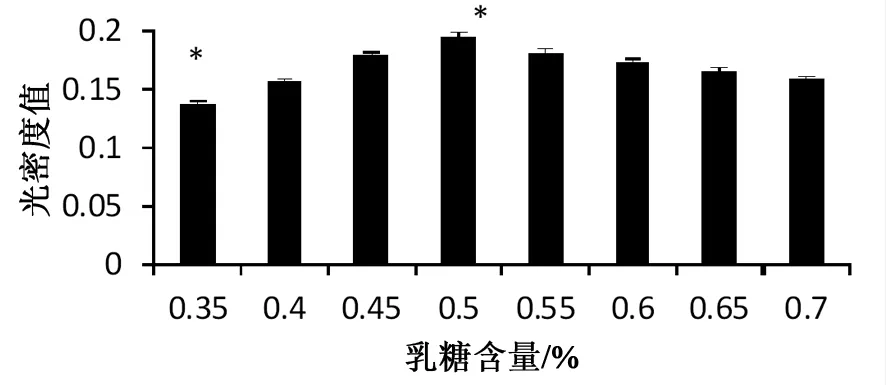
图1 发酵培养基乳糖对菌液光密度的影响
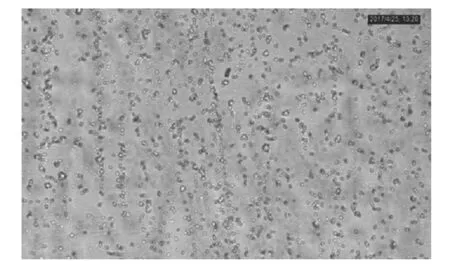
图2 乳糖含量为0.5%时(OD660=0.195)的菌液图
根据上图1分析可知,发酵培养基乳糖含量在0.35%(w/v)处菌液光密度值较低,随着乳糖含量的增大光密度值也随之逐渐增大,但是乳糖含量到达0.5%(w/v)时达到最大值0.195,之后再增大含量菌液光密度值不会增大反而随之逐渐减小。而菌液光密度值越大代表着菌液量越多,所以发酵培养基乳糖含量为0.5%(w/v)处发酵所得菌最多,由图2可以看出OD值大时显微镜图大肠杆菌微生物要多于OD值小的,说明培养基的最佳乳糖含量为0.5%(w/v)。
2.2 单一氮源酵母浸粉含量的不同对发酵培养基产菌量的影响结果
酵母浸粉含量对培养基产菌量的影响是设置8个100 mL的培养基,酵母浸粉含量在原始培养基基础上改为0.35%(w/v),0.4%(w/v),0.45%(w/v), 0.5%(w/v),0.55%(w/v),0.6%(w/v),0.65%(w/v), 0.7%(w/v)。发酵完成后于721型分光光度计下660nm处测得不同酵母浸粉含量下发酵所得菌液光密度OD660值如图3所示(*表示差异显著)。
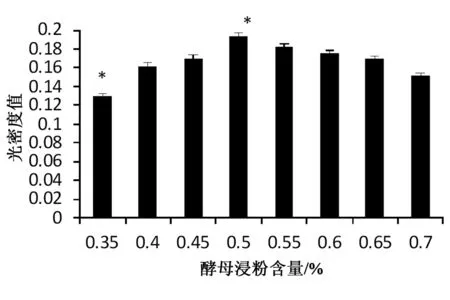
图3 酵母浸粉对菌液光密度的影响
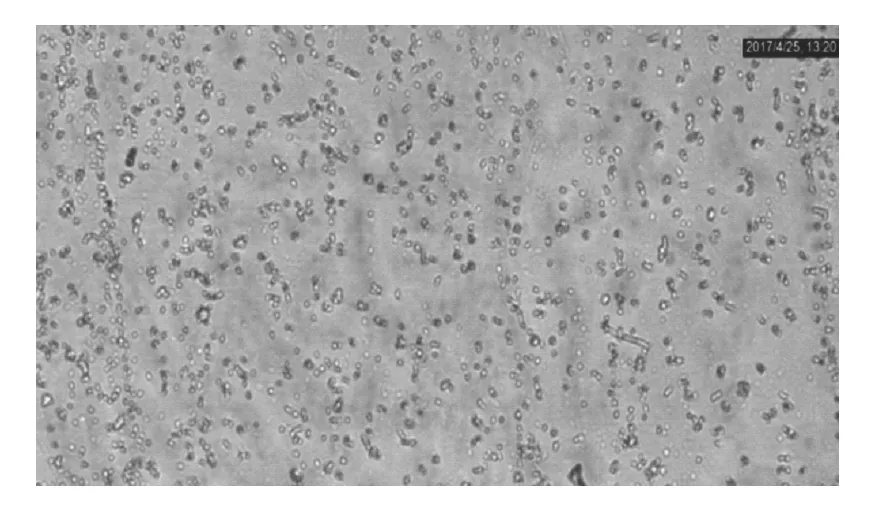
图4 酵母浸粉含量为0.5%时(OD660=0.193)的菌液图
根据图3分析可知,发酵培养基酵母浸粉含量在0.35%(w/v)处菌液光密度值较低,随着酵母浸粉含量的增大光密度值也随之逐渐增大,但是酵母浸粉含量到达0.5%(w/v)时达到最大值0.193,之后再增大含量菌液光密度值不会增大反而随之逐渐减小。而菌液光密度值越大代表着菌液量越多,由图4可以看出OD值大时显微镜图大肠杆菌微生物要多于OD值小的,说明培养基的最佳酵母浸粉含量为0.5%(w/v)。
2.3 单一氮源鱼粉蛋白胨含量差异对发酵培养基产菌量的影响结果
鱼粉蛋白含量对乳糖发酵培养基产菌量的影响实验是设置8个发酵培养基,其含量在基础培养基上改为0.7%(w/v),0.8%(w/v),0.9%(w/v), 1.0%(w/v),1.1%(w/v),1.2%(w/v),1.3%(w/v), 1.4%(w/v)。于721型分光光度计下660 nm处测得不同鱼粉蛋白胨含量下发酵所得菌液光密度OD660值如图5所示(*表示差异显著)。
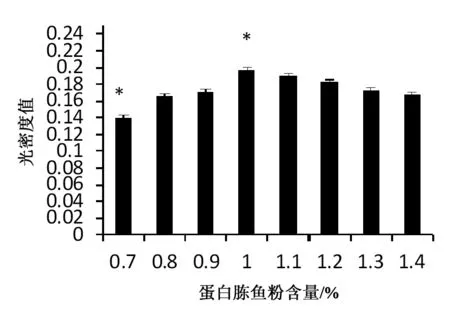
图5 发酵培养基鱼粉蛋白胨对菌液光密度的影响
图6 鱼粉蛋白胨含量为1.0%时(OD660=0.196)的菌液图
根据图5分析可知,发酵培养基鱼粉蛋白胨含量在0.7%(w/v)处菌液光密度值较低,随着鱼粉蛋白胨含量的增大光密度值也随之逐渐增大,但是鱼粉蛋白胨含量到达1.0%(w/v)时达到最大值0.196,之后再增大含量菌液光密度值不会增大反而随之逐渐减小。而菌液光密度值越大代表着菌液量越多,由图6可以看出光密度值大的菌液观察到的大肠杆菌微生物量多于光密度值小的,说明培养基的最佳鱼粉蛋白胨含量为1.0%(w/v)。
2.4 无机盐氯化钠含量差异对发酵培养基产菌量的影响
氯化钠为菌株发酵生长的良好无机盐,本实验设置8个培养基,氯化钠含量分别为0.35%(w/v),0.4%(w/v),0.45%(w/v), 0.5%(w/v),0.55%(w/v),0.6%(w/v),0.65%(w/v), 0.7%(w/v)。发酵后菌液于721型分光光度计下660nm处测得不同含量下发酵所测得菌液光密度OD660值如图7所示(*表示差异显著)。
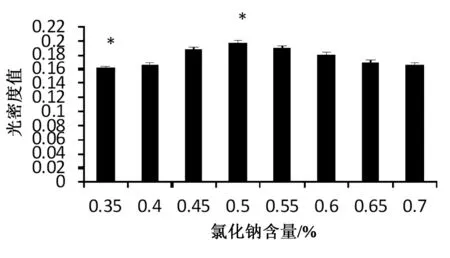
图7 发酵培养基NaCl对菌液光密度的影响

图8 氯化钠含量为0.5%时(OD660=0.197)的菌液图
根据图7分析可知,发酵培养基NaCl含量在0.35%(w/v)处菌液光密度值较低,伴随氯化钠的量的变大光密度值OD660也会随之慢慢变大,但是NaCl的量到达0.5%(w/v)处OD660到达最大值,之后再增大含量菌液光密度值不会增大反而随之逐渐减小。而菌液光密度值越大代表着菌液量越多,所以乳糖发酵培养基NaCl含量为0.5%(w/v)处菌液产量最多,说明培养基的最佳NaCl含量为0.5%(w/v)。从图8中也看得出0.5%氯化钠含量对乳糖发酵培养基菌体菌较多。
3 结论
在酵母浸粉的发酵培养基优化实验中测得菌体光密度值OD660在酵母浸粉含量为0.5%时最大;在鱼粉蛋白胨的发酵培养基优化实验中测得菌体光密度值OD660在鱼粉蛋白胨含量为1.0%时最大;在乳糖的发酵培养基优化实验中测得菌体光密度值OD660在乳糖含量为0.5%时最大;在氯化钠的发酵培养基优化实验中测得菌体光密度值OD660在氯化钠含量为0.5%时最大。综合分析得结论:0.5%(w/v)的酵母浸粉,1.0%(w/v)的鱼粉蛋白胨,0.5%(w/v)的乳糖,0.5%(w/v)的氯化钠,是为最佳的乳糖发酵培养基组分组成。
[1]王小力,张亚丽.γ-谷氨酰基转肽酶产生菌发酵培养基的优化及酶促反应研究[J].农产品加工,2010,210(6):77-80.
[2]姜新苓.血清中GGT水平与肾功能异常的相关性[J].世界最新医学信息文摘,2015,15(73):144-145.
[3]易庚华,陈荫椿,石仲歧,等.食管癌谷氨酰胺转肽酶生物化学研究[J].南通医学院学报,1992,12(1):32-34.
[4]李健,赵治国,白经修,等.食管癌高发区重度不典型增生人群谷氨酰胺转肽酶的随访观察[J].中国肿瘤临床,2004,31(16):905-907.
[5]徐国明,孔 磊,董秀琴,等.血清Y谷氨酰胺转肽酶对食管鳞癌患者预后价值分析[J].癌症进展,2015,13(6):642-645.
[6]姚崇华,胡以松,翟凤英,等.我国2002年代谢综合征的流行情况[J].中国糖尿病杂志,2007,15(6):332-335.
[7]周璟明,陈 宏,张祝兰,等.费氏链霉(Streptomyces fradiae)FIM-S38胞外产新霉素的发酵条件优化[J].生物技术通报,2014(12):92-96.
