穿心莲内酯影响猪链球菌生物被膜形成
2018-04-04王金玉姜晓文王婕然于苗苗于文会
王金玉,姜晓文,王 娜,王婕然,于苗苗,钟 秋,于文会,2*
(1. 东北农业大学动物医学院,哈尔滨 150030;2. 黑龙江省教育厅动物普通疾病防治重点实验室,哈尔滨 150000)
猪链球菌是一种人畜共患菌,猪链球菌按荚膜抗原被分为33种血清型,其中猪链球菌2型是最常见、危害最大的,可以通过接触直接传染给人[1]。猪链球菌很容易在自然环境或动物体内形成生物膜,使猪链球菌难以去除,增加了感染的危险性[2]。细菌生物被膜(bacterial biofilm,BF),是细菌或真菌特有的生命现象,主要是为了适应自然环境,有利于生存。当细菌在活组织或非活性组织表面吸附时,它们能够分泌多种多糖复合物,如脂蛋白、纤维蛋白和多糖基质,它们通过黏性物质将细菌结合在一起,互相包裹缠绕形成的一种膜样物质[3-7]。已经形成生物被膜的细菌比游离的细菌对抗生素的耐受力会增加到近1 000倍[8]。治疗猪链球菌病的一个重要手段就是干预猪链球菌生物被膜的形成[9]。研究发现猪链球菌中含有多种毒力基因,例如猪溶血素(SLY)、溶菌酶释放蛋白(MRP)、荚膜多糖(CPS)、胞外因子(EF)、谷氨酸脱氢酶(GDH)等,均与致病性相关[10-17]。
大多数现有的抗菌剂是天然化合物,如青霉素、链霉素和β-内酰胺类的提取物。由于耐药细菌的大量出现,新的抗菌药在市场上有很大的需求[18]。穿心莲内酯(Andrographolide,AG) 被誉为天然抗生素药物,是一种二萜内酯类化合物,爵床科植物穿心莲Andrographispaniculata(Burm. f) Ness的全草或叶中的一种活性物质,是穿心莲的有效成分之一,AG 和它的衍生物具有抗炎、抗感染、抗肿瘤、免疫调节等广泛的药理作用,特别是在一些抗感染作用更加明显,比如对细菌、真菌、病毒、原虫等[19]。通过构建猪链球菌体外生物被膜模型,采用中药单体穿心莲内酯对其进行干预,为猪链球菌病的细菌耐药性寻找替代疗法提供参考。
1 材料与方法
1.1 试验菌株
猪链球菌2型分离株[20],由中国农业科学院哈尔滨兽医研究所惠赠,具有良好的生物被膜形成能力,菌种保存于含有20%甘油的THB 培养基中,-80 ℃保存。
1.2 培养基及试剂
THB(Todd-Hewitt broth)培养基购于高科园海博生物技术有限公司;犊牛血清购于四季青有限公司;结晶紫染料、琼脂粉末、脑心浸液粉末均购于南京化学试剂有限公司;24孔及96孔细胞培养板购于美国Costar公司;穿心莲内酯标准品购于中国食品药品检定研究院。
1.3 穿心莲内酯对猪链球菌的MIC和MBC测定
向96孔细胞培养板依次加入用THB培养基稀释的菌液,第1孔加入160 μL THB稀释的菌液外,2~12孔每孔加入100 μL THB稀释的菌液。向第1孔加入40 μL 5 mg·mL-1的穿心莲内酯溶液,混匀后采取二倍稀释法逐一稀释每孔中的药物浓度至第11孔,并从第11孔吸取100 μL 弃去,第12孔为不加穿心莲内酯的阴性对照组。使每孔最终菌液浓度约为1×106cfu·mL-1。按上述方法做3组重复。于37 ℃培养24 h,以肉眼观察,无细菌生长为MIC[21]。从确定为MIC的孔到最后一孔中分别吸取50 μL的液体涂布法接种于THB固体培养基上,37 ℃培养24 h。接种平板中肉眼未见细菌生长的最低药物浓度为MBC[22]。
1.4 猪链球菌生长曲线的测定
将活化好的猪链球菌用THB液体培养基稀释到1×108cfu·mL-1,每个试管中加入一定量的THB培养基和穿心莲内酯,使菌液浓度为1×106cfu·mL-1,穿心莲内酯的浓度分别是1/2MIC、1/4MIC、1/8MIC、阴性对照组为不加药物组,每个试管内总体积为5 mL,每组3个重复。37 ℃恒温培养12 h,每小时取200 μL在600 nm处测定OD值,绘制生长曲线[23]。
1.5 菌落计数法观察亚抑菌浓度的穿心莲内酯对猪链球菌生物被膜的影响
步骤:①将干净的盖玻片分割成合适的大小,放入无菌的锥形瓶中,分别放入10 mL含有1/2MIC、1/4MIC和1/8MIC穿心莲内酯的培养基中,然后每孔中加入0.1 mL稀释好的菌液,以不加穿心莲内酯的孔为空白对照组,37 ℃培养48 h;②取出培养 48 h生物膜模型,灭菌 PBS 轻轻冲洗两次,去除浮游菌;锥形瓶中的菌液为悬浮菌组,两组分别进行如下操作;③将生物膜模型置于盛有5 mL无菌THB 培养液的试管中,高速涡旋振荡2 min,将细菌从玻璃片上振荡下来形成悬液;④采用梯度稀释法,分别稀释至10-1、10-2、10-3、10-4、10-5、10-6、10-7;⑤取0.1 mL 菌液到相应编号的THB平板中,垂直自流后置于37 ℃恒温孵育箱培养24 h;⑥到达规定时间后选取菌落在30~300之间的平板计数。菌落数与对应稀释倍数乘积即为原液细菌量,并换算成常用对数(gcfu·cm-2)。
1.6 亚MIC穿心莲内酯干预猪链球菌培养对生物被膜形成影响
取无菌的96孔板,同菌液浓度的猪链球菌放入含有1/2MIC、1/4MIC和1/8MIC的96孔板中,以不加穿心莲内酯的孔为阴性对照组,氨苄西林抑制组为阳性对照,每组3个重复,培养72 h。然后将上层悬浮的猪链球菌吸走,用等量的无菌PBS清洗三次。再向每孔加入99%甲醇200 μL,固定15 min,晾干。每孔加入2%结晶紫200 μL染色5 min后,将染色液用无菌PBS冲洗掉。晾干,将结合染料的贴壁细菌及多糖等用33%冰醋酸200 μL溶解。用酶标仪(595 nm)测量OD值[24]。
1.7 RNA提取和定量RT-PCR
取处在对数生长期的猪链球菌100 μL,分别放入5 mL含有1/2MIC、1/4MIC和1/8MIC穿心莲内酯的培养基中,在37 ℃的环境下进一步孵化72 h。阴性对照组培养基中不加穿心莲内酯。提取猪链球菌生物被膜的mRNA后用试剂盒进行cDNA的合成[25]。RT-PCR用来测量gdh、mrp、gapdh、sly、fbps、ef、cps2J和luxSmRNA 的转录量,16S rRNA为内参基因。引物由上海生工设计并合成(表1)。准备20 μL PCR 预混液,包括12.5 μL 的IQ SYBR Green Supermix,1 μL的基因特异性引物(上下游引物总和)和6.5 μL的Rnase- and DNase-free water;最后加入5 μL 的cDNA。RT-PCR的反应条件:94 ℃ 10 min,以下进行35个周期:94 ℃ 15 s,60 ℃ 60 s,72 ℃ 20 s;72 ℃ 10 min[26]。
表1用于定量分析的引物
Table1Primersforquantitativeanalysis

基因Gene序列(5'-3')Sequence(5'-3')正向引物Forward反向引物ReversegdhACCTCTTGGCTTTGGTGGTTGAAGGATTTACCGTTTGCTGmrpTGGCACAGTTATCAAGGAACCTACCGTCAACACGAACCAATgapdhGCTGAAGAAGTAAACGCTGCTGTCGCATCAAACAATGAACCslyAGTCAGTTTGGCACTCGTAGGTTGTGGCTCGTAAGTCAAGCfbpsGCTCCTGACCACCTATCTGCTCAAAGCCACATCCAACTCAefGAACCCAAGGAACCAATCGAACATTCTGACCACTCGCATCcps2JTTGGAATACGCAGAGCAAGATAACCCTCCCGACAAATCACluxSCGAGTTTGGAAGAAATTGCAGAGCTGAATGAAGGCTGTGGT16SrRNATGCTAGTCACCGTAAGGCTAAGGGCTGCAAGATTTCCTTGAT
1.8 亚MIC穿心莲内酯干预猪链球菌生物被膜形态的观察
步骤:①固定,将干净的盖玻片分割成合适的大小,放入无菌的24孔板中,分别放入含有2 mL 1/2MIC、1/4MIC和1/8MIC穿心莲内酯的培养基中,然后每孔中加入1 mL稀释好的菌液,以不加穿心莲内酯的孔为空白对照组,37 ℃培养72 h后取出盖玻片放入平皿中;用灭菌PBS洗涤两次,放入戊二醛中固定,置4 ℃冰箱中1 h。②冲洗,用灭菌PBS洗去戊二醛,轻轻洗涤两次,每次10 min。③脱水,用50%、70%、90%乙醇各脱水一次,每次10 min;用100%乙醇脱水2次,每次10 min。④置换,无水乙醇∶叔丁醇=1∶1,叔丁醇各1次,每次15 min。⑤干燥,将样品放入-20 ℃冷冻室30 min,取出后放入冷冻干燥仪干燥4 h以上。⑥点样,将制备好的样品观察面朝上,用导电胶带粘附于扫描电镜样品台上,进行标记、观察。⑦镀膜,用E-1010型离子溉射键膜仪,在真空条件下将样品表面镀一层厚150A的金属膜;⑧观察,将制备好的样品粘在样品台上,扫描电镜下进行观察[27]。
1.9 AI-2的测定
将哈维氏弧菌接种于海生菌肉汤培养基中,于8 ℃ 120 r·min-1摇床培养24 h。600 nm测其OD值范围在0.7~1.2均可。用新鲜的海生菌肉汤培养基以1∶5 000稀释,随后振荡摇匀。用12孔板培养猪链球菌,第1孔加入2 mL含穿心莲内酯1 mg·mL-1的THB液体培养基,第2、3、4孔每孔加入1 mL普通THB培养基,从第1孔吸出1 mL加入到第2个孔依此类推,至第4孔吸出1 mL弃去,然后每孔加入1 mL普通THB培养基。第5孔加入2 mL普通THB培养基作为空白对照。最后每孔加入100 μL 稀释好的猪链球菌。37 ℃恒温培养24 h。24 h后,将之前培养过的液体12 000 r·min-1,离心10 min,取上清液。将上述上清液放到试管中,以1∶9的体积比与哈维氏弧菌的稀释菌液混合。每个试管做2组平行。28 ℃ 4 h摇床振荡培养。4 h 后每个试管取出200 μL加入到黑色96孔酶标板内,每个试管取三组做平行。荧光酶标仪测定其化学荧光[28]。
1.10 统计学处理

2 结 果
2.1 穿心莲内酯抗猪链球菌MIC和MBC测定
从表2可知穿心莲内酯对猪链球菌的最低抑菌浓度(MIC)为0.25 mg·mL-1,最低杀菌浓度(MBC)为0.5 mg·mL-1。
表2穿心莲内酯对猪链球菌的MIC和MBC
Table2MICandMBCofAndrographolideagainstStreptococcussuis

0.125mg·mL-10.25mg·mL-10.5mg·mL-11mg·mL-1MIC+---MBC++--
2.2 猪链球菌生长曲线
穿心莲内酯在1/2MIC、1/4MIC、1/8MIC时对猪链球菌的生长无明显抑制作用,试验结果见图1。

图1 穿心莲内酯亚MIC浓度下猪链球菌的生长曲线Fig.1 Growth curve of Streptococcus suis at sub-MIC concentration of Andrographolide
2.3 菌落计数法观察亚抑菌浓度的穿心莲内酯对猪链球菌生物被膜的影响
由表3可知在1/2MIC、1/4MIC、1/8MIC时生物被膜中细菌数量明显降低。
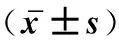

Table 3 The number of Streptococcus suis supplement with sub-MIC concentration of Andrographolide gcfu·cm-2
2.4 亚MIC穿心莲内酯对猪链球菌生物被膜的干预作用
1/2MIC组、阳性对照与阴性对照组比较差异极显著(P<0.01),1/4MIC、1/8MIC组与阴性对照组比较差异显著(P<0.05)。穿心莲内酯对猪链球菌有干预作用呈剂量依赖性。试验结果见图2。
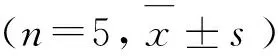
*. P<0.05,**. P<0.01图2 亚MIC 浓度穿心莲内酯对猪链球菌生物被膜干预的作用Fig.2 Effect of sub-MIC concentration of Andrographolide on the biofilm of Streptococcus suis
2.5 RT-PCR检测结果
如图3所示,穿心莲内酯对猪链球菌的毒力因子gapdh、fbps、sly、ef、luxS的转录有抑制作用,在1/2MIC、1/4MIC时有显著的抑制作用(P<0.05 或P<0.01),1/8MIC时没有明显的抑制作用。


*. P<0.05,**. P<0.01图3 穿心莲内酯对猪链球菌5种毒力因子转录影响测定结果Fig.3 Effect of Andrographolide on the transcription of 5 virulence factors of Streptococcus suis
如图4所示,穿心莲内酯对猪链球菌的毒力因子cps2J、mrp、gdh的转录有促进作用,在1/2MIC、1/4MIC时有显著的促进作用(P<0.05或P<0.01),1/8MIC时没有明显的促进作用。


*. P<0.05,**. P<0.01图4 穿心莲内酯对猪链球菌3种毒力因子转录影响测定结果Fig.4 Effect of Andrographolide on the transcription of 3 virulence factors of Streptococcus suis
2.6 亚MIC穿心莲内酯对猪链球菌生物被膜干预作用的形态学观察
扫面电镜结果显示,不加药物组中的细菌被镶嵌在生物被膜中,周围包裹着许多膜状物质,穿心莲内酯能够使细菌周围的膜状物质消失,细胞外基质大量减少,细菌生物被膜发生明显变化,细菌的数量明显下降;穿心莲内酯对生物被膜的形成有抑制作用,且随着剂量的增加这种抑制作用也随之明显增强,1/2MIC(图5A)穿心莲内酯对生物被膜的干预作用最强,1/2MIC(图5A)穿心莲内酯,1/4MIC(图5B)穿心莲内酯,1/8MIC(图5C)穿心莲内酯对生物被膜的干预作用依次减弱,图5D为不加穿心莲内酯的阴性对照组。
2.7 AI-2的测定结果
使用哈维氏弧菌生物发光法测定细菌培养液中AI-2活性。AI-2活性测定表示为相对光单位和阴性组比较差异性。如图6所示,1/2MIC、1/4MIC、1/8MIC组与阴性对照组比较均有显著性差异(P<0.01或P<0.05),说明穿心莲内酯对猪链球菌AI-2信号分子的产生有抑制作用,并且有剂量依赖性。
3 讨 论
汪洋已经研究出猪链球菌在体内定植常以生物被膜形式生存,生物被膜可以阻止和抑制巨噬细胞、白细胞、抗体及抗生素进入生物被膜中清除或杀灭细菌,导致链球菌反复感染,难以控制[29]。从本研究中的猪链球菌对照组结晶紫染色结果可知,猪链球菌形成生物被膜的能力较强,在电镜图片中可看到猪链球菌被胞外基质包绕,层层排布在菌体的周围,形成塔型或蘑菇型的生物被膜[30]。如何能够抑制或清除生物被膜,防止其反复感染已成为国内、外学者关注的焦点。目前有研究结果表明十四、十五元环大环内酯类药物对抑制细菌生物被膜形成有一定的作用[31]。本研究采用1/2MIC、1/4MIC、1/8MIC浓度的穿心莲内酯对猪链球菌生物被膜形成进行干预,可见穿心莲内酯能够有效抑制猪链球菌生物被膜的形成,这种抑制作用随药物剂量的增加而增强。这一结果与上文提到的结果相似。从扫描电镜试验结果可知,穿心莲内酯能使细菌生物被膜中的细菌数量和生物被膜的形态发生明显变化,可见穿心莲内酯对生物被膜的干预作用确实存在剂量依赖性。

A. 1/2MIC穿心莲内酯;B. 1/4MIC穿心莲内酯;C. 1/8MIC穿心莲内酯;D.阴性对照A. 1/2MIC Andrographolide; B. 1/4MIC Andrographolide; C. 1/8MIC Andrographolide; D. Negative control图5 扫描电镜观察亚MIC浓度穿心莲内酯对猪链球菌生物膜的形态学观察(3 000×)Fig.5 Observation the effects of sub-MICs concentration of Andrographolide on the morphology of Streptococcus suis biofilm by scanning electron microscopy (3 000×)

*. P<0.05,**. P<0.01图6 穿心莲内酯对猪链球菌AI-2的信号分子影响测定结果Fig.6 Effects of Andrographolide on Streptococcus suis AI-2 signals
已经被证实了的早期猪链球菌经典的毒力及与毒力相关的基因有CPS、MRP、IgG结合蛋白、GAPDH、分泌型核酸酶A、透明质酸酶、EF、SLY、GDH、GDH、FBPS、精氨酸氨基肽酶、精氨酸氨基肽酶等。虽然对于猪链球菌的了解还不是非常的全面,但是经过了前人20多年的研究,已经鉴定出了一些公认的毒力基因及毒力的相关基因,在很大程度上提升了我们对于潜在毒力基因的认知度[10-12]。在相关研究报道中指出[29],猪链球菌的毒力因子gapdh、sly、fbps、cps2J、mrp与猪链球菌的侵袭及黏附有关,从而能够达到调节生物被膜形成的作用。本研究荧光定量PCR结果发现阴性对照组和加药组相比,gapdh、sly、fbps、ef基因表达下调,而cps2J、mrp和gdh基因表达上调,并呈剂量依赖性。这说明穿心莲内酯有可能影响相关黏附基因的表达,从而抑制了猪链球菌生物被膜的形成。与此同时,我们发现luxS基因表达下调,而且在使用哈维氏弧菌生物发光法测定细菌培养液中AI-2活性试验时,我们发现穿心莲内酯对猪链球菌AI-2信号分子的产生有抑制作用,并且有剂量依赖性。众所周知[29],luxS基因AI-2信号分子是调节密度感应系统的重要因子,密度感应系统(QS)是生物群体调节生命活动一种重要的调节系统,它可以使生物群体在达到一定的密度时调节诸如发光、产气、耐药及生物被膜形成等生命活动。在本研究中显示,穿心莲内酯能够下调表达luxS基因及抑制AI-2信号分子活性,说明穿心莲内酯能够干预猪链球菌的QS系统,从而对猪链球菌生物被膜的形成产生了抑制作用。从以上结果我们发现,穿心莲内酯能很好地抑制猪链球菌形成生物被膜,并初步阐述其抑制的机制,然而猪链球菌生物被膜的产生和抑制机制还需要我们进一步的研究,希望本试验可以为预防和治疗猪链球菌病提供一些具体有意义的数据。
4 结 论
亚抑菌浓度的穿心莲内酯能够干预猪链球菌生物被膜形成,并影响猪链球菌相关毒力基因及AI-2信号分子的表达。
参考文献(References):
[1]LUN Z R, WANG Q P, CHEN X G, et al.Streptococcussuis: an emerging zoonotic pathogen[J].LancetInfectDis, 2007, 7(3): 201-209.
[2]ZHANG Y Y, DING D D, LIU M L, et al. Effect of the glycosyltransferases on the capsular polysaccharide synthesis ofStreptococcussuisserotype 2[J].MicrobiolRes, 2016, 185: 45-54.
[3]MOHAMMADI Z, PALAZZI F, GIARDINO L, et al. Microbial biofilms in endodontic infections: an update review[J].BiomedJ, 2013, 36(2): 59-70.
[4]尤理想, 赵青, 周敏, 等. 细菌生物膜检测方法改进与应用[J]. 实验技术与管理, 2015, 32(3): 72-76.
YOU L X, ZHAO Q, ZHOU M, et al. Improved method of bacterial biofilm detection and its application[J].ExperimentalTechnologyandManagement, 2015, 32(3): 72-76. (in Chinese)
[5]MAN N K, DEGREMONT A, DARBORD J C, et al. Evidence of bacterial biofilm in tubing from hydraulic pathway of hemodialysis system[J].ArtifOrgans, 1998, 22(7): 596-600.
[6]SERRA D O, RICHTER A M, KLAUCK G, et al. Microanatomy at cellular resolution and spatial order of physiological differentiation in a bacterial biofilm[J].mBio, 2013, 4(2): 00103-13.
[8]CASTELO-BRANCO D S C M, RIELLO G B, VASCONCELOS D C, et al. Farnesol increases the susceptibility ofBurkholderiapseudomalleibiofilm to antimicrobials used to treat melioidosis[J].JApplMicrobiol, 2016, 120(3): 600-606.
[9]WANG S, YANG Y B, ZHAO Y L, et al. Sub-MIC tylosin inhibitsStreptococcussuisbiofilm formation and results in differential protein expression[J].FrontMicrobiol, 2016, 7: 384.
[10]CALZAS C, LEMIRE P, AURAY G, et al. Antibody response specific to the capsular polysaccharide is impaired inStreptococcussuisserotype 2-infected animals[J].InfectImmun, 2015, 83(1): 441-453.
[11]SANTHAKUMARI S, KANNAPPAN A, PANDIAN S K, et al. Inhibitory effect of marine cyanobacterial extract on biofilm formation and virulence factor production of bacterial pathogens causing vibriosis in aquaculture[J].JApplPhycol, 2016, 28(1): 313-324.
[12]HUSAIN F M, AHMAD I. Doxycycline interferes with quorum sensing-mediated virulence factors and biofilm formation in Gram-negative bacteria[J].WorldJMicrobiolBiotechnol, 2013, 29(6): 949-957.
[13]ALASIL S M, OMAR R, ISMAIL S, et al. Inhibition of quorum sensing-controlled virulence factors and biofilm formation inPseudomonasaeruginosaby culture extract from novel bacterial species ofPaenibacillususing a rat model of chronic lung infection[J].IntJBacteriol, 2015, 2015: 671562.
[14]KIM B S, PARK S J, KIM M K, et al. Inhibitory effects ofChrysanthemumborealeessential oil on biofilm formation and virulence factor expression ofStreptococcusmutans[J].EvidBasedComplementAlternatMed, 2015, 2015: 616309.
[15]ZIUZINA D, BOEHM D, PATIL S, et al. Cold plasma inactivation of bacterial biofilms and reduction of quorum sensing regulated virulence factors[J].PLoSOne, 2015, 10(9): e0138209.
[16]KASIMANICKAM V R, OWEN K, KASIMANICKAM R K. Detection of genes encoding multidrug resistance and biofilm virulence factor in uterine pathogenic bacteria in postpartum dairy cows[J].Theriogenology, 2015, 85(2): 173-179.
[17]CHOI N Y, KANG S Y, KIM K J.Artemisiaprincepsinhibits biofilm formation and virulence-factor expression of antibiotic-resistant bacteria[J].BiomedResInt, 2015, 2015: 239519.
[18]AVIN S, AVINASH A, PATIL N, et al. Recent advances in the development of antibacterial agents[J].ResJPharmBiolChemSci, 2015, 6(5): 1220-1228.
[19]HSU Y H, HSU Y L, LIU S H, et al. Development of a bifunctional andrographolide-based chemical probe for pharmacological study[J].PLoSOne, 2016, 11(4): e0152770.
[20]于文会, 许晶, 魏庆微, 等. 蒲公英水提物对猪链球菌生物被膜体外干预作用[J]. 畜牧兽医学报, 2015, 46(10): 1875-1881.
YU W H, XU J, WEI Q W, et al.Dandelionaqueous extract affects biofilm formation byS.suis[J].ActaVeterinariaetZootechnicaSinica, 2015, 46(10): 1875-1881. (in Chinese)
[21]CHOI S C. Effects of bacterial biofilms and iron oxide on copper distribution in a simulated marine environment: an implication to the sediments in the Pearl River estuary[D]. Hong Kong, China: The Hong Kong Polytechnic University, 2003: 189-230.
[22]张文元, 杨亚冬, 唐靓. 十四元环大环内酯类对细菌生物被膜形成的影响及对环丙沙星的增效作用[J]. 中国卫生检验杂志, 2005, 15(11): 1288-1289.
ZHANG W Y, YANG Y D, TANG L. Effects of 14-membered macrolides on the formation ofPseudomonasaeruginosabiofilms and synergism between macrolide and ciprofloxacin[J].ChineseJournalofHealthLaboratoryTechnology, 2005, 15(11): 1288-1289. (in Chinese)
[23]VAN CALSTEREN M R, GAGNON F, LACOUTURE S, et al. Structure determination ofStreptococcussuisserotype 2 capsular polysaccharide[J].BiochemCellBiol, 2010, 88(3): 513-525.
[24]DOBRETSOV S, QIAN P Y. The role of epibotic bacteria from the surface of the soft coralDendronephthyasp. in the inhibition of larval settlement[J].JExpMarBiolEcol, 2004, 299(1): 35-50.
[25]吴恋, 王春艳, 吕维, 等. 藏药大车前草中大车前苷的定性和定量分析[J]. 成都中医药大学学报, 2014, 37(1): 48-50, 59.
WU L, WANG C Y, LV W, et al. Qualitative and quantitative analysis of plantamajoside inPlantagomajorL.[J].JournalofChengduUniversityofTCM, 2014, 37(1): 48-50, 59. (in Chinese)
[26]Vaccine composition against Streptococcus suis infection: EP, 2949340[P]. 2015-12-02.
[27]HUANG Y H, CAI T G, XIA X, et al. Research advances in the intervention of inflammation and cancer by active ingredients of traditional Chinese medicine[J].JPharmPharmSci, 2016, 19(1): 114-126.
[28]CALLEJO R, PRIETO M, ROCCA F, et al. Molecular characterization ofStreptococcussuisserotype 2 strains isolated from humans and diseased pigs in Argentina[C/OL]//Proceedings of Xix Lancefield International Symposium on Streptococci and Streptococcal Diseases. Buenos Aires, Argentina, 2014. [2017-12-26].https://www.researchgate.net/publication/268222687_MOLECULAR_CHARACTERIZATION_OF_STREPTOCOCCUS_SUIS_SEROTYPE_2_STRAINS_ISOLATED_FROM_HUMANS_AND_DISEASED_PIGS_IN_ARGENTINA
[29]汪洋. 猪链球菌生物被膜形成及致病机理研究[D]. 南京: 南京农业大学, 2011: 1-10.
WANG Y. Study on the mechanism of biofilm formation and molecular pathogenesis ofStreptococcussuis[D]. Nanjing: Nanjing Agricultural University, 2011: 1-10. (in Chinese)
[30]SAHA M, WAHL M. Seasonal variation in the antifouling defence of the temperate brown algaFucusvesiculosus[J].Biofouling, 2013, 29(6): 661-668.
[31]LUTZ L, PEREIRA D C, PAIVA R M, et al. Macrolides decrease the minimal inhibitory concentration of anti-pseudomonal agents againstPseudomonasaeruginosafrom cystic fibrosis patients in biofilm[J].BMCMicrobiol, 2012, 12: 196.
