荷斯坦奶牛乳腺干细胞的成神经诱导鉴定及催乳素对其增殖活性的影响
2018-04-04刘迎春陈钰萌韩哲先周欢敏
刘迎春,陈钰萌,韩哲先,高 峰,周欢敏
(1.内蒙古农业大学生命科学学院,呼和浩特 010018; 2.内蒙古自治区生物制造重点实验室,呼和浩特 010018;3.内蒙古农业大学动物科学学院,呼和浩特 010018)
动物的乳腺是一种能够反复经历发育、功能分化和退化的组织,早在胚胎期乳腺就己经开始发育[1]。奶牛的乳腺发育经过胚胎期、青春期前、青春期后、妊娠期、泌乳期及干乳期6个时期[2],这一过程是奶牛泌乳性能发挥的决定性过程。然而在乳腺的生长发育过程中,乳腺干细胞(Mammary stem cells, MSCs)对于青春期、妊娠期、泌乳期和泌乳衰退期的乳腺生长与重建具有重大意义[3]。乳腺干细胞由多种类型的上皮细胞组成,生长发育于动物的乳腺之中的一种处于静止期的,未分化的细胞,其特点为自我增殖、自我更新和多向分化。其可以分化为所有类型的乳腺细胞[4],特别是具有向不同胚层来源细胞跨越分化的能力,跨越分化的研究,更有助于揭示细胞分化的机制。同时,乳腺干细胞的增殖对乳腺的生长、分化和再生也有十分重要的作用,尤其是在动物妊娠期、泌乳期和泌乳衰退周期中[5],是研究器官形成、细胞分化研究的理想模型。近年来的研究显示[6],激素、生长因子、细胞因子及细胞外基质组分是干细胞分化增殖所必须的。乳腺的泌乳功能同样依赖激素的调控,尤其是催乳素(Prolactin,PRL)的调控作用[7]。催乳素是一种蛋白质激素,由垂体前叶腺嗜酸细胞分泌,与其受体结合后,引发催乳素介导的细胞信号转导通路[8],从而促进乳腺发育,发动并维持泌乳[9]。但是,催乳素如何促进奶牛乳腺干细胞向乳腺细胞发育分化,完成乳腺生长与重建的机理仍不清楚。由于干细胞在体外经化学诱导后具有跨胚层分化的能力[10],所以体外诱导法也是鉴定干细胞的常用方法。因此,本研究在已分离纯化的荷斯坦奶牛乳腺干细胞基础上,利用体外诱导法来诱导乳腺干细胞分化为神经细胞,旨在鉴定分离纯化得到的荷斯坦奶牛乳腺干细胞具有跨胚层分化的能力,即多向分化潜能;并用催乳素刺激乳腺干细胞,以探讨催乳素对其增殖的最适浓度,以期为催乳素调控乳腺干细胞在奶牛乳腺重建过程及泌乳性能的最大发挥提供理论依据。
1 材料与方法
1.1 材料
本实验室提供的已分离纯化的P3代荷斯坦奶牛乳腺干细胞[11]。DMEM/F12(SH30023.01B)、胎牛血清(FBS,SV30087.01)、PBS(SH30256.01B)均购自 HyClone 公司;青霉素(00212226)、链霉素(03032507)均购自华北制药公司;胰蛋白酶(T4799)、催乳素(268615-1G)均购自 Sigma 公司;Insulin-Transferrin-Selenium(907606)购自Gibco公司;β-巯基乙醇(MB0338)购自BBI公司。尼氏染色试剂盒(DK0021)购自北京雷根生物公司;MTT (T0793)、二甲基亚砜(DMSO,0231)均购自Amresco公司。
1.2 方法
1.2.1乳腺干细胞的复苏自液氮中取出P3代乳腺干细胞,迅速放到37 ℃水浴锅中,镊子夹住冻存管震荡,直至冻存液溶解后拿出。75%酒精擦净管口后,迅速移进超净工作台,吸出细胞冻存液,移到1.5 mL离心管,1 500 r·min-1离心5 min,弃除上清液,用干细胞培养液(DMEM/F12 +10%FBS +1%PS+EGF 20 ng·mL-1+ ITS 10 μL·mL-1)重悬细胞,将细胞接种到培养皿中,移入37 ℃、5%CO2培养箱培养。
1.2.2乳腺干细胞的传代培养待细胞长到70%~80%融合时,酶消化法传代培养。弃掉培育细胞时的细胞培养液,加适量的有双抗(青霉素+链霉素)的PBS溶液清洗2遍后,弃掉,向培养皿中加入1 mL 0.25%胰蛋白酶消化细胞,待消化1~5 min,向培养皿中加入等体积培养液,停止消化。将上述细胞悬液转移入1.5 mL的离心管中,1 500 r·min-1离心5 min,弃除上清,干细胞培养液重悬细胞,细胞计数(细胞计数板法,细胞数/mL=4个大格细胞总数/4×(104·mL-1)。
1.2.3乳腺干细胞成神经诱导 取上述传代的细胞接种于12孔板中;显微镜观察待细胞贴壁生长为50%~60%融合的时候,随机分为对照组和试验组,试验组加入神经预诱导液(DMEM/F12 +10%FBS +1 mmol·L-1β-巯基乙醇),对照组加入普通培养液(DMEM/F12 +10%FBS +1%PS),置37 ℃、5%CO2培养箱中诱导24 h。24 h后,取适量PBS,清洗1遍,试验组加入神经诱导液(DMEM/F12 +10%FBS +3 mmol·L-1β-巯基乙醇),对照组不变,置37 ℃、5%CO2培养箱中继续培养,每天更换培养液1次,每天注意在荧光显微镜下观察细胞生长形态的变化,并使用尼氏染色,试剂盒染色,鉴定神经细胞。
1.2.4乳腺干细胞诱导分化为神经细胞特异表达基因鉴定神经微管蛋白Ⅲ(β-TubulinⅢ)和神经元特异性烯醇化酶(NSE)为神经细胞的特异表达基因,利用Priemer 5.0软件设计合成引物,并由生工生物工程(上海)有限公司合成(表1)。首先用RNAiso Plus裂解已诱导的乳腺干细胞,然后提取总RNA,并反转录为cDNA,通过PCR体系和1%琼脂糖凝胶电泳进行鉴定。
表1神经细胞标记基因引物序列
Table1Theprimerssequenceofmarkergeneinneuralcell
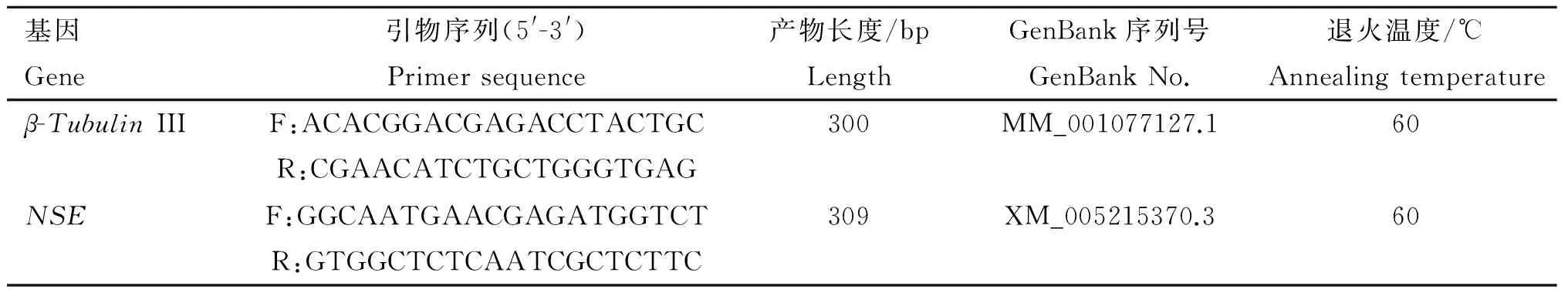
基因Gene引物序列(5'-3')Primersequence产物长度/bpLengthGenBank序列号GenBankNo.退火温度/℃Annealingtemperatureβ-TubulinIIIF:ACACGGACGAGACCTACTGCR:CGAACATCTGCTGGGTGAG300MM_001077127.160NSEF:GGCAATGAACGAGATGGTCTR:GTGGCTCTCAATCGCTCTTC309XM_005215370.360
1.2.5乳腺干细胞活力的检测按照2×103·孔-1的密度将细胞悬液接种于96孔培养板中,置于37 ℃、5%CO2饱和湿度的培养箱中培养,待干细胞生长贴壁后,随机的分为对照组和催乳素处理组。设定催乳素0(对照组)、100、300、500、700 ng·mL-15个浓度梯度进行处理,每个浓度设定8个复孔,每个培养孔为1 个重复,置于37 ℃、5%CO2培养箱中继续培养24 h;在培养结束前4 h,各培养孔加入 MTT(5 mg·mL-1) 20 μL; 4 h后,弃上清液,每孔加入二甲基亚砜(DMSO) 200 μL以溶解沉淀,振荡10 min,用酶标仪在490 nm 波长处检测各孔的吸光度值(OD)。
细胞相对增殖率(Relative growth rate,RGR)=(试验组 OD490 nm/对照组 OD490 nm)×100%。
1.2.6数据分析采用SAS 9.4一般线性模型进行数据统计分析,以P<0.05为差异显著。
2 结 果
2.1 乳腺干细胞的传代与复苏
将解冻后的乳腺干细胞培养2 d,显微镜下,观察细胞贴壁后,有明显铺路石状生长的细胞即为乳腺干细胞;高倍镜下发现乳腺干细胞的细胞核较大,呈多核状态,占细胞大部分位置,即核质比大,可见细胞有明显的幼稚细胞的状态(图1)。

A.100×;B. 400×图1 乳腺干细胞的传代与复苏(2 d)Fig.1 Passage and recovery of mammary stem cells (2 d)
2.2 乳腺干细胞成神经诱导
乳腺干细胞中加入神经预诱导液,放入CO2培养箱,培养24 h,有大部分乳腺干细胞都漂浮在培养基中,并且死亡,部分细胞开始慢慢变圆,也有堆积成细胞簇的现象,细胞两极伸出细长突起,状似双极神经元细胞,尼氏染色呈阳性(图2A),对照组细胞尼氏染色,可以从倒置显微镜中观察到乳腺干细胞中有少许尼氏颗粒的存在,但没有看到细胞明显的分化成杆状,树突状类型的神经细胞(图2A′);更换正式神经诱导液,CO2培养箱中培养24 h,可以明显的观察到有杆状,树突状的神经细胞,经尼氏染色呈阳性(图2B),对照组尼氏染色后有少许尼氏颗粒的存在,仍没有看到细胞明显的分化(图2B′);神经细胞继续诱导24 h,有更多的细胞旁边延伸出突起,细胞周围出现微管样结构有所增加,经尼氏染色呈阳性(图2C),对照组尼氏染色后仍只有少许尼氏颗粒的存在,细胞未分化成杆状,树突状类型的神经细胞(图C′)。
A.诱导24 h;A′.未诱导24 h;B.诱导48 h;B′.未诱导48 h;C.诱导72 h;C′.未诱导72 h A. MSCs were induced 24 h; A′. MSCs were not induced 24 h; B. MSCs were induced 48 h;B′. MSCs were not induced 48 h; C. MSCs were induced 72 h;C′. MSCs were not induced 72 h图2 乳腺干细胞成神经诱导(100×)Fig.2 Mammary stem cells(MSCs)were induced into neurocyte(100×)
2.3 乳腺干细胞诱导分化为神经细胞标记基因鉴定
RT-PCR法检测神经细胞特异表达基因β-TubulinⅢ和NSE都呈现阳性结果,利用特异性引物扩增目的基因片段,电泳显示条带清晰且单一,无非特异扩增,图3结果表明,β-TubulinⅢ的片段大小约为300 bp,NSE的片段大小约为309 bp,与设计的片段大小符合。
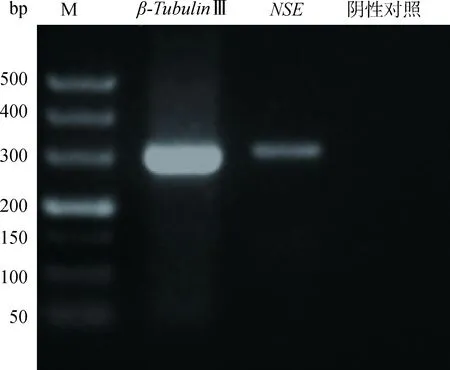
图3 乳腺干细胞成神经诱导(基因检测)Fig.3 Mammary stem cells were induced into neurocyte (Gene detection)
2.4 催乳素对乳腺干细胞增殖的影响
不同浓度催乳素对乳腺干细胞相对增殖率(RGR)的影响见表2。催乳素处理组(除700 ng·mL-1组外)RGR显著高于对照组(P<0.05),100 ng·mL-1处理组显著高于其他各组(P<0.05)。结果表明,与对照组相比较,催乳素组可显著促进乳腺干细胞的增殖,其中100 ng·mL-1组的增殖活性最高。
3 讨 论
乳腺干细胞是一种成体干细胞,具有多向分化潜能及自我更新能力[12]。研究发现,处于不同发育时期的动物乳腺中都存在一定比例的干细胞,正是这些干细胞对组织自稳态的维持和乳腺的生长与重建有很重要的作用[13],但是目前人们对乳腺干细胞的了解并不多。在乳腺干细胞存在于一部分基底细胞的前期认识基础上[14],前人曾经尝试回答乳腺干细胞的分化潜能问题。笔者将荷斯坦奶牛的乳腺干细胞在体外分离和培养并研究[15],检测其多向分化潜能,这就是鉴定干细胞的一个重要的判断标准。本试验加入神经诱导液后,乳腺干细胞由紧密排列的铺路石状变为长梭型,且生长均一。随着诱导时间不断增长,能够发现有类神经元细胞,经过尼氏染色后呈阳性。经过诱导后的乳腺干细胞可以表达一些神经元细胞或星形胶质细胞的特异标志物[16]:NSE和β-tubulinⅢ。RT-PCR技术鉴定基因的表达量,结果呈阳性表达。由此表明,在本研究条件下培养细胞,乳腺干细胞可表达其多向分化潜能,可以向多数不同的细胞组织定向分化。
表2不同浓度催乳素对奶牛乳腺干细胞相对增殖率的影响
Table2EffectofdifferentconcentrationsofprolactinonRGRofmammarystemcell

项目Item催乳素/(ng·mL-1)Prolactin0100300500700SEMP值PvalueRGR1.00±0.04c1.38±0.03a1.25±0.02b1.19±0.06b1.12±0.02bc0.05580.0546
同行数据肩标不同小写字母表示差异显著(P<0.05);相同或无小写字母表示差异不显著(P>0.05)
Values in the same row with different small letter superscripts mean significant difference (P<0.05), while with the same or no letter superscripts mean no significant difference (P>0.05)
乳腺的发育及泌乳都需要激素的调控。催乳素在促进哺乳动物的乳腺发育和维持泌乳等方面发挥重大作用[17-18]。催乳素对奶牛乳腺的发育及泌乳的研究已经取得了一些成果。E.H.Wall等[19]研究表明,给奶牛外源注射少量的催乳素,产奶量增加;P.Lacasse等[20]研究发现,无论单胃动物还是反刍动物,催乳素都可以促进其乳腺的发育和泌乳[21]。催乳素不仅可以通过激素系统间接地调节乳腺的发育,也可以通过与乳腺上皮细胞的催乳素受体结合直接调节乳腺的发育[22]。田青等[23-24]研究表明,胰岛素、催乳素和氢化可的松能促进乳腺上皮细胞增殖。邢媛媛等[25]研究结果表明,低浓度催乳素能够促进乳腺上皮细胞的增殖,而高浓度(1 000 ng·mL-1)催乳素对乳腺上皮细胞的增殖产生抑制效应。同时发现不同浓度的催乳素对乳脂和乳蛋白的合成调控有一定的关系,即低浓度时催乳素促进合成。100~300 ng·mL-1的浓度作用效果最好,而高浓度(1 000 ng·mL-1) 的催乳素对奶牛乳腺的乳脂和乳蛋白的合成产生一定的抑制作用。因为乳腺干细胞对于青春期、妊娠期、泌乳期和泌乳衰退期的乳腺生长与重建等都具有重要意义,笔者认为催乳素也会对乳腺干细胞的增殖产生一定的作用。将催乳素作用于乳腺干细胞,并利用 MTT 法检测其对乳腺干细胞增殖活性的影响,旨在初步探讨催乳素对于乳腺干细胞的作用意义。结果表明,催乳素能够促进乳腺干细胞的增殖。另外,本试验发现在选取不同浓度的催乳素刺激乳腺干细胞的情况下,100 ng·mL-1催乳素处理组乳腺干细胞增殖活性显著高于0、300、500、700 ng·mL-1刺激组,说明低浓度时乳腺干细胞的活力较好,即且100 ng·mL-1为荷斯坦奶牛乳腺干细胞增殖的最适浓度。由此证明了催乳素可以促进乳腺干细胞增殖,为促进乳腺干细胞在体外继续增殖,并分化为正常的乳腺细胞提供理论支持,这对于乳腺干细胞的临床应用有重要意义。
本研究条件下可证明体外分离和培养的荷斯坦奶牛的乳腺干细胞具有多向分化潜能,且催乳素刺激后,增殖活性显著增强,为进一步研究乳腺干细胞在体内外的分化和扩增提供基本的理论依据。以期为催乳素调控乳腺干细胞在奶牛乳腺重建过程及泌乳性能的最大发挥提供基础理论依据。
4 结 论
在本研究条件下,体外分离培养的荷斯坦奶牛乳腺干细胞经特定诱导可以定向分化为神经样细胞,具有分化神经细胞的能力,说明乳腺干细胞的多向分化潜能。催乳素可促进乳腺干细胞增殖,且100 ng·mL-1为增殖的最适浓度。
参考文献(References):
[1]李庆章. 奶牛乳腺发育与泌乳生物学[M]. 北京: 科学出版社, 2014.
LI Q Z. Mammary gland development and lactation biology in dairy cows[M]. Beijing: Science Press, 2014. (in Chinese)
[2]HORIGAN K C, TROTT J F, BARNDOLLAR A S, et al. Hormone interactions confer specific proliferative and histomorphogenic responses in the porcine mammary gland[J].DomestAnimEndocrinol, 2003, 7(2): 124-138.
[3]STELWAGEN K, SINGH K. The role of tight junctions in mammary gland function[J].JMammaryGlandBiolNeoplasia, 2014, 19(1): 131-138.
[4]FU N Y, LINDEMAN G J, VISVADER J E. The mammary stem cell hierarchy[J].CurrTopDevBiol, 2014, 107: 133-160.
[5]KORDON E C, SMITH G H. An entire functional mammary gland may comprise the progeny from a single cell[J].Development, 1998, 125(10): 1921-1930.
[6]OHLSTEIN B, KAI T, DECOTTO E, et al. The stem cell niche: Theme and variations[J].CurrOpinCellBiol, 2004, 16(6): 693-699.
[7]FARMER C, PALIN M F. Exogenous prolactin stimulates mammary development and alters expression of prolactin-related genes in prepubertal gilts[J].JAnimSci, 2005, 83(4): 825-832.
[8]BERNARD V, YOUNG J, CHANSON P, et al. New insights in prolactin: Pathological implications[J].NatRevEndocrinol, 2015, 11(5): 265-275.
[9]WU W, CHEN Y H, UEDA E, et al. Different forms of prolactin have opposing effects on the expression of cell cycle regulatory proteins in differentiated mammary epithelial cells[J].OncolRes, 2006, 16(2): 75-84.
[10]INMAN J L, ROBERTSON C, MOTT J D, et al. Mammary gland development: Cell fate specification, stem cells and the microenvironment[J].Development, 2015, 142(6): 1028-1042.
[11]李帅民. 荷斯坦奶牛乳腺来源干细胞的初步分离及鉴定[D].呼和浩特:内蒙古农业大学, 2014.
LI S M. Reliminary isolation and identification of stem cells from Holstein mammary[D]. Hohhot: Inner Mongolia Agricultural University, 2014. (in Chinese)
[12]李吉霞, 葛秀国, 刘新峰, 等. 乳腺干细胞自我更新相关信号通路研究进展[J]. 天津农学院学报, 2013, 20(1): 41-45.
LI J X, GE X G, LIU X F, et al. Progress on self-renewal signaling pathways of mammary stem cells[J].JournalofTianjinAgriculturalUniversity, 2013, 20(1): 41-45. (in Chinese)
[13]WOODWARD W A, CHEN M S, BEHBOD F, et al. On mammary stem cells[J].JCellSci,2005, 118(Pt 16): 3585-3594.
[14]STINGL J, EIREW P, RICKETSON I, et al. Purification and unique properties of mammary epithelial stem cells[J].Nature, 2006, 439(7079): 993-997.
[15]VAN KEYMEULEN A, ROCHA A S, OUSSET M, et al. Distinct stem cells contribute to mammary gland development and maintenance[J].Nature, 2011, 479(7372): 189-193.
[16]王飞. 人胚胎神经干细胞体外诱导分化及其分化相关基因表达的研究[D].苏州: 苏州大学, 2003.
WANG F. Study on the inducing differentiation and expression of genes associated with differentiation of human embryonic neural stem cellsinvitro[D]. Suzhou: Suzhou University, 2003. (in Chinese)
[17]BOLE-FEYSOT C, GOFFIN V, EDERY M, et al. Prolactin (PRL) and its receptor: Actions, signal transduction pathways and phenotypes observed in PRL receptor knockout mice[J].EndocrRev, 1998, 19(3): 225-268.
[18]TWOROGER S S, RICE M S, ROSNER B A, et al. Bioactive prolactin levels and risk of breast cancer: A nested case-control study[J].CancerEpidemiolBiomarkersPrev,2015, 24(1): 73-80.
[19]WALL E H, CRAWFORD H M, ELLIS S E, et al. Mammary response to exogenous prolactin or frequent milking during early lactation in dairy cows[J].JDairySci, 2006, 89(12): 4640-4648.
[20]LACASSE P, LOLLIVIER V, DESSAUGE F, et al. New developments on the galactopoietic role of prolactin in dairy ruminants[J].DomestAnimEndocrinol, 2012, 43(2): 154-160.
[21]朱孟芝,董雅娟, 龚宜超, 等.体外诱导牛骨髓间充质干细胞向乳腺样上皮细胞分化初步研究[J]. 中国畜牧兽医, 2012, 39(1): 92-96.
ZHU M Z, DONG Y J, GONG Y C, et al. Preliminary study on differentiation of bovine BMSC into mammary gland-like epithelial cellsinvitro[J].ChinaAnimalHusbandry&VeterinaryMedicine,2012, 39(1): 92-96. (in Chinese)
[22]BINART N, HELLOCO C, ORMANDY C J, et al. Rescue of preimplantatory egg development and embryo implantation in prolactin receptor-deficient mice after progesterone administration[J].Endocrinology,2000, 141(7): 2691-2697.
[23]田青, 王洪荣. 胰岛素、催乳素和氢化可的松对奶牛乳腺上皮细胞增殖和凋亡的影响[J]. 中国饲料, 2013(2): 8-12.
TIAN Q, WANG H R. Effects of insulin, prolactin and hydrocortisone on proliferation and apoptosis of mammary epithelial cells in dairy cows[J].ChinaFeed,2013(2): 8-12. (in Chinese)
[24]田青,王洪荣,王梦芝.氢化可的松对奶牛乳腺上皮细胞酪蛋白合成的影响[J].畜牧兽医学报,2014,45(10): 1663-1670.
TIAN Q, WANG H R,WANG M Z. Effects of HYD on the synthesis of casein in mammary epithelial cells of holstein cowsinvitro[J].ActaVeterinariaetZootechnicaSinica, 2014, 45(10): 1663-1670. (in Chinese)
[25]邢媛媛, 李大彪, 李红磊, 等. 催乳素对奶牛乳腺上皮细胞乳脂和乳蛋白合成相关基因表达的影响[J]. 动物营养学报, 2016, 28(8): 2439-2447.
XING Y Y, LI D B, LI H L, et al. Effects of prolactin on gene expressions involved in milk fat and milk protein synthesis in bovine mammary epithelial cells[J].ChineseJournalofAnimalNutrition, 2016, 28(8): 2439-2447. (in Chinese)
