胰高血糖素样肽-2对羔羊胃肠道重量、瘤胃发酵及小肠上皮发育相关基因表达的影响
2018-04-04刘理想孙大明毛胜勇刘军花
刘理想,孙大明,毛胜勇,刘军花
(南京农业大学消化道微生物研究室,南京 210095)
胰高血糖素样肽-2(Glucagon-like peptide-2,GLP-2)是由33个氨基酸组成,肠L内分泌细胞分泌的一种肠上皮特异性生长因子,其分泌受肠道营养素[1]和营养水平[2]的调控。GLP-2的功能包括促进肠道发育、增强肠道屏障功能、增加血液流量及抗炎症作用等[3],而其中最主要的功能就是特异性地促进肠黏膜生长与损伤后修复[4]。大量研究发现,GLP-2可通过抑制隐窝细胞凋亡、促进隐窝细胞增殖来增加绒毛高度和隐窝深度,从而刺激小肠上皮的生长和发育[5]。对断奶仔猪肠上皮细胞的研究发现,低剂量的二肽基肽酶Ⅳ能够促进GLP-2对细胞增殖、代谢和细胞完整性的作用效果[6]。
基于GLP-2在维持其他物种(人、猪、大鼠和小鼠等)肠道稳态中的重要作用,近年来人们开始重视GLP-2在反刍动物肠道发育中的作用。但相较人及单胃动物上的研究,GLP-2在反刍动物上的研究才刚刚起步。较早的研究发现,在代乳料和开食料中添加丁酸钠可以提高犊牛颈静脉血浆中GLP-2的浓度[7]。近年来有研究在奶牛所有胃肠道组织都检测到胰高血糖素GCG(GLP-2的前体物质)及GLP-2受体(GLP-2R),尤其在小肠细胞中高度表达,证实了在反刍动物胃肠道中同样存在GLP-2信号系统,同时也发现,日粮能量水平的增加可提高小肠GLP-2的分泌量,从而促进小肠的发育,并提高葡萄糖转运载体GLUT-2的表达量[8]。本实验室前期研究发现,皮下注射GLP-2可以促进犊牛小肠黏膜的生长及血液的流通[9]。近年来的研究结果也证实,GLP-2可作为药物通过改善小肠黏膜细胞自我更新来缓解犊牛腹泻[10]。最新研究进展表明,甜味素可以通过刺激GLP-2分泌从而促进犊牛小肠上皮的生长发育[11]。基于以上研究背景可以看出,GLP-2系统存在于反刍动物肠道中,并且其可促进其肠道发育,但其中所涉及的分子机制并不清楚。
单胃动物上的大量研究表明,GLP-2与小肠上皮的GLP-2R结合,刺激IGF-1的分泌,接着IGF-1结合IGF-1R,激活相应的信号通路,通过调节细胞周期蛋白和相应的蛋白激酶来加快细胞周期进程,促进细胞增殖[12]。反刍动物同样存在GLP-2系统,但其促进小肠发育的机制是否与单胃动物一致并不清楚。因此,本研究采用体外注射GLP-2试验,对羔羊小肠上皮Cyclins、CDKs、GCG、GLP-2R、IGF-1和IGF-1R mRNA表达进行研究。研究结果将对深入认识GLP-2调节羔羊小肠发育的分子机制具有重要意义。
1 材料与方法
1.1 试验设计与动物饲养
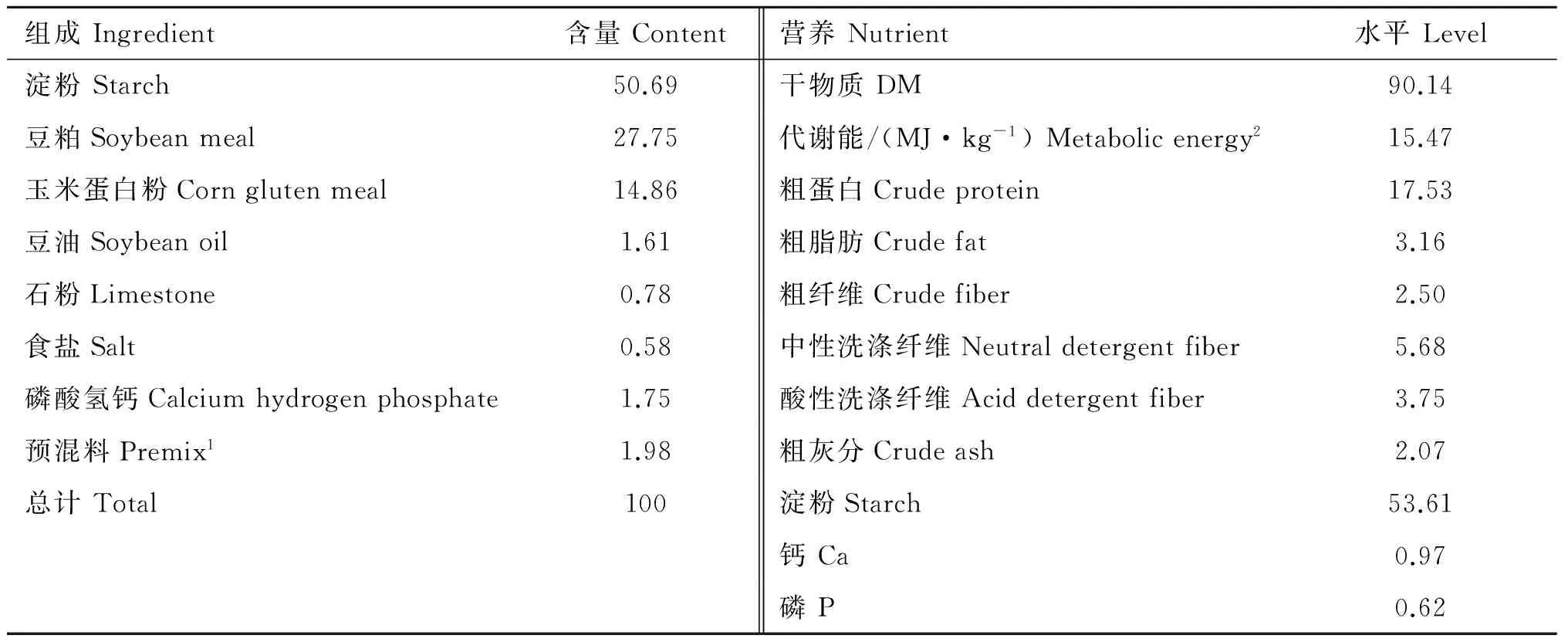
试验选择10只体况良好,胎次一致,体重相近的新生羔羊(湖羊),随机分为两组,每组5只。GLP-2组按50 μg·kg-1BW,每天分2次皮下注射GLP-2,间隔12 h, 连续注射14 d。对照组注射相应体积的0.5%牛血清白蛋白(BSA)生理盐水,注射时间同GLP-2组。牛血清白蛋白按1∶200的比例溶解在生理盐水中,配置成0.5%的BSA生理盐水溶液,GLP-2溶解于0.5%的BSA生理盐水溶液(0.4 mg·mL-1),现配现用。GLP-2由南京肽业生物科技有限公司合成,BSA购自南京建成生物有限公司。10日龄时,羔羊开始自由采食开食料、苜蓿(18.09%粗蛋白, 26.06%粗纤维)和燕麦草(10.05%粗蛋白, 28.71%粗纤维)。试验期间,自由哺乳和饮水,每周最后一天于晨饲开食料前称量羔羊体重。羔羊28日龄时,对照组和GLP-2组分别皮下注射BSA和GLP-2。试验开始前,两组羔羊的体重没有显著差异((6.18±0.47) kgvs. (5.80±0.26) kg,P=0.504)。试验开食料参考NRC(2007)[13]建议的绵羊羔羊饲养标准配制,开食料组成及营养水平见表1。
表1开食料组成与营养水平(干物质基础)
Table1Ingredientandnutrientlevelsofthestarterdiet(drymatterbasis)
%
1.每千克预混料提供:维生素A 500 000 IU,维生素D 50 000 IU,维生素E 2 000 IU,Fe 3.0 g,Zn 5.0 g,Cu 0.5 g,Mn 3.0 g,Co 0.1 g,I 50 mg,Se 40 mg;2.该数值是基于NRC(2007)[13]数据库的计算值
1. Per kg premix contains: vitamin A 500 000 IU, vitamin D 50 000 IU, vitamin E 2 000 IU, Fe 3.0 g, Zn 5.0 g, Cu 0.5 g, Mn 3.0 g, Co 0.1 g, I 50 mg, Se 40 mg;2. The value is analyzed based on database of the NRC (2007)[13]
1.2 样品采集
羔羊42日龄时,第一次注射2 h后进行屠宰,屠宰前用含40单位肝素钠的采血管采集颈静脉血,于4 ℃ 3 000 r·min-1离心15 min后收集血浆,之后将其储存在-20 ℃,待测血常规。屠宰后立即收集有代表性的瘤胃内容物(至少200 mL),四层无菌纱布过滤后立即测定pH,同时取过滤后的瘤胃液10 mL,分装于2个5 mL的离心管,-20 ℃保存,待测挥发性脂肪酸(VFA)浓度。屠宰后5 min之内,将消化道分离称量各器官重(瘤胃、瓣胃、十二指肠、空肠、回肠、盲肠、结肠),采集十二指肠、空肠及回肠组织在冰的磷酸盐缓冲溶液(PBS)里清洗3次,将其组织剪成0.5 cm × 0.5 cm的小碎块装在2 mL的冻存管里置于液氮中保存,用于后续RNA的提取。
1.3 羔羊瘤胃及血液生理参数测定
用便携式pH计 (HI 9024C; HANNA Instruments,美国) 当场测定瘤胃液pH。利用气相色谱仪 (GC-14B, 岛津, 日本; 毛细管柱: 30 m×0.32 mm×0.25 mm 膜厚度) 测定挥发性脂肪酸(VFA)浓度,具体步骤参照秦为琳[14]的方法(柱温为110 ℃,汽化室温度为180 ℃,检测器为180 ℃)。血浆葡萄糖浓度采用葡萄糖试剂盒(上海荣盛生物药业),利用葡萄糖氧化酶-过氧化物酶法测定。血浆GLP-2浓度根据GLP-2荧光酶免疫试剂盒(Phoenix Europe GmbH,德国)操作说明测定。血浆葡萄糖和GLP-2试剂盒的测量范围分别是 3.89~6.11 mmol·L-1和0~10 000 pg·mL-1。
1.4 羔羊小肠上皮RNA的提取和cDNA的合成
取100 mg小肠上皮组织置于研钵中,倒入液氮快速充分研磨,按照Trizol试剂(TaKaRa,日本)的使用说明提取小肠上皮组织总RNA。提取的总RNA使用Nano Drop分光光度计检测RNA的浓度和纯度。所有样品的吸收比例(OD260 nm/OD280 nm)都为1.8~2.0,证明RNA纯度较高。用1.4%的琼脂糖胶检测RNA的完整性。将所有RNA浓度调整到1 μg·μL-1,置于-80 ℃冰箱保存备用。用含基因组RNA酶的反转录试剂盒(PrismScript RT reagent kit with gDNA Eraser(TaKaRa,日本))进行cDNA的合成。
1.5 引物的合成和实时定量PCR
利用Q5 Real-time PCR仪(Applied Biosystems,美国)对目的基因及内参基因GAPDH进行定量,GAPDH引物序列参照文献[15],实时定量PCR分析所用引物采用Primer 5.0软件设计,由上海捷瑞生物工程有限公司合成,引物序列见表2。用SYBR® Premix ExTaqTM(TaKaRa,日本)试剂盒进行定量。反应条件:95 ℃ 预变性30 s;95 ℃ 5 s,60 ℃ 30 s,40个循环;95 ℃,15 s;60 ℃ 1 min;95 ℃,15 s。反应体积20 μL:10 μL SYBR Premix ExTaq,0.4 μL ROX Reference Dye II, 10 μmol·L-1上下游引物各0.4 μL,2 μL样品cDNA,6.8 μL无菌水。所有样品设3个重复。目的基因的相对表达量以管家基因GAPDH作为内参进行校正,数据分析采用2-△△CT的方法。
表2本研究中所用引物序列
Table2Sequencesofprimerusedinthisstudy

基因名称Genename基因IDGeneID引物序列(5'→3')Primersequence产物/bpProductsizeGCGNW_011943216.1F:CGGAAGAAGTCAACATCGTR:TAAAGTCTCGGGTAGCAAG119GLP-2RXM_004013306F:GGCCTACAGATACTGCCTGTCTR:GATGTAGTTACGTGTGCAGTGGA244IGF-1NM_001009774.3F:GCTCTCAACATCTCCCATCTCCR:CCCATTGCTTCTGAAGTGCAAA94IGF-1RNC_019475.2F:AGAAGATCACCATGAGCCGCR:TCACCGTCTTAATGGCCACC120CyclinANC_019478.2F:CTCTCCTATCACCGCCTGACR:CTTTGGGGTCCAAGTTCTGC144CyclinB1NM_001045872.1F:AGCGGATCCAAACCTTTGTAGTGR:CAATGAGGATGGCTCTCATGTTTC137CyclinD1NC_019478.2F:CCTGCCGTCCATGCGGAAR:GAACTTCACATCTGTGGCAC403CyclinEXM_015100542F:TGGCACCGATGTCTCTGTTCR:CCACACTGGCTTCTCACAGT114CDK1NM_174016.2F:CCAATAATGAAGTGTGGCCAGAAGR:AGAAATTCGTTTGGCAGGATCATAG164

(转下页 Carried forward)
1.6 数据处理
结果以“平均值±标准误(means±SE)”表示。数据采用SPSS 20.0中的独立样本t检验进行显著性分析。采用GraphPad Prism 6.01 (www.graphpad.com) 软件分析目的基因的mRNA表达量。P<0.05表示差异显著。
2 结 果
2.1 注射GLP-2对羔羊体重的影响
如图1所示,与对照组相比,GLP-2组羔羊出生重(P=0.947)、7日龄重(P=0.809)、14日龄重(P=0.845)、21日龄重(P=0.704)、28日龄重(P=0.504)、35日龄重(P=0.306)和42日龄重(P=0.224)无显著变化。
2.2 GLP-2对羔羊器官重量的影响
如表3所示,与对照组羔羊相比,GLP-2组羔羊空肠重(P=0.083)和回肠重(P=0.060)有升高的趋势,而瘤胃湿重(P=0.906)、瘤胃干重(P=0.585)、瓣胃湿重(P=0.804)、瓣胃干重(P=0.464)、十二指肠重(P=0.272)、盲肠重(P=0.540)及结肠重(P=0.295)无显著变化。
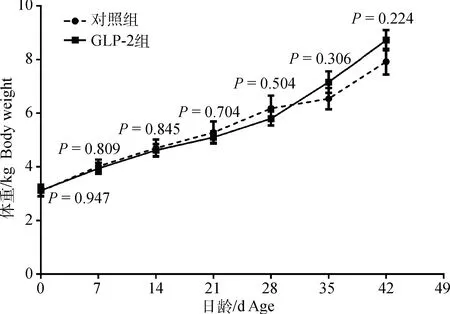
图1 注射GLP-2对羔羊体重的影响Fig.1 The effect of GLP-2 injection on body weight of lambs
表3注射GLP-2对羔羊器官重量的影响(n=5)
Table3EffectsofGLP-2injectiononorganweightoflambs(n=5)

项目Item对照组ControlgroupGLP-2组GLP-2groupP值P-value瘤胃湿重/kgWetweightofrumen0.81±0.040.80±0.030.906瘤胃干重/gDryweightofrumen130.80±9.69138.80±10.170.585瓣胃湿重/gWetweightofomasum15.05±2.2116.32±4.410.804瓣胃干重/gDryweightofomasum8.80±2.0210.85±1.720.464十二指肠重/gDuodenumweight11.15±1.6313.61±1.300.272空肠重/gJejunumweight170.20±13.87215.20±17.970.083回肠重/gIleumweight287.40±13.26330.60±14.620.060盲肠重/gCecumweight52.45±10.8961.00±7.730.540结肠重/gColonweight141.40±8.75174.00±27.720.295
湿重. 屠宰分离器官后直接称重;干重. 去除内容物后称重
The wet weight of organs are directly weighed after separation of the organs; The dry weight of organs are weighed after removing the contents
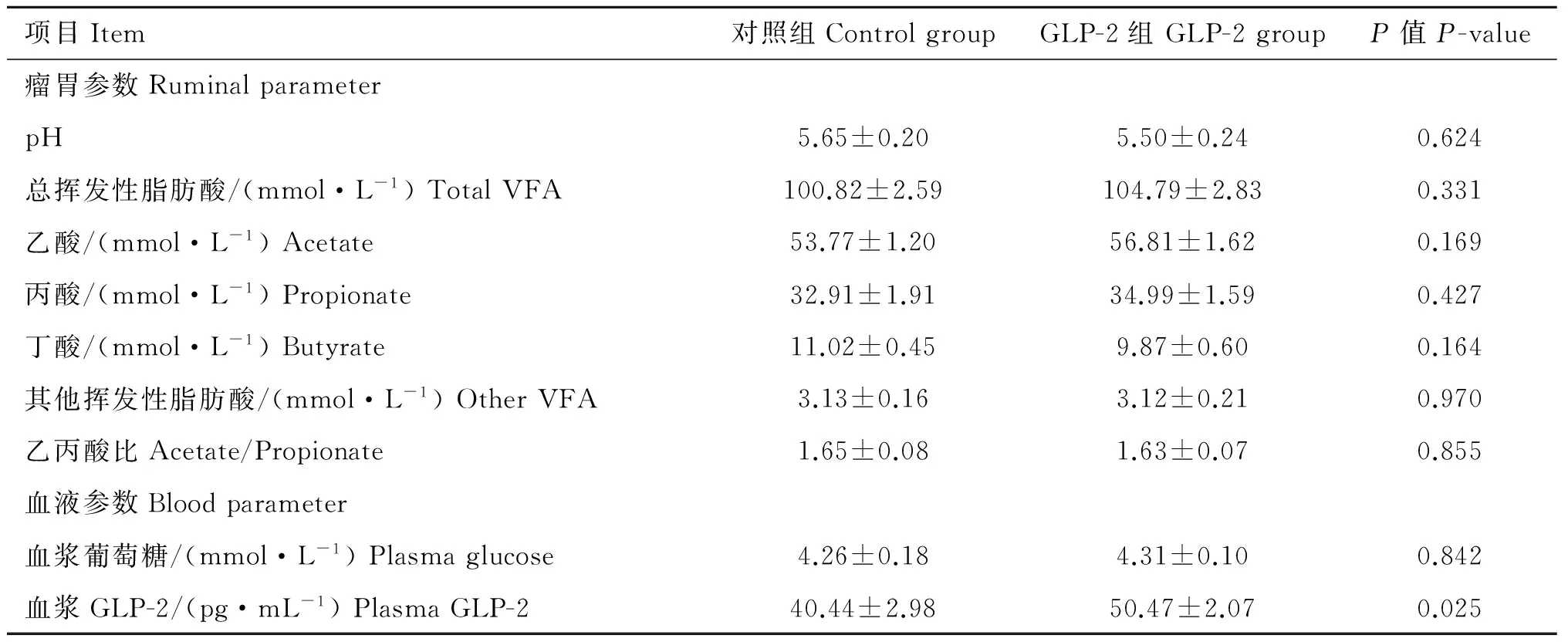
2.3 注射GLP-2对羔羊瘤胃和血液参数的影响
如表4所示,与对照组羔羊相比,GLP-2组羔羊显著升高了血浆GLP-2浓度(P=0.025);GLP-2组羔羊瘤胃pH(P=0.624)、总VFA浓度(P=0.331)、乙酸浓度(P=0.169)、丙酸浓度(P=0.427)、丁酸浓度(P=0.164)、其他VFA浓度(P=0.970)、乙丙酸比(P=0.855)及血浆葡萄糖浓度(P=0.842)相对于对照组没有显著变化。
表4注射GLP-2对羔羊瘤胃发酵和血液参数的影响(n=5)
Table4EffectsofGLP-2injectiononrumenfermentationandbloodparametersoflambs(n=5)
项目Item对照组ControlgroupGLP-2组GLP-2groupP值P-value瘤胃参数RuminalparameterpH5.65±0.205.50±0.240.624总挥发性脂肪酸/(mmol·L-1)TotalVFA100.82±2.59104.79±2.830.331乙酸/(mmol·L-1)Acetate53.77±1.2056.81±1.620.169丙酸/(mmol·L-1)Propionate32.91±1.9134.99±1.590.427丁酸/(mmol·L-1)Butyrate11.02±0.459.87±0.600.164其他挥发性脂肪酸/(mmol·L-1)OtherVFA3.13±0.163.12±0.210.970乙丙酸比Acetate/Propionate1.65±0.081.63±0.070.855血液参数Bloodparameter血浆葡萄糖/(mmol·L-1)Plasmaglucose4.26±0.184.31±0.100.842血浆GLP-2/(pg·mL-1)PlasmaGLP-240.44±2.9850.47±2.070.025
其他挥发性脂肪酸=异丁酸+戊酸+异戊酸
Other VFA=Isobutyrate + Valerate + Isovalerate
2.4 注射GLP-2对羔羊小肠上皮周期蛋白mRNA表达的影响
如图2A所示,与对照组相比,GLP-2注射显著升高了十二指肠上皮CyclinB1(P=0.001)、CyclinD1(P=0.044)、CDK1(P=0.028)及CDK6(P=0.016)的mRNA表达,而CyclinA、CyclinE1、CDK2和CDK4的mRNA表达没有显著变化(P>0.05);GLP-2组空肠上皮CyclinA(P=0.028)、CyclinB1(P=0.016)、CDK1(P=0.013)、CDK4(P=0.023)和CDK6(P=0.028)mRNA表达显著高于对照组,而CyclinD1、CyclinE1、CDK2的mRNA表达没有显著变化(P>0.05);GLP-2注射显著升高了回肠上皮CyclinA(P=0.025)、CyclinD1(P=0.001)、CDK2(P=0.013)、CDK4(P=0.020)的mRNA表达,而CyclinB1、CyclinE1、CDK1及CDK6的mRNA表达没有显著变化(P>0.05)。
2.5 注射GLP-2对羔羊小肠上皮GCG、GLP-2R、IGF-1及IGF-1R mRNA表达的影响
如图2B所示,与对照组相比,GLP-2注射显著升高了十二指肠上皮GCG(P=0.036)和IGF-1R(P=0.031),空肠上皮GCG(P=0.049)、IGF-1(P=0.027)、IGF-1R(P=0.036)和GLP-2R(P=0.011),回肠上皮GCG(P=0.025)、IGF-1(P=0.029)、IGF-1R(P=0.029)及GLP-2R(P=0.032)的mRNA表达;但对十二指肠上皮IGF-1(P=0.712)和GLP-2R(P=0.227)的mRNA表达没有显著影响。
3 讨 论
本研究发现,皮下注射GLP-2并没有影响羔羊的体重,与C.C.Taylor-Edwards等[9]在犊牛上的研究结果一致。这可能是由于试验动物采食相同的日粮,能量摄入相同导致的。但相对于注射前,注射GLP-2后羔羊体重增加加快,一方面可能是由于GLP-2的作用,另一方面可能是受日龄增长的影响。本研究发现,GLP-2并没有影响羔羊除小肠以外其他胃肠道的重量。C.C.Taylor-Edwards等[8]在牛前胃组织中检测到GCG和GLP-2R mRNA的表达较低,但在小肠组织中表达较高。皮下注射GLP-2可能会使GLP-2经过血液循环到达瘤胃,但由于瘤胃上皮缺乏GLP-2R的介导,无法启动相应的下游通路,因此没有影响羔羊瘤胃发育。同时发现,GLP-2注射也没有显著影响羔羊瘤胃发酵,这可能与两组羔羊采食相同的日粮有关。本研究中一个有趣的发现是,GLP-2注射对羔羊空肠和回肠重量有增加的趋势,这与在非反刍动物中的发现类似[16]。这种增加可能是由于小肠隐窝细胞的增殖导致绒毛高度、隐窝深度和黏膜层的增加。GLP-2诱导小肠黏膜生长在非反刍动物中已有很多依据[17],而在反刍动物中的研究相对较少。
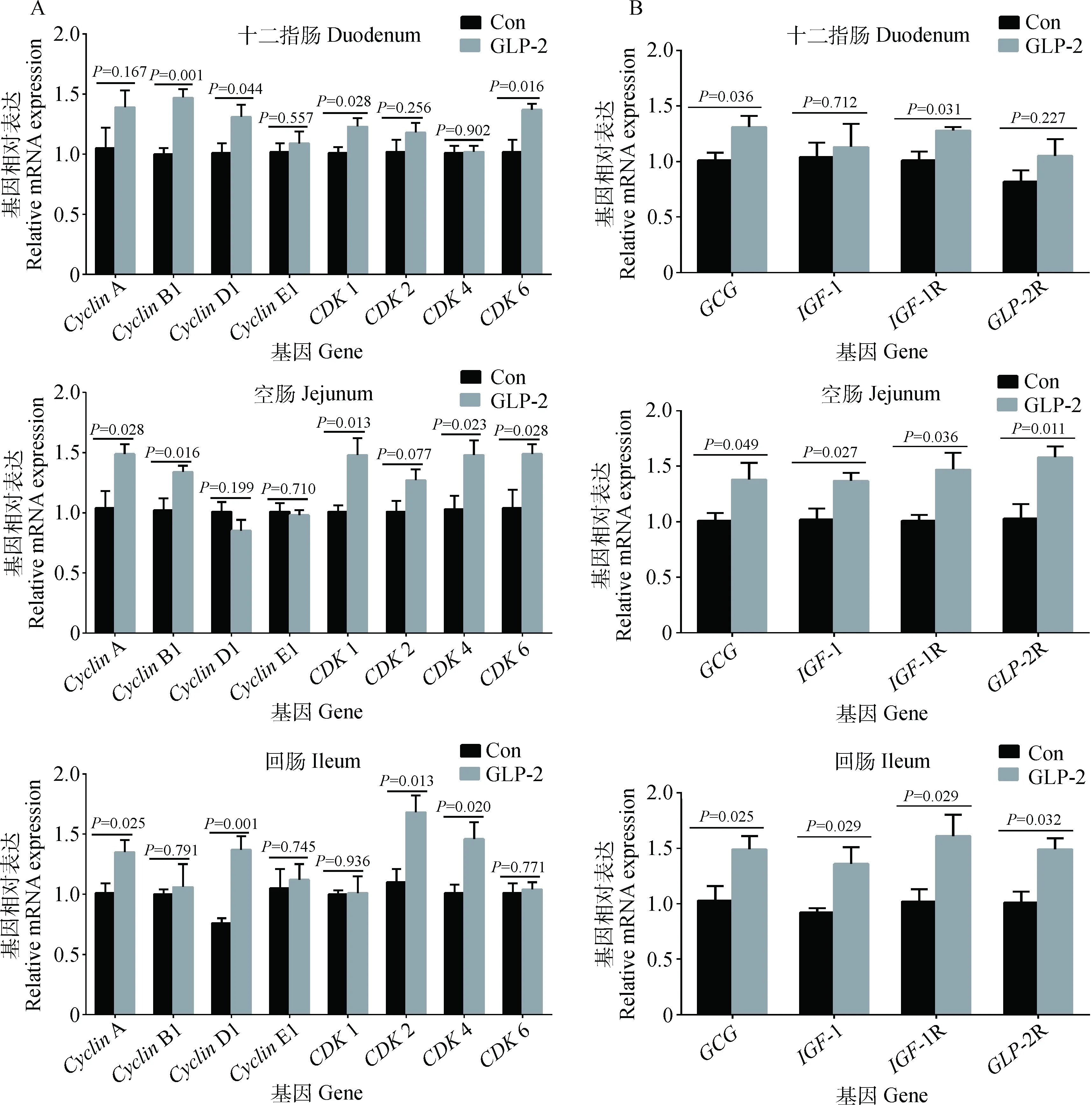
图2 注射GLP-2对羔羊小肠上皮细胞周期蛋白和GCG、GLP-2R、IGF-1和IGF-1R mRNA表达的影响Fig.2 The effect of GLP-2 injection on mRNA expression of small intestinal epithelial cell cycle proteins and GCG, GLP-2R, IGF-1, IGF-1R of lambs
基于上述结果,本研究发现GLP-2注射对羔羊小肠重量有增加的趋势,接下来,我们将进一步研究GLP-2促进羔羊小肠发育的分子机制。单胃动物上的许多研究表明,GLP-2具有促进肠黏膜生长发育,肠上皮隐窝细胞增殖的作用[18-19],而小肠上皮细胞增殖又与细胞周期的变化密切相关。细胞周期的推进主要受细胞周期蛋白(Cyclins)及其相关激酶(Cyclin dependent protein kinases, CDKs)的调控。细胞周期包括静止期(G0期)、分裂间期(G1期、S期和G2期)和有丝分裂期(M期)[20]。研究发现,CyclinD1与CDK4或CDK6形成的复合物对于G1阶段至关重要[21],而G1阶段是真核生物细胞分裂周期中的关键步骤。本试验中,GLP-2处理显著升高了十二指肠上皮CyclinD1、CDK6的mRNA表达水平,空肠上皮CDK4及CDK6的mRNA表达水平和回肠上皮CyclinD1、CDK4的mRNA表达水平。这可能是由于注射GLP-2上调了小肠上皮CyclinD1、CDK4和CDK6的基因表达,使细胞周期G1期持续时间缩短,从而推进细胞周期进程,促进肠上皮细胞增殖。CyclinA在S和G2/M阶段扮演着重要角色[22]。在S期,CyclinA-CDK2复合物通过关键DNA复制因子的磷酸化驱动染色体复制[23]。本研究中,GLP-2注射促使空肠上皮CyclinA和回肠上皮CyclinA、CDK2基因表达上调,这可能是GLP-2促进了细胞周期过程中DNA复制。注射GLP-2使十二指肠上皮和空肠上皮CyclinB1和CDK1基因表达上调。据报道,哺乳动物CyclinB1-CDK1复合物在G2后期发挥着重要作用[24]。CyclinE1-CDK2可以促进细胞周期由G1期进入S期[25],但本试验中两组小肠上皮的CyclinE1 mRNA的表达水平并没有显著差异。在一定程度上,小肠上皮细胞周期基因mRNA表达变化并不能完全反映细胞周期进程变化。因此认为,CyclinA、CyclinB1、CyclinD1、CDK1、CDK4和CDK6是与肠道发育相关的重要基因。GLP-2可能通过上调这些基因的表达,加速细胞周期进程,促进小肠的发育。
GLP-2的生物活性不仅与分泌量有关,也与血液中活性GLP-2的比例有关。本研究发现,体外注射GLP-2,升高了血浆GLP-2浓度,这表明体外注射GLP-2可能诱导了羔羊自身GLP-2的分泌。此外,外源GLP-2注射可提高羔羊小肠上皮GCG、GLP-2R的mRNA表达量,表明外源注射的GLP-2可能通过血液循环到达小肠,激活小肠GLP-2前体物质(GCG)及其受体(GLP-2R)的表达。对小鼠的研究表明,GLP-2R主要在肠道的皮下肌成纤维细胞而非隐窝细胞表达[26],这就暗示,GLP-2促进肠道隐窝细胞增殖可能需要其他生长因子的介导。之后一系列的研究结果也进一步证实了以上假说。当敲除小鼠的IGF-1R基因后,GLP-2促进小肠隐窝细胞生长的作用被完全消除[27]。皮下肌成纤维细胞体外培养试验也发现,在培养基中添加GLP-2使得IGF-1的分泌量显著增加[28]。以上结果证实,GLP-2刺激小肠隐窝细胞的增殖需要通过IGF-1介导[3]。本研究发现,注射GLP-2使羔羊十二指肠上皮IGF-1R,空肠和回肠上皮IGF-1、IGF-1R的mRNA表达上调。这可能是当GLP-2与GLP-2R结合后,促进了羔羊小肠上皮IGF-1的表达和分泌,这和P.E.Dube等[27]的研究结果一致。J.Jasleen等[29]报道,在体外试验中,GLP-2处理肠上皮细胞系可以促进细胞周期蛋白A和D1的表达。E.E.Connor等[30]发现,牛的小肠中细胞周期蛋白D1和GLP-2R的表达呈正相关。许多研究证实,IGF-1能够诱发CyclinD1表达的上调,之后与相应的细胞周期依赖蛋白激酶CDK4和CDK6形成复合物而启动细胞增殖[31-32]。但是,IGF-1与IGF-1R结合后,必须通过相关的信号转导途径将细胞外信号转导至细胞内,才能发挥其调节细胞周期的功能。外源GLP-2注射导致羔羊小肠上皮IGF-1及IGF-1R表达上调,并且与小肠上皮细胞周期蛋白表达变化一致。这一结果暗示,GLP-2调节羔羊小肠上皮细胞周期的作用可能与IGF-1信号通路存在一定关联。研究结果将对深入认识GLP-2调节羔羊小肠发育的分子机制具有重要意义。
4 结 论
皮下注射GLP-2对羔羊体重、胃肠道各器官重量和瘤胃内环境都没有显著影响,但空肠重和回肠重有增加的趋势,同时,升高了血浆中GLP-2浓度,促进了小肠上皮发育相关基因的表达。本研究结果表明,外源注射GLP-2可促进羔羊的小肠发育。
参考文献(References):
[1]FENG Y, DEMEHRI F R, XIAO W, et al. Interdependency of EGF and GLP-2 signaling in attenuating mucosal atrophy in a mouse model of parenteral nutrition[J].CellMolGastroenterolHepatol, 2017, 3(3): 447-468.
[2]CASTRO J J, MORRISON S Y, HOSSEINNI A, et al. Secretion of glucagon-like peptide-2 responds to nutrient intake but not glucose provision in milk-fed calves[J].JDairySci, 2016, 99(7): 5793-5807.
[3]DUBÉ P E, BRUBAKER P L. Frontiers in glucagon-like peptide-2: multiple actions, multiple mediators[J].AmJPhysiolEndocrinolMetab, 2007, 293(2): E460-E465.
[4]KVIDERA S K, HORST E A, SANZ FERNANDEZ M V, et al. Characterizing effects of feed restriction and glucagon-like peptide 2 administration on biomarkers of inflammation and intestinal morphology[J].JDairySci, 2017, 100(11): 9402-9417.
[5]方媛媛. 胰高血糖素样肽-2与脓毒症肠道的保护[J]. 海南医学, 2017, 28(3): 456-458.
FANG Y Y. Gut protection of glucagon like peptide-2 for sepsis[J].HainanMedicalJournal, 2017, 28(3): 456-458. (in Chinese)
[6]贾刚, 邓秋红, 蒋荣川, 等. 胰高血糖素样肽-2和二肽基肽酶Ⅳ抑制剂联合使用对断奶仔猪肠上皮细胞的影响[J]. 畜牧兽医学报, 2017, 48(1): 99-107.
JIA G, DENG Q H, JIANG R C, et al. Effects of the combination of Glucagon-like peptide-2 and Dipeptidyl Peptidase-IV inhibitors on intestinal epithelial cells of weaned pigletsinvitro[J].ActaVeterinariaetZootechnicaSinica, 2017, 48(1): 99-107.(in Chinese)
[7]GORKA P, KOEALSKI Z M, PIETRZAK P, et al. Effect of sodium butyrate supplementation in milk replacer and starter diet on rumen development in calves[J].JPhysiolPharmacol, 2009, 60(S3): 47-53.
[8]TAYLOR-EDWARDS C C, BURRIN D G, MATTHEWS J C, et al. Expression of mRNA for proglucagon and glucagon-like peptide-2 (GLP-2) receptor in the ruminant gastrointestinal tract and the influence of energy intake[J].DomestAnimEndocrinol, 2010, 39(3): 181-193.
[9]TAYLOR-EDWARDS C C, BURRIN D G, HOLST J J, et al. Glucagon-like peptide-2 (GLP-2) increases small intestinal blood flow and mucosal growth in ruminating calves[J].JDairySci, 2011, 94(2): 888-898.
[10]CONNOR E E, KAHL S, ELSASSER T H, et al. Glucagon-like peptide 2 therapy reduces negative effects of diarrhea on calf gut[J].JDairySci, 2013, 96(3): 1793-1802.
[11]MORAN A W, AL-RAMMAHI M, ZHANG C, et al. Sweet taste receptor expression in ruminant intestine and its activation by artificial sweeteners to regulate glucose absorption[J].JDairySci, 2014, 97(8): 4955-4972.
[12]DRUCKER D J, YUSTA B. Physiology and pharmacology of the enteroendocrine hormone glucagon-like peptide-2[J].AnnuRevPhysiol, 2014, 76(76):561-583.
[13]NRC. Nutrient requirements of small ruminants: sheep, goats, cervids and new world camelids[M]. Washington, D. C: National Academy press, 2007.
[14]秦为琳. 应用气相色谱测定瘤胃挥发性脂肪酸方法的研究改进[J]. 南京农学院学报, 1982, 5(4): 110-116.
QIN W L. Determination of rumen volatile fatty acids by means of gas chromatography[J].JournalofNanjingAgriculturalCollege, 1982, 5(4): 110-116.(in Chinese)
[15]WANG A, GU Z, HEID B, et al. Identification and characterization of the bovine G protein-coupled receptor GPR41 and GPR43 genes[J].JDairySci, 2009, 92(6): 2696-2705.
[16]TSAI C H, HILL M, ASA S L, et al. Intestinal growth-promoting properties of glucagon-like peptide-2 in mice[J].AmJPhysiol, 1997, 273(1):E77-E84.
[17]LEI Q C, BI J C, WANG X Y, et al. GLP-2 prevents intestinal mucosal atrophy and improves tissue antioxidant capacity in a mouse model of total parenteral nutrition[J].Nutrients, 2016, 8(1):33.
[18]BURRIN D G, STOLL B, GUAN X F, et al. Glucagon-like peptide 2 dose-dependently activates intestinal cell survival and proliferation in neonatal piglets[J].Endocrinology, 2005, 146(1):22-32.
[19]GHATEI M A, GOODLAD R A, TAHERI S, et al. Proglucagon-derived peptides in intestinal epithelial proliferation[J].DigDisSci, 2001, 46(6):1255-1263.
[20]YANO S, TAKEHARA K, TAZAWA H, et al. Cell-cycle-dependent drug-resistant quiescent cancer cells induce tumor angiogenesis after chemotherapy as visualized by real-time FUCCI imaging[J].CellCycle, 2017, 16(5):406-414.
[21]NARASIMHA A M, KAULICH M, SHAPIRO G S, et al. Cyclin D activates the Rb tumor suppressor by mono-phosphorylation[J].Elife, 2014, 3(3): e02872.
[22]LEE H J, JEDRYCHOWSKI M P, VINAYAGAM A, et al. Proteomic and metabolomic characterization of a mammalian cellular transition from quiescence to proliferation[J].CellRep, 2017, 20(3):721-736.
[23]KANAKKANTHARA A, JEGANATHAN K B, LIMZERWALA J F, et al. Cyclin A2 is an RNA binding protein that controlsMre11 mRNA translation[J].Science, 2016, 353(6307): 1549-1552.
[24]LINDQVIST A, VAN ZON W, KARLSSON R C, et al. Cyclin B1-Cdk1 activation continues after centrosome separation to control mitotic progression[J].PLoSBiol, 2007, 5(5): e123.
[25]BARR A R, HELDT F S, ZHANG T L, et al. A dynamical framework for the all-or-none G1/S transition[J].CellSyst, 2016, 2(1): 27-37.
[26]ØRSKOV C, HARTMANN B, POULSEN S S, et al. GLP-2 stimulates colonic growth via KGF, released by subepithelial myofibroblasts with GLP-2 receptors[J].RegulPept, 2005, 124(1-3):105-112.
[27]DUBE P E, FORSE C L, BAHRAMI J, et al. The essential role of insulin-like growth factor-1 in the intestinal tropic effects of glucagon-like peptide-2 in mice[J].Gastroenterology, 2006, 131(2): 589-605.
[28]LEEN J L, IZZO A, UPADHYAY C, et al. Mechanism of action of glucagon-like peptide-2 to increase IGF-I mRNA in intestinal subepithelial fibroblasts[J].Endocrinology, 2011, 152(2):436-446.
[29]JASLEEN J, ASHLEY S W, SHIMODA N, et al. Glucagon-like peptide 2 stimulates intestinal epithelial proliferationinvitro[J].DigDisSci, 2002, 47(5): 1135-1140.
[30]CONNOR E E, BALDWIN R L Ⅵ, CAPUCO A V, et al. Characterization of glucagon-like peptide 2 pathway member expression in bovine gastrointestinal tract[J].JDairySci, 2010, 93(11): 5167-5178.
[31]NEW D C, WONG Y H. Molecular mechanisms mediating the G protein-coupled receptor regulation of cell cycle progression[J].JMolSignal, 2007, 2:2.
[32]卢劲晔. 日粮能量水平对山羊瘤胃上皮生长的影响及机理研究[D]. 南京:南京农业大学, 2012.
LU J Y. Effects of dietary energy intake on growth of rumen epithelium and its underlying mechanism in goats [D]. Nanjing: Nanjing Agricultural University, 2012.(in Chinese)
