捻转血矛线虫脂肪酶基因表达与生物学特性分析
2018-04-04周丽娜胡孟娟李祥瑞徐立新宋小凯严若峰
周丽娜,胡孟娟,孙 伟,李祥瑞,徐立新,宋小凯,严若峰
(南京农业大学动物医学院,南京 210095)
捻转血矛线虫(Haemonchuscontortus)为毛圆科血矛属线虫,是反刍兽常见的胃肠道寄生性线虫,该寄生虫长期寄生于反刍动物皱胃黏膜,吸食宿主血液[1],造成感染动物胃肠组织受到严重破坏,患畜表现严重贫血、衰弱,甚至死亡[2],这给我国畜牧业发展带来很大经济损失[3-4]。
目前,对该病的防控仍停留在化药驱杀阶段,然而,耐药性虫株的产生已严重影响药物效力[5],这迫使人们尝试探究免疫学方法防治该病,因此,发掘新的具有强免疫原性或发育调节作用的潜在靶标是发展更有效防治该病方法的前提。
本实验室孙伟博士[6]和其他研究者[7]的报道显示,捻转血矛线虫脂肪酶(Lipase)是一类催化合成和分解长链脂肪酸酯的酶,与捻转血矛线虫发育调节相关,且其前18个氨基酸是信号肽区域,这预示Lipase为分泌型蛋白。据报道,一些分泌型蛋白酶、脂肪酶和C类凝集素同系物与捻转血矛线虫感染和调节宿主免疫应答密切相关[8]。本文对脂肪酶进行了克隆表达及相关生物学特性研究,以期为捻转血矛线虫病的防治提供新靶标。
1 材料与方法
1.1 试验材料
1.1.1试验动物和虫体健康山羊,购自南京某山羊养殖场;雌性标重清洁大鼠,购自扬州大学实验动物中心;捻转血矛线虫三期幼虫由本实验室保存。山羊经人工感染捻转血矛线虫第三期幼虫,21 d后收集粪便,一方面进行孵化得到新的三期幼虫,另一方面利用食盐水密度梯度法收集虫卵,感染35 d后剖杀,从其皱胃挑取并收集成虫。
1.1.2主要试验试剂TRIzol®Reagent试剂购自Invitrogen公司;Total RNA Kit Ⅰ购自大连宝生物工程有限公司;脂肪酶(Lipase)活性试剂盒、Cy3标记山羊抗大鼠IgG(H+L)、DAPI染色液购自碧云天公司;HiScriptTMQ RT SuperMix for qPCR (+gDNA wiper)试剂盒、AceQ®qPCR SYBR®Green Master Mix试剂盒购自南京诺唯赞公司。
1.2 试验方法
1.2.1PCR新鲜捻转血矛线虫成虫10条左右,加入1 mL TRIzol低温充分研磨虫体,按Inviotrgen TRIZOL说明书步骤依次操作,提取RNA,然后按照说明书进行反转录,合成cDNA。
依据捻转血矛线虫lipase基因序列(GenBank登录号HQ44439.1),显示ORF序列全长918 bp,共编码305个氨基酸,并进行蛋白质预测分析。去除信号肽,用Primer 5.0软件设计引物,P1:5′-CGGAATTCTATTCAGACTCGTTGGCGAGG-3′;P2:5′-CGAGCTCTCA-TTCGGGCATTACCTCAAA-3′。EcoRⅠ和SacⅠ分别为上下游引物酶切位点,引物由通用生物公司合成。
以成虫cDNA为模板,以上序列为引物进行PCR扩增,1%琼脂糖凝胶电泳检测PCR产物。
1.2.2Lipase基因的克隆扩大PCR反应体系并回收产物,连接克隆载体pMD-19T,转化连接产物至大肠杆菌DH5α感受态中,挑单克隆,提取质粒,并双酶切鉴定,阳性克隆送至通用生物公司测序,测序结果显示正确者命名为pMD-19T-Lipase,并应用DNAStar软件翻译扩增出的实际序列,NCBI在线比对,应用MEGA6完成进化树分析。
1.2.3原核表达载体的构建同时双酶切pMD-19T-Lipase阳性质粒和pET-32a(+)表达载体,回收目的片段,连接重组质粒并转化至大肠杆菌BL21感受态中,挑单克隆,提取质粒,双酶切鉴定并选取阳性测序,测序显示正确者为pET-32a(+)-Lipase。
1.2.4表达产物的分析和融合蛋白的获得选取构建成功的重组菌接种于含氨苄霉素(工作浓度为50 μg·mL-1)的LB液体培养基中,37 ℃振荡培养,采用IPTG(工作浓度0.1 mmoL·L-1)诱导表达,确定表达峰值时间。
扩大体系同上操作,诱导培养至表达峰值,收集诱导后菌体,超声破碎,将上清和包涵体进行SDS-PAGE,确定表达产物的分布情况。
参照说明书使用His蛋白纯化柱对表达产物进行纯化,将纯化好的蛋白质于含梯度尿素的复性缓冲液进行复性,得到融合蛋白质,根据说明书测定蛋白质浓度,除菌分装,于-70 ℃冻存。
1.2.5抗血清的制备取两只SD大鼠,200 μg融合蛋白质与等量的弗氏完全佐剂充分乳化,首次免疫;两周后等量蛋白质加等体积弗氏不完全佐剂充分乳化,再次免疫大鼠;每间隔一周进行三免和四免,与二免相同;四免一周后眼眶下静脉采血,分离血清并分装,-20 ℃保存备用。纯化的32a蛋白进行相同操作,采血作为阴性对照。
1.2.6融合蛋白质的抗原特性分析取适量融合蛋白质进行SDS-PAGE电泳后,进行转印,将蛋白质转印至硝酸纤维膜上;5%脱脂奶粉封闭过夜;TBST清洗多次,以感染捻转血矛线虫山羊的血清作为一抗(1∶100稀释),未感染山羊的血清作为阴性对照,37 ℃孵育1 h;TBST清洗膜数次,以兔抗山羊IgG-HRP作为二抗(1∶5 000稀释),37 ℃避光孵育1 h;TBST清洗膜数次,最后DAB避光显色,拍照。
1.2.7融合蛋白质酶活性检测Lipase又称甘油酯水解酶,根据脂肪酶活性检测试剂盒说明书分别在不同温度和pH值下进行以下反应:

倍比稀释试剂盒中底物,分别进行等量酶活测定,并在0、1、2、3、4 min时分别测定吸光值,建立底物浓度和最大反应速度关系,计算该脂肪酶米氏常数。
1.2.8Lipase阶段性表达量分析将捻转血矛线虫的虫卵、L3、雌虫、雄虫分别用Trizol法提取RNA(虫卵用Total RNA Kit I试剂盒),并反转录得到cDNA,即可利用前期验证合适的引物(内参基因和目的基因扩增Ct差值与模板浓度回归线斜率绝对值<0.1)进行△△Ct方法[9]检测lipase基因在该病原体各阶段的表达量。
根据捻转血矛线虫lipase基因和β-tubulin基因序列设计用于实时定量PCR的引物。送英潍捷基(上海)有限公司设计合成(表1)。
表1RT-PCR用引物
Table1TheprimersofRT-PCR
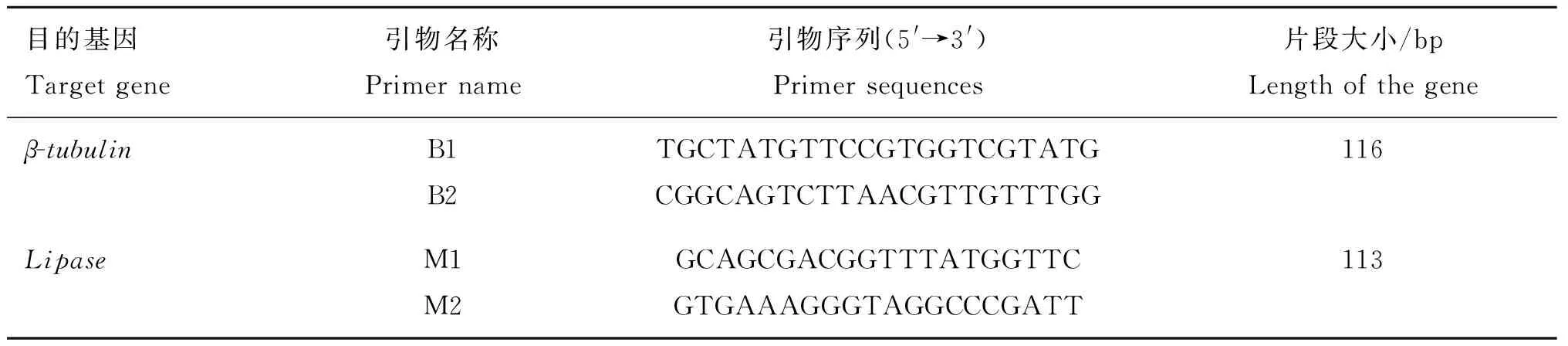
目的基因Targetgene引物名称Primername引物序列(5'→3')Primersequences片段大小/bpLengthofthegeneβ-tubulinB1B2TGCTATGTTCCGTGGTCGTATGCGGCAGTCTTAACGTTGTTTGG116LipaseM1M2GCAGCGACGGTTTATGGTTCGTGAAAGGGTAGGCCCGATT113
用已验证合适的引物分别扩增捻转血矛线虫雌虫、雄虫、三期幼虫和虫卵β-tublin和lipase基因,记录每次Ct平均值及RQ值,应用SPSS软件分析数据,用GraphPad软件作图。
1.2.9融合蛋白质的组织定位将收集的成虫取出,PBS冲洗干净,雌雄分开,晾干后进行包埋,切片(一般片厚10 μm),切下后快速贴合于预处理的防脱载玻片上,-20 ℃冰箱保存备用。
常温下放置冰冻切片30 min,4 ℃预冷的丙酮固定10 min,然后干燥静置;TBST清洗4次,用5%BSA封闭,4 ℃过夜;TBST清洗数次,以抗原蛋白质免疫的大鼠血清为一抗(1∶100稀释),对照组加等量同稀释倍数的空白大鼠血清,37 ℃孵育1 h;TBST清洗数次,以Cy3-山羊抗大鼠IgG为二抗(1∶500稀释),37 ℃避光孵育1 h;TBST清洗数次,DAPI室温避光复染5 min,TBST清洗数次,最后滴加抗淬灭剂封片,尽快于激光共聚焦显微镜观察拍照。
2 结 果
2.1 捻转血矛线虫lipase基因的克隆
2.1.1Lipase蛋白预测分析根据http://www.cbs.dtu.dk/services/SignalP/预测分析蛋白质,结果显示前18个氨基酸是信号肽区域(图1)。

图1 Hc-Lipase氨基酸序列分析Fig.1 Analysing of lipaseamino acid sequence
2.1.2Lipase基因克隆PCR产物经琼脂糖凝胶电泳可见864 bp处有一条特异性条带(图2A),回收纯化PCR产物,与载体pMD-19T连接,重组质粒经双酶切后,得到大小约为864 bp的目的片段和2 800 bp左右的载体片段(图2B)。
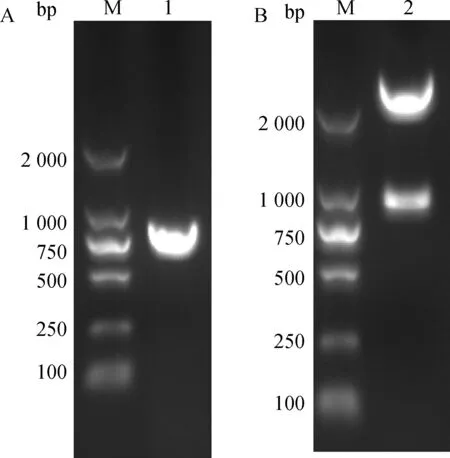
A. RT-PCR产物琼脂糖凝胶电泳;B. 重组质粒pMD-19T-Lipase双酶切鉴定;M. DNA相对分子质量标准DL2000;1. RT-PCR扩增产物;2. 重组质粒经EcoR Ⅰ和Sac Ⅰ双酶切A. Agarose gel electrophoresis of lipase RT-PCR products; B. Identification of recombinant plasmid pMD-19T-Lipase by restriction enzyme digestion; M. DNA marker DL2000; 1. Products of RT-PCR; 2. Recombinant plasmid digested by double enzymes图2 Lipase基因的克隆及鉴定Fig.2 Cloning and identification of lipase gene
2.2 捻转血矛线虫Lipase多重分析
NCBI在线比对扩增片段的氨基酸序列,结果显示与Haemonchuscontortus相似性达100%;与Dictyocaulusviviparous、Ancylostomaceylanicum、Ancylostomaduodenale相似性分别是65%、65%、61%;与秀丽隐杆线虫类Caenorhabditisbriggsae、Caenorhabditisbrenneri、Caenorhabditisremanei、Caenorhabditiselegans相似性分别是65%、52%、 51%、 51%。
由进化树分析结果(图3),可粗略估计这几个同源性相近的线虫在进化时间和地位上的相对性,捻转血矛线虫(Haemonchuscontortus)Lipase与Dictyocaulusviviparous、Ancylostomaceylanicum、Ancylostomaduodenale共处于一个分支,因此可猜测四者在进化时间上相对其他线虫更相近,同处于一个更近的进化地位。

图3 捻转血矛线虫Lipase氨基酸多重分析Fig.3 Multiple alignment of amino acid sequence of Hc-Lipase
2.3 捻转血矛线虫lipase基因的原核表达
构建的pET-32a(+)-Lipase质粒经双酶切鉴定,结果显示有一条5 900 bp左右的载体片段和一条约864 bp的目的片段,与预期结果一致(图4)。
SDS-PAGE结果显示,pET-32a(+)-Lipase表达产物为50 ku左右,且其表达量随着诱导时间的延长不断增高,并在诱导6 h时达到最高(图5A)。诱导表达后的菌体破碎物显示,目的蛋白质主要以包涵体的形式存在,利用His蛋白纯化柱纯化得到目的蛋白质,SDS-PAGE显示纯化效果较好(图5B)。

M. DNA相对分子质量标准DL2000;1. 重组质粒经EcoR Ⅰ和Sac Ⅰ双酶切M. DNA marker DL2000; 1. Recombinant plasmid digested by EcoR Ⅰ and Sac Ⅰ图4 重组表达质粒pET-32a(+)-Lipase的鉴定Fig.4 Identification of recombinant expression plasmid pET-32a(+)-Lipase
2.4 融合蛋白质的抗原特性分析
Western blot检测结果显示,在50 ku左右有一条特异性条带,而阴性对照没有条带出现(图6),说明Lipase蛋白具有良好的抗原特性,能被宿主免疫系统识别。

M. 蛋白质相对分子质量标准;1~2. pET-32a(+)诱导0和5 h的裂解产物;3~9. pET-32a(+)-Lipase诱导表达0~6 h的细菌裂解产物;10. pET-32a(+)-Lipase诱导6 h后的裂解产物;11. 表达产物上清;12. 表达产物包涵体;13.纯化后的目的蛋白质M. Protein molecular weight marker; 1-2. pET-32a(+) induced by IPTG for 0 and 5 hours; 3-9. pET-32a(+)-Lipase induced by IPTG for 0-6 hours; 10. pET-32a(+)-Lipase induced by IPTG for 6 hours;11. Supernatant of expression products; 12. Precipitate of expression products; 13. Purification of target protein图5 pET-32a(+)-Lipase的表达(A)与纯化(B)Fig.5 Expression (A) and purification (B) of pET-32a(+)-Lipase

M.蛋白质相对分子质量标准;1. 融合蛋白与感染山羊血清的Western blot分析;2. 阴性对照M. Protein molecular weight marker; 1. Fusion protein recognized by serum from infected goat as primary antibody; 2. Negative control图6 融合蛋白质的Western blot 分析Fig.6 Western blot analysis of fusion protein
2.5 融合蛋白的酶活性分析
2.5.1融合蛋白的酶活最适条件结果表明pET32a标签蛋白可近似认为不具有脂肪酶活性,融合蛋白Lipase具有一定的脂肪酶活性,且酶促反应最佳条件为37 ℃左右,pH为7左右(图7)。
2.5.2融合蛋白Km结果显示底物浓度(S)与反应速度(v)双倒数关系线方程为y=7.648 9x+67.867,因此该脂肪酶km值为0.118 mmol·L-1(图8)。
2.6 Lipase阶段性表达
结果显示,内参基因和目的基因△Ct与模板浓度关系回归线方程式为y=0.046 2x+3.547 5,R2=0.104 1;斜率绝对值<0.1 (图9),因此引物符合要求,用此引物进行阶段性探究,结果显示Hc-Lipase具有阶段性表达现象,且基因在雄虫表达量最高,是雌虫的7.522 343倍,三期幼虫阶段表达量最低是雌虫的0.026 569倍,而在虫卵阶段表达量是雌虫的4.968 598倍(图10)。
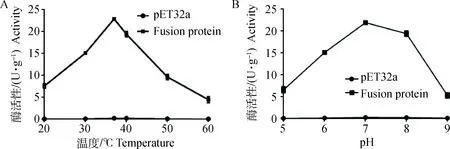
图7 温度和pH对融合蛋白脂肪酶活性影响Fig.7 The effect of temperature and pH on the Lipase activity of fusion protein

图8 底物浓度与反应速度关系Fig.8 The relationship between substrate concentration and velocity
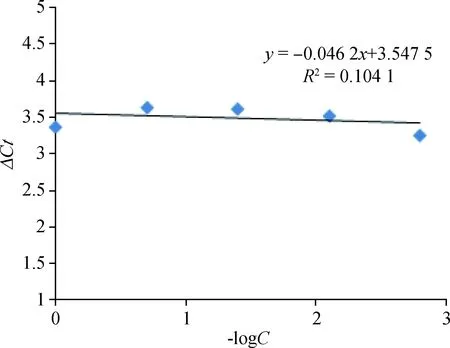
图9 lipase基因引物有效性试验结果Fig.9 The results of effectiveness of lipase primers
2.7 Hc-Lipase在虫体的组织定位
结果显示Hc-Lipase在雌虫、雄虫组织上均有表达,大多在虫体表皮和肠腔表面,其他部位组织有少量表达。对照组未检测出红色荧光(图11)。
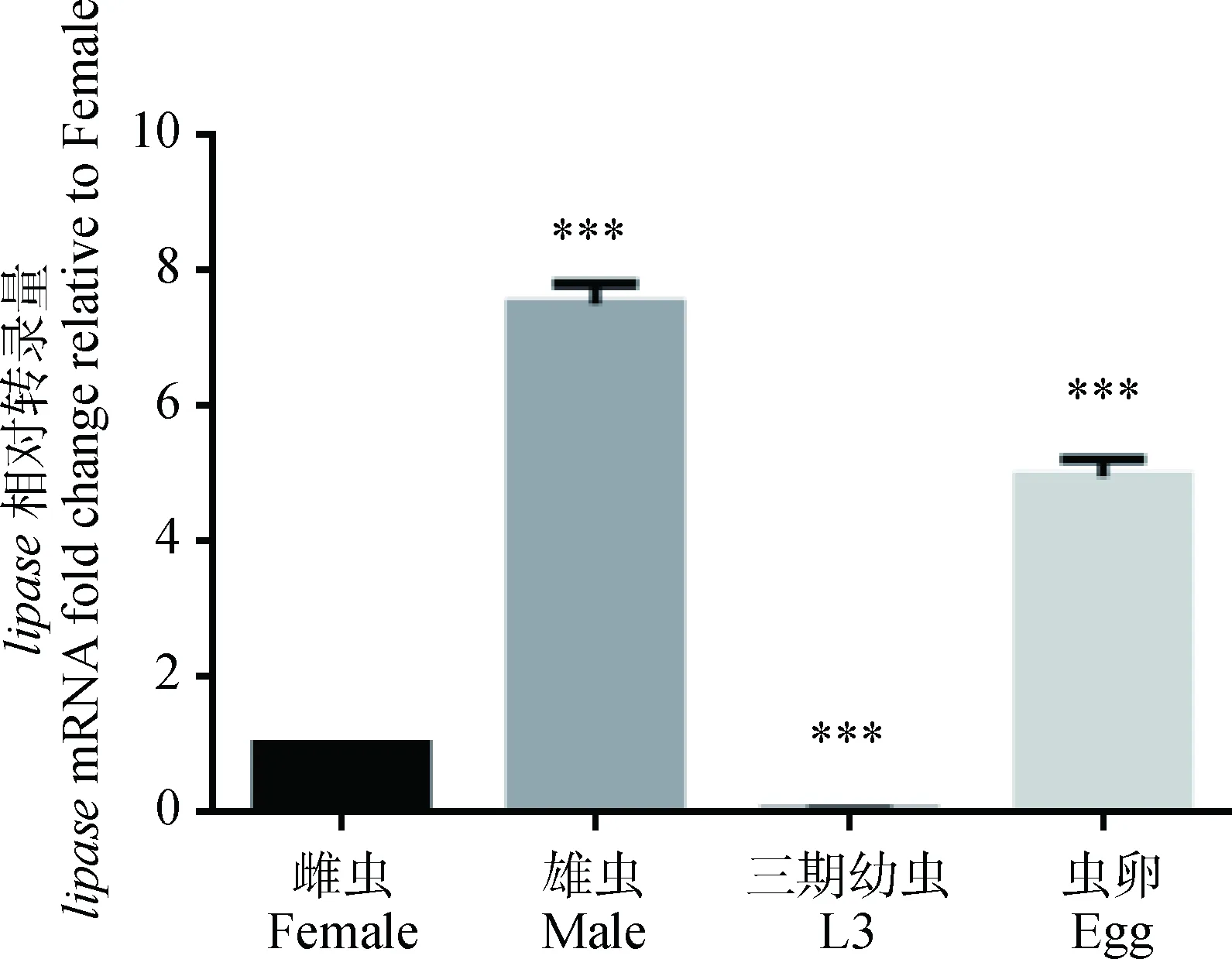
P(Male)<0.01;P(L3)<0.001;P(Egg)<0.001图10 lipase在各生活期的相对转录量Fig.10 The transcription of lipase gene in different life cycles
3 讨 论
随着防控捻转血矛线虫病的化学药物的广泛大量使用,使耐药虫株不断出现,这给疾病的防治带来巨大困难[10],因此寻找新的药物靶标和尝试采用疫苗等免疫学手段防治捻转血矛线虫病受到大家更广泛的关注。从而,寻找具免疫保护性的虫体特异性抗原成为探究新的防治方法必要前提[11],众多研究表明,Lipase(脂肪酶)是一类重要的分泌蛋白之一,且与捻转血矛线虫发育调节相关,因此对该蛋白质的深入研究有助于了解虫体发育调节的作用机制,对筛选出新的可用于抗捻转血矛线虫的潜在靶标具有重要意义。
本文选取捻转血矛线虫Lipase进行克隆表达,在NCBI比对分析其氨基酸序列[12],发现捻转血矛线虫Lipase与一些线虫相关氨基酸有较高同源性,具有保守结构域。捻转血矛线虫(H.contortus)与胎生网尾线虫(Dictyocaulusviviparous)、锡兰钩口线虫(Ancylostomaceylanicum)、十二指肠钩口线虫(Ancylostomaduodenale)脂肪酶相似性较高,且在同一个进化分支上,因此可粗略估计脂肪酶类进化中,捻转血矛线虫在进化地位和时间上与这三者相对其他更接近[12-13],与其保守序列的功能和关系需深入探究。

胞核结合DAPI(蓝色),靶蛋白集合Cy3(红色)。A、B捻转血矛线虫Lipase在雌雄成虫定位情况; C:阴性对照组没有靶蛋白荧光Nuclei were stained with DAPI (blue) and target protein with Cy3 (red). A, B. The Hc-Lipase positioning at male and female adult worm’s; C. No fluorescence was observed in control图11 激光共聚焦分析捻转血矛线虫Lipase在成虫组织定位Fig.11 Localisation of Hc-Lipase in H. contortus adult worm by immunofluorescence assay
经脂肪酶活性检测可知,所纯化的融合蛋白质具有脂肪酶活性,在37 ℃、pH7条件下酶活性最高。据资料报道,水产动物刺参肠道内脂肪酶的最适条件为40 ℃和pH7.5,葡萄球菌脂肪酶为40 ℃和pH6.8~7.5,米根霉类脂肪酶为40 ℃和pH8.5,假丝酵母类脂肪酶为37 ℃和pH7.4[14-17],这说明不同物种脂肪酶最适条件不同,可推测与其分泌部位环境和所属动物的习性有密切关系。Western blot 分析显示,构建的融合蛋白质具有良好反应原性[18], Lipase对虫体免疫的调节作用还需要进一步研究。
随着实时定量PCR的应用,很多研究证明RT-PCR对基因量检测的优越性和可靠性[19],已有文章报道应用此方法检测线虫某基因在生活周期阶段性表达量[20-21];同样,本试验采用△△Ct方法检测显示Hc-Lipase在雄虫阶段表达量最高。有关研究证明,抗原的组织表达量和其对虫体免疫调节作用重要性有一定联系[22],因此Lipase可能是捻转血矛线虫重要抗原之一,对其如何调节发育和免疫功能的机制还需探究。
S. H. Nagaraj等[23]报道称mRNA的转录水平与蛋白质的表达之间是相互独立的两个过程,因此本研究通过免疫组化的方法进一步分析了Lipase在雌虫、雄虫中的组织定位。免疫荧光技术的基础是抗原抗体的反应,利用已知的荧光抗体(抗大鼠Cy3抗体)直接与捻转血矛线虫组织结合,具有简单快捷、精度准确的特点。本试验发现Hc-Lipase主要在虫体表皮、肠腔表面及肠段组织表达,此结果证明Lipase是虫体结构组成的重要部分;且有研究证明,在虫体(尤其是表皮、肠腔)表达较多的抗原物质更可能与抗原分泌及寄生虫感染有密切关联,对免疫细胞功能也具有调节作用[24-25],因此有理由认为Lipase与虫体抗原性和分泌有关,也与病原体免疫逃避密切相关,在病原体免疫调节上具有重要地位。深入研究捻转血矛线虫脂肪酶的功能,对发现新的防治靶标具有重要意义。
4 结 论
捻转血矛线虫脂肪酶基因序列具有一定保守性,但与其他线虫脂肪酶在同源性和进化的时间、地位上有所不同;与脂肪代谢有关且具有较高的反应原性;在虫体分布较广泛,尤其虫体表面以及肠腔,且其表达具有一定阶段性。推测该抗原蛋白可能参与虫体发育、代谢和调节宿主免疫应答等过程。
参考文献(References):
[1]EMERY D L, HUNT P W, LE JAMBRE L F.Haemonchuscontortus: the then and now, and where to from here?[J].IntJParasitol, 2016, 46(12): 755-769.
[2]SIMPSON H V. Pathophysiology of abomasal parasitism: is the host or parasite responsible?[J].VetJ, 2000, 160(3): 177-191.
[3]张家峥, 刘晓燕, 张华. 羊的捻转血矛线虫病的危害及防治[J]. 兽药市场指南, 2005(7): 34-35.
ZHANG J Z, LIU X Y, ZHANG H. The damage and control ofHaemonchuscontortusin goat[J].TheMarkingGuidelineofVeterinaryDrug, 2005(7): 34-35. (in Chinese)
[4]YE J L, ZHU A D, TAO N G, et al. Comprehensive analysis of expressed sequence tags from the pulp of the red mutant ‘Cara Cara’ navel orange (CitrussinensisOsbeck)[J].JIntegrPlantBiol, 2010, 52(10): 856-867.
[5]KAMINSKY R, DUCRAY P, JUNG M, et al. A new class of anthelmintics effective against drug-resistant nematodes[J].Nature, 2008, 452(7184): 176-180.
[6]孙伟. 捻转血矛线虫HC29、Dim-1和Lipase基因的克隆及免疫保护作用研究[D]. 南京: 南京农业大学, 2011.
SUN W. Cloning and immunolprotection of HC29, Dim-1 and Lipase fromHaemonchuscontortus[D]. Nanjing: Nanjing Agricultural University, 2011. (in Chinese)
[8]JASMER D P, ROTH J, MYLER P J. Cathepsin B-like cysteine proteases andCaenorhabditiseleganshomologues dominate gene products expressed in adultHaemonchuscontortusintestine[J].MolBiochemParasitol, 2001, 116(2): 159-169.
[9]LIVAK K J, SCHMITTGEN T D. Analysis of relative gene expression data using real-time quantitative PCR and the method[J].Methods, 2001, 25(4): 402-408.
[10]CHEN J. Parasitoligy[M]. London: Taylor & Francis, 2000.
[11]邹继新, 刘云. 绵羊消化道线虫病的防治措施[J]. 中国畜牧兽医文摘, 2013, 29(10): 90.
ZOU J X, LIU Y. Prevention and control measures of intestinal helminthasis in sheep[J].ChineseDigestofAnimalandVeterinaryScience, 2013, 29(10): 90. (in Chinese)
[12]HARNETT W. Secretory products of helminth parasites as immunomodulators[J].MolBiochemParasitol, 2014, 195(2): 130-136.
[13]GADAHI J A, LI B J, EHSAN M, et al. RecombinantHaemonchuscontortus24 kDa excretory/secretory protein (rHcES-24) modulate the immune functions of goat PBMCsinvitro[J].Oncotarget, 2016, 7(51): 83926-83937.
[14]SATOMURA A, KURODA K, UEDA M. Generation of a functionally distinctRhizopusoryzaelipase through protein folding memory[J].PLoSOne, 2015, 10(5): e0124545, doi: 10.1371/journal.pone.0124545.
[15]BISWAS L, BISWAS R, NERZ C, et al. Role of the twin-arginine translocation pathway inStaphylococcus[J].JBacteriol, 2009, 191(19): 5921-5929, doi: 10.1128/JB.00642-09.
[16]孟刚. 磁性纳米颗粒的制备和表征及在脂肪酶固定化方面的研究[D]. 北京: 中国石油大学, 2009.
MENG G. Preparation and characterization of magnetic nanoparticles and its application in the immobilization of lipase[D]. Beijing: China University of Petroleum, 2009. (in Chinese)
[17]白燕, 王维新. 刺参肠道蛋白酶、淀粉酶、脂肪酶与纤维素酶活性的测定方法[J]. 饲料工业, 2012, 33(20): 28-32.
BAI Y, WANG W X. The methods of the activity about protease, amylase, lipase and cellilase[J].FeedIndustry, 2012, 33(20): 28-32. (in Chinese)
[18]杨汉春. 动物免疫学[M]. 2版. 北京: 中国农业大学出版社, 2003: 10.
YANG H C. Animal immunology[M]. 2nd ed. Beijing: China Agricultural University Press, 2003: 10. (in Chinese)
[19]BUSTIN S A. Quantification of mRNA using real-time reverse transcription PCR (RT-PCR): trends and problems[J].JMolEndocrinol, 2002, 29(1): 23-39.
[20]SCHNIEDER T, HEISE M, EPE C. Genus-specific PCR for the differentiation of eggs or larvae from gastrointestinal nematodes of ruminants[J].ParasitolRes, 1999, 85(11): 895-898.
[21]张志凯. 捻转血矛线虫新基因Hcher-1和HcMSP的克隆与阶段性表达特性分析[D]. 南京: 南京农业大学, 2011.
ZHANG Z K. Cloning and differential expression analysis ofHcher-1 andHcMSPgenes inHaemonchuscontortus[D]. Nanjing: Nanjing Agricultural University, 2011. (in Chinese)
[22]王小环, 杨莲如, 赵林立, 等. 免疫荧光检测技术及其在寄生虫检测中的应用进展[J]. 中国畜牧兽医, 2012, 39(3): 81-84.
WANG X H, YANG L R, ZHAO L L, et al. Brief introduction of immunefluorescent test technology and application progress on parasites detection[J]ChinaAnimalHusbandry&VeterinaryMedicine, 2012, 39(3): 81-84. (in Chinese)
[23]NAGARAJ S H, HARSHA H C, REVERTER A, et al. Proteomic analysis of the abomasal mucosal response following infection by the nematode,Haemonchuscontortus, in genetically resistant and susceptible sheep[J].JProteomics, 2012, 75(7): 2141-2152.
[24]马春晓. 捻转血矛线虫精氨酸激酶的克隆表达及其抗原特性分析[D]. 南京: 南京农业大学, 2014.
MA C X. Arginine kinase inHaemonchuscontortus: cloning, expression and antigenic characteristics analysis[D]. Nanjing: Nanjing Agricultural University, 2014. (in Chinese)
[25]牛延萍. 捻转血矛线虫过氧化物酶基因的克隆和5种蛋白的抗原特性分析[D]. 南京: 南京农业大学, 2012.
NIU Y P. Cloning of peroxidase and antigenic characteristics analysis of five proteins inHaemonchuscontortus[D]. Nanjing: Nanjing Agricultural University, 2012. (in Chinese)
