IL-6诱导鼻咽癌CNE-2细胞分泌IL-10的机制研究
2018-04-04,,,,
,,, ,
(1.川北医学院附属医院耳鼻咽喉科,四川 南充 637000;2.川北医学院附属医院肿瘤科,四川 南充 637000)
白细胞介素6(interleukin-6,IL-6)作为经典的促炎症细胞因子,可介导组织局部微环境及全身的炎症免疫应答,在感染性疾病、自身免疫性疾病以及肿瘤的发生发展中起着重要作用[1-2]。有文献证实,在肿瘤中IL-6的表达和分泌水平明显增加,并通过其相应的受体直接作用于肿瘤细胞,诱导其分泌基质金属蛋白或上皮间质化,从而有利于肿瘤细胞的增殖和转移[3-4]。此外,IL-6还可以作用于初始CD4+细胞,诱导其分化成熟为Th17细胞,进而通过其效应因子IL-17促进肿瘤细胞分泌促血管因子VEGF-A,诱导新生血管的形成[5]。然而,IL-6在肿瘤中的生物学特性仍未完全阐明。早期研究发现,IL-6能够诱导免疫调节性细胞因子IL-10的表达[6],提示IL-6可经IL-10参与介导免疫抑制微环境的形成。在鼻咽癌中,肿瘤细胞可高表达IL-6的受体并分泌IL-10[7-8]。基于IL-10在肿瘤免疫抑制中的主导地位,那么,IL-6是否能够诱导鼻咽癌细胞产生IL-10,进而影响肿瘤的进程呢?本研究拟体外培养鼻咽癌细胞系CNE-2细胞并利用IL-6进行刺激,探讨IL-6是否参与诱导鼻咽癌细胞分泌IL-10,并初步阐明其可能的分子机制。
1 材料与方法
1.1 材料
重组人细胞因子IL-6购自美国Peprotech公司,IL-10 ELISA检测试剂盒购自深圳达科为公司,抗IL-6R抗体购自美国Biolegend公司,mRNA提取试剂盒购自美国invitrogen公司,逆转录试剂盒和SYBR Green Real-time PCR Master Mix购自日本Toyobo公司,NF-κB抑制剂(BAY 11-7082)、PI3K抑制剂Wortmannin、p38/MAPK抑制剂(SB203580)、JNK抑制剂(SP600125)、MEK1/2抑制剂(U0126)和STAT3抑制剂(FLLL32)购自美国MedChem Express公司,DMSO购自美国Sigma公司(所有抑制剂均用DMSO进行溶解),RPIM 1640培养基、胎牛血清以及胰酶均购自美国Hyclone公司,PBS购自北京中杉金桥生物技术有限公司。人鼻咽癌细胞系CNE-2细胞购自中国科学院。
1.2 方法
1.2.1细胞培养CNE-2细胞用含10%胎牛血清的1640培养基置于37 ℃、5%的CO2培养箱中进行培养。
1.2.2细胞刺激CNE-2细胞以5×105个/孔铺于12孔板中,加入不同浓度的重组人细胞因子IL-6进行刺激(0、0.1、1、10 ng/mL),或加入5 μg/mL的抗IL-6R抗体或10 μM的BAY 11-7082(NF-κB组)、Wortmannin(PI3K组)、SB203580(p38/MAPK组)、SP600125(JNK组)、U0126(MEK1/2组)、FLLL32(STAT3组)或DMSO(与抑制剂中的DMSO含量相当,DMSO组)以及培养基(对照组)预孵育1 h,然后清洗掉孔中的培养基,再加入新的1640培养基并利用10 ng/mL的IL-6进行刺激,收集CNE-2细胞及其培养上清,用于RT-PCR及ELISA检测IL-10的水平。
1.2.3RT-PCRCNE-2细胞经RNA提取试剂盒抽提mRNA并逆转录成cDNA,然后分别利用IL-10的引物对(上游引物:5’AGAACCT GAAGACCCTCAGGC-3’,下游引物:5’CCACGGCCTTGCTCTTGTT-3’)和β-actin的引物对(上游引物:5’-TTCCTTCCTGGGCATGGAGTCC-3’,下游引物:5’-TGGCGTACAGGTCTTTGCGG-3’)进行PCR扩增,PCR反应条件为:95 ℃预变性30 s,然后以95 ℃变性5 s,60 ℃退火5 s,72 ℃延伸30 s的模式反应40个循环,使用IQ5定量PCR仪上的软件,以β-actin作为参考基因,采用2-△△Ct法分析IL-10的表达差异。
1.2.4ELISA根据IL-10的ELISA检测试剂盒操作指南,检测CNE-2细胞培养上清中的IL-10水平。
1.3 统计学处理

2 结果
2.1 IL-6诱导CNE-2细胞表达和分泌IL-10的检测
体外培养的CNE-2细胞经IL-6刺激后,检测IL-10的mRNA表达及分泌水平,结果显示:IL-6不仅可以刺激CNE-2细胞上调表达IL-10(图1a),而且能够诱导IL-10的大量分泌(图2),且IL-10的表达和分泌水平随IL-6刺激剂量的增加而增加。CNE-2细胞经IL-6刺激培养24 h后,IL-6刺激组(0.1、1、10 ng/mL)中IL-10的水平分别是(31.5±12.3)、(62.6±23.5)、(151.4±25.2)pg/mL,而未刺激组中IL-10的水平是(26.7±11.2)pg/mL。进一步利用10 ng/mL的IL-6刺激CNE-2细胞,并在不同的时间点检测IL-10的表达和分泌,结果发现:随着IL-6刺激时间的延长,IL-10的mRNA表达及分泌水平也逐渐增加(图1b、表1),由此提示IL-6可诱导鼻咽癌CNE-2细胞上调表达并分泌免疫调节性细胞因子IL-10,且具有剂量和时间依赖性。

a:IL-6在不同浓度(0、0.1、1、10 ng/mL)下刺激CNE-2细胞24 h后IL-10的mRNA表达水平;b:10 ng/mL的IL-6在不同时间点刺激CNE-2细胞表达IL-10的mRNA水平*:P<0.05;#:P<0.01
图1IL-6刺激CNE-2细胞表达IL-10的mRNA水平比较

*:P<0.05;#:P<0.01
表1不同时间的IL-6(10ng/mL)刺激CNE-2细胞分泌IL-10的水平比较(pg/mL)

时间 0h6h12h24h未刺激组 24.1±8.521.6±12.226.2±11.828.5±14.2IL-6(10ng/mL)25.2±12.755.4±10.6*108.9±18.2#146.7±20.7#
*:与第0 h及第6 h未刺激组比较,P<0.05;#:与未刺激组及第6 h刺激组比较,P<0.01
2.2 IL-6经IL-6R/NF-κB信号途径参与调控IL-10的分泌
根据IL-6可诱导CNE-2细胞分泌IL-10,我们进一步探讨其可能的机制。结果显示:在IL-6刺激的条件下,若加入抗IL-6R抗体阻断IL-6与其相应受体结合,IL-10的表达和分泌显著下降,差异具有极显著性统计学意义(P<0.01),见图3。此外,利用NF-κB抑制剂BAY 11-7082、PI3K抑制剂Wortmannin、p38/MAPK抑制剂SB203580、MEK1/2抑制剂U0126、JNK抑制剂SP600125和STAT3抑制剂FLLL32进行预处理,结果发现,在IL-6刺激的条件下,NF-κB抑制剂BAY 11-7082组中IL-10的表达和分泌水平显著低于未加抑制剂组,差异具有极显著性统计学意义(P<0.01),见图4。而加入其他抑制剂组则与未加抑制剂或DMSO组相比差异无统计学意义(P>0.05)。由此提示IL-6通过IL-6R/NF-κB信号通路诱导CNE-2细胞分泌IL-10。
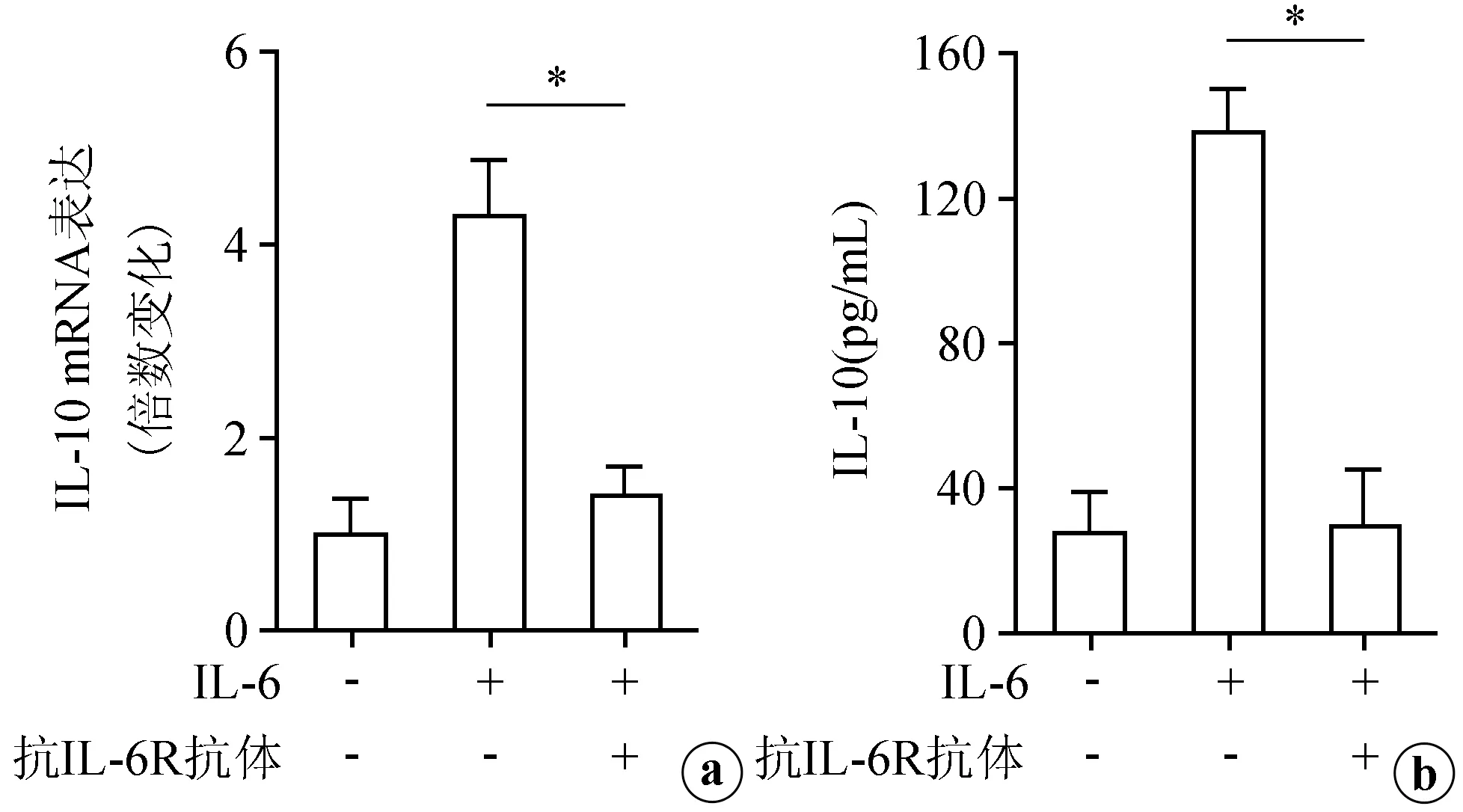
a:抗IL-6R抗体阻断后对IL-6诱导CNE-2细胞表达IL-10 mRNA水平的影响;b:抗IL-6R抗体阻断后对IL-6诱导CNE-2细胞分泌IL-10的影响*:P<0.01
图3抗IL-6R抗体阻断后对IL-6诱导IL-10表达和分泌的效果
3 讨论
目前,IL-6在肿瘤中的生物学功能得到广泛的研究和探讨[9]。文献报道肿瘤微环境中恶变的上皮细胞、成纤维细胞以及多个炎症免疫细胞均可上调诱导IL-6的表达,而IL-6则进一步通过其相应的受体以自分泌或旁分泌的方式发挥促肿瘤功能[10-11]。一方面,IL-6可直接增强肿瘤干细胞的干性特征,促进肿瘤细胞的存活和转移;另一方面,IL-6能够诱导其他炎症因子的释放,进而级联放大IL-6的促炎作用,导致肿瘤的不断进展[12]。鼻咽癌及其他癌症患者外周血中的IL-6水平显著增加,并与患者的疾病进展呈显著正相关,而患者经放射治疗后血清中的IL-6则明显下降[13-15],提示IL-6很可能与鼻咽癌的发生发展密切相关。然而,IL-6在鼻咽癌中的生物学功能特别是其抗肿瘤免疫抑制的作用机制尚未完全阐明。
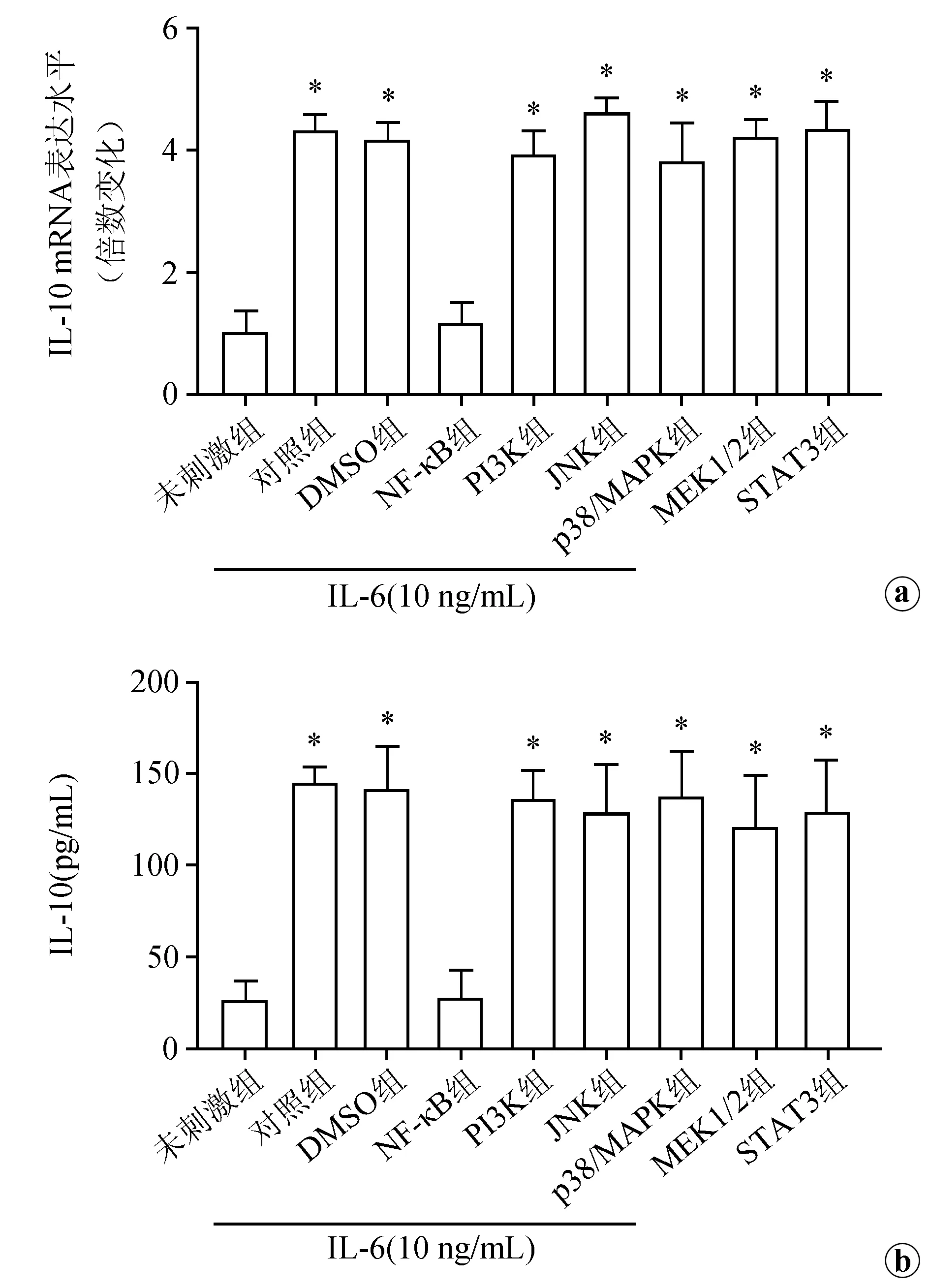
a:NF-κB抑制剂BAY 11-7082、PI3K抑制剂Wortmannin、JNK抑制剂SP600125、p38/MAPK抑制剂SB203580、MEK1/2抑制剂U0126和STAT3抑制剂FLLL32预处理对IL-6诱导CNE-2细胞表达IL-10 mRNA水平的影响;b:NF-κB抑制剂BAY 11-7082、PI3K抑制剂Wortmannin、JNK抑制剂SP600125、p38/MAPK抑制剂SB203580、MEK1/2抑制剂U0126和STAT3抑制剂FLLL32预处理对IL-6诱导CNE-2细胞分泌IL-10的影响*:与未刺激组和NF-κB组比较,P<0.01
图4不同信号通路抑制剂对IL-6诱导IL-10表达和分泌的比较
本研究发现,IL-6刺激CNE-2细胞后可检测到IL-10的mRNA表达和蛋白分泌水平显著增加,并随着其刺激剂量的增加或者刺激时间的延长而增加,其诱导CNE-2细胞表达和分泌IL-10的水平也逐渐增加。因此,这些结果表明IL-6不仅可以调控细胞因子IL-10的转录,而且能够介导IL-10转录后的翻译。基于IL-10已被公认为免疫抑制性的细胞因子,能够诱导免疫抑制性T细胞的产生并抑制效应性T细胞的抗肿瘤功能[16-17],由此表明IL-6不仅利用其诱导组织炎症的能力促使上皮细胞发生炎癌转化,而且可以诱导IL-10的分泌促使抗肿瘤免疫的下降,进一步放大其促瘤作用。那么,IL-6诱导CNE-2细胞表达和分泌IL-10的机制是什么呢?IL-6R是传递IL-6信号的唯一受体,当IL-6与细胞膜表面的IL-6R结合后,可与细胞内的gp130亚基形成复合物,进而激活下游级联信号[18]。早期的研究已经证实,IL-6R可表达于HNE1、HONE1及CNE1等多个鼻咽癌细胞系表面[7],IL-6与这些细胞表面相应的IL-6R结合后,能够诱导金属基质蛋白酶MMP2和MMP9的表达和分泌,进而降解细胞外基质成分,有助于鼻咽癌细胞的侵袭与远端转移。然而,CNE-2鼻咽癌细胞系是否表达IL-6R并经此调控IL-6的生物学功能并不清楚。因此,本研究利用抗IL-6R的抗体阻止IL-6与其相结合,结果观察到IL-6刺激CNE-2细胞表达和分泌IL-10的水平显著下降。基于IL-6R是IL-6的唯一受体,由此提示CNE-2细胞表达IL-6R,可用于体外研究IL-6对鼻咽癌细胞的生物学作用。
目前,已有文献报道IL-6与IL-6R结合后,多个信号通路转录因子参与介导其下游的生物学调控[19-20]。那么,IL-6是通过什么信号途径诱导CNE-2表达和分泌IL-10呢?因此,本研究分别加入多个信号转录途径的抑制剂对CNE-2细胞进行处理,结果发现在IL-6的刺激下,预先加入NF-κB信号抑制剂BAY 11-7082的处理组中,CNE-2细胞表达和分泌IL-10的水平显著低于未加信号抑制剂组,而PI3K抑制剂Wortmannin、p38/MAPK抑制剂SB203580、STAT3抑制剂FLLL32、MEK1/2抑制剂U0126和JNK抑制剂SP600125处理组中IL-10的表达和分泌水平则与未加抑制剂组无明显差异,由此证实IL-6与其相应的受体IL-6R结合后,可激活NF-κB信号,进而诱导IL-10的转录和翻译。其他信号通路包括PI3K、STAT3、p38/MAPK、MEK1/2和JNK等被报道可被IL-6激活,但是这些信号很可能不参与调控IL-6诱导IL-10的表达和分泌。因此,尽管IL-6可经其受体活化多个下游信号通路,调控大量的基因进行转录和翻译,但是针对某一个特定基因如IL-10的表达很可能由单一的信号转录因子参与介导,而并非多个信号同时参与转录调控其表达和分泌。在肿瘤组织中,IL-10是经典的抗肿瘤免疫抑制性因子,IL-10的大量分泌可导致抗肿瘤免疫细胞的功能显著下降,进而有利于肿瘤细胞的免疫逃逸。因此,在鼻咽癌中,IL-6可能通过刺激鼻咽癌细胞上调表达和分泌IL-10,参与诱导鼻咽癌抗肿瘤免疫抑制微环境的形成,进而促进鼻咽癌的不断进展。
综上,IL-6可通过IL-6R及其下游NF-κB信号途径诱导鼻咽癌CNE-2细胞表达和分泌IL-10,进而导致抗肿瘤免疫抑制的形成。因此,本研究为全面阐明IL-6在鼻咽癌微环境中的促瘤作用提供了新的实验证据,并将为临床设计靶向阻断鼻咽癌中IL-6的肿瘤免疫治疗提供新思路。
[参考文献]
[1] Rose-John S,Winthrop K,Calabrese L.The role of IL-6 in host defence against infections:immunobiology and clinical implications[J].Nat Rev Rheumatol,2017,13(7):399-409.doi:10.1038/nrrheum.2017.83.
[2] Yao X,Huang J,Zhong H,et al.Targeting interleukin-6 in inflammatory autoimmune diseases and cancers[J].Pharmacol Ther,2014,141(2):125-139.doi:10.1016/j.pharmthera.2013.09.004.
[3] Sun X,Zhang J,Wang Z,et al.Shp2 plays a critical role in IL-6-induced EMT in breast cancer cells[J].Int J Mol Sci,2017,18(2):E395.doi:10.3390/ijms18020395.
[4] Zergoun AA,Zebboudj A,Sellam SL,et al.IL-6/NOS2 inflammatory signals regulate MMP-9 and MMP-2 activity and disease outcome in nasopharyngeal carcinoma patients[J].Tumour Biol,2016,37(3):3505-3514.doi:10.1007/s13277-015-4186-4.
[5] Tsukamoto H,Fujieda K,Senju S,et al.Immune-suppressive effects of IL-6 on T-cell-mediated anti-tumor immunity[J].Cancer Sci,2018,109(3):523-530.doi:10.1111/cas.13433.
[6] Xu J,Yang Y,Qiu G,et al.c-Maf regulates IL-10 expression during Th17 polarization[J].J Immunol,2009,182(10):6226-6236.doi:10.4049/jimmunol.0900123.
[7] Sun W,Liu DB,Li WW,et al.Interleukin-6 promotes the migration and invasion of nasopharyngeal carcinoma cell lines and upregulates the expression of MMP-2 and MMP-9[J].Int J Oncol,2014,44(5):1551-1560.doi:10.3892/ijo.2014.2323.
[8] Savitri E,Haryana MS.Expression of interleukin-8,interleukin-10 and Epstein-Barr viral-load as prognostic indicator in nasopharyngeal carcinoma[J].Glob J Health Sci,2015,7(3):364-372.doi:10.5539/gjhs.v7n3p364.
[9] Hunter CA,Jones SA.IL-6 as a keystone cytokine in health and disease[J].Nat Immunol,2015,16(5):448-457.doi:10.1038/ni.3153.
[10] Spangler JB,Moraga I,Mendoza JL,et al.Insights into cytokine-receptor interactions from cytokine engineering[J].Annu Rev Immunol,2015,33:139-167.doi:10.1146/annurev-immunol-032713-120211.
[11] Tsang CM,Cheung YC,Lui VW,et al.Berberine suppresses tumorigenicity and growth of nasopharyngeal carcinoma cells by inhibiting STAT3 activation induced by tumor associated fibroblasts[J].BMC Cancer,2013,13:619.doi:10.1186/1471-2407-13-619.
[12] 张伟洁,郑宏.IL-6介导免疫炎性反应作用及其与疾病关系的研究进展[J].细胞与分子免疫学杂志,2017,33(5):699-703.doi:10.13423/j.cnki.cjcmi.008258.
[13] 任亮,顾涛.鼻咽癌患者放疗前后血清IL-2、IL-6和TNF-α检测的临床意义[J].放射免疫学杂志,2012,25(5):503-504.doi:10.3969/j.ssn.1008-9810.2012.05.011.
[14] Jin YB,Zhang GY,Lin KR,et al.Changes of plasma cytokines and chemokines expression level in nasopharyngeal carcinoma patients after treatment with definitive intensity-modulated radiotherapy(IMRT)[J].PLoS One,2017,12(2):e0172264.doi:10.1371/journal.pone.0172264.
[15] 孙真,薛颖,王东霞,等.血清HGF和IL-6水平与非小细胞肺癌预后的相关性研究[J].局解手术学杂志,2015,24(4):403-405.doi:10.11659/jjssx.01E015076.
[16] Mrizak D,Martin N,Barjon C,et al.Effect of nasopharyngeal carcinoma-derived exosomes on human regulatory T cells[J].J Natl Cancer Inst,2014,107(1):363.doi:10.1093/jnci/dju363.
[17] 周健,陶磊.IL-10在肿瘤中的研究进展[J].国际肿瘤学杂志,2013,40(3):181-184.doi:10.3760/cma.j.issn.1673-422x.2013.03.006.
[18] Wolf J,Rose-John S,Garbers C.Interleukin-6 and its receptors:a highly regulated and dynamic system[J].Cytokine,2014,70(1):11-20.doi:10.1016/j.cyto.2014.05.024.
[19] Lokau J,Agthe M,Flynn CM,et al.Proteolytic control of Interleukin-11 and Interleukin-6 biology[J].Biochim Biophys Acta,2017,1864(11 Pt B):2105-2117.doi:10.1016/j.bbamcr.2017.06.008.
[20] Zhu DD,Zhang J,Deng W,et al.Significance of NF-κB activation in immortalization of nasopharyngeal epithelial cells[J].Int J Cancer,2016,138(5):1175-1185.doi:10.1002/ijc.29850.
