大鼠骨关节炎模型的建立及软骨组织中MMP-13和ADAMTS-5的表达
2018-04-04,,,,
,,, ,
(安徽医科大学第二附属医院骨科,安徽 合肥 230000)
骨关节炎(osteoarthritis,OA)是一种慢性、进行性、退行性关节病变,是临床上常见的关节疾病之一。该病的发病率与年龄和性别密切相关,病变主要累及全身的大关节,膝关节是其好发关节之一。OA的发病机制目前尚未完全明了,其病理变化主要是关节软骨的丢失及软骨下骨的硬化。OA中关节软骨细胞外基质的降解、合成失衡,进而导致软骨细胞凋亡最终引起软骨丢失。构成软骨基质的骨架部分是主要是Ⅱ型胶原蛋白和聚蛋白多糖。一直以来,基质金属蛋白酶(matrix metalloproteinase,MMPs)家族被认为是降解Ⅱ型胶原和聚蛋白多糖的经典酶类,但近年来研究表明,带有血小板凝血酶敏感蛋白结构域的解聚素与金属蛋白酶(a disintegrin and metalloproteinase with thrombospondin motif,ADAMTS)家族也在OA的发病中起着重要的作用。在软骨细胞外基质的降解过程中,尤其是MMP-13和ADAMTAS-5发挥着重要作用[1]。本研究采用大鼠膝关节内侧副韧带离断联合内侧半月板切除术制作动物OA模型,并使用Western blot技术和免疫组化方法检测MMP-13和ADAMTAS-5蛋白在造模不同时期表达的变化,旨在用此模型对OA发病机制进行进一步探讨,以期能为临床早期预防、治疗OA提供理论依据。
1 材料与方法
1.1 实验动物、试剂与仪器
SD雌性大鼠40只,体质量(225±25)g,购自安徽医科大学动物实验中心(合格证号:皖医实动准字第01号)。实验于安徽医科大学第二临床学院科研实验中心实施,大鼠自由进食水,昼夜节律12 h∶12 h。实验过程严格遵循安徽省实验动物管理条例执行。抗MMP-13抗体、抗ADAMTS-5抗体(英国Abcam公司);抗β-actin抗体(中国Biosharp公司);辣根酶标记羊抗小鼠/兔二抗(北京中杉金桥生物技术有限公司);手术器械(安徽医科大学第二附属医院中心手术室提供);显微镜(日本奥林巴斯公司) 。
1.2 动物模型的制作
用电脑产生随机数字,将大鼠随机分为模型组30只和假手术组10只。大鼠用10%的水合氯醛腹腔注射麻醉成功后,取仰卧位固定于手术台上,术区常规备皮、消毒、铺巾。选取30只模型组大鼠行右膝内侧副韧带离断加内侧半月板切除术建立右膝OA模型。手术步骤:右膝关节内侧切口切开皮肤,直视下切断并剪掉部分内侧副韧带,进入关节腔。将髌骨脱位推向外侧,膝关节屈曲位,切除内侧半月板。碘伏、生理盐水冲洗切口,使用4-0缝线逐层关闭切口(图1)。另10只行右膝关节切开术,不破坏关节内部结构,作为假手术组。术后2 h所有大鼠清醒,正常进食水。术后每天每只大鼠肌肉注射青霉素20万u预防感染,连续应用3 d。
1.3 退变关节软骨大体观察
模型组大鼠分别于术后4、6、8周处死,每次处死10只。假手术组于术后8周处死。解剖术侧膝关节,观察内侧胫骨平台关节面的病理改变,按照以下评分标准进行评分:关节面光整为0分;关节面粗糙为1分;关节面糜烂为2分;关节面溃疡为3分;软骨剥脱为4分[2]。
1.4 Western blot法检测大鼠关节软骨中MMP-13和ADAMTS-5蛋白的表达水平
取下大鼠膝关节软骨,剪碎研磨,用RIPA裂解液提取总蛋白,BCA法进行总蛋白定量,100 ℃水浴10 min,使样本蛋白变性,与蛋白上样缓冲液混匀后进行电泳、转膜,取出PVDF膜用TBST溶液洗涤。体积分数8%的脱脂牛奶封闭2 h,加入一抗后置入4 ℃冰箱过夜,次日用TBST溶液洗膜。加入二抗室温下孵育1.5 h,再次用TBST洗膜。ECL法显色,显影仪显影。使用Image J测定灰度值,以β-actin作为内参,目的蛋白与β-actin的灰度比值作为其相对表达水平。

a:右膝术区消毒铺巾;b:切断内侧副韧带、切开关节囊;c:切除内侧半月板;d:缝合关节囊;e:缝合皮肤
1.5 免疫组化检测大鼠关节软骨中MMP-13和ADAMTS-5蛋白的表达水平
大鼠膝关节标本用4%多聚甲醛固定12 h,10%EDTA脱钙12周后石蜡包埋,进行常规组织石蜡切片,4 μm 组织切片脱蜡,二甲苯、梯度酒精水化,将切片放置在烧开的柠檬酸中,冷却至室温,取出切片。PBS冲洗,滴加MMP-13和ADAMTS-5兔抗鼠一抗试剂,4 ℃孵育过夜;PBS冲洗,滴加二抗,37 ℃温箱孵育20 min; PBS冲洗,滴加DAB显色,显微镜下适时终止,自来水冲洗5 min, 苏木素复染1 min,37 ℃温箱至干,加入封片剂封片。参照Pelletier等[3]的方法,显微镜下观察,每个切片随机取3个视野,每个高倍视野计数100个细胞,取观察结果的平均值进行计算。阳性细胞为软骨细胞被染成棕褐或棕黄色,计数阳性细胞的百分率,阳性细胞率=(阳性细胞数/所计数细胞总数)×100%。
1.6 统计学分析

2 结果
2.1 大体观察
假手术组胫骨平台软骨面平整光滑,关节软骨无破坏,关节边缘无骨赘形成。模型组造模术后4周胫骨平台内侧关节软骨面失去正常光泽,透明度下降,软骨面不规则;术后6周可见胫骨内侧平台软骨面粗糙糜烂,色泽灰暗,周围可见少量骨赘形成;术后8周软骨磨损进一步加重内侧平台出现软骨缺损,软骨下骨质裸露,内侧平台周围有大量骨赘形成(图2)。各组评分两两之间比较差异均有统计学意义(P<0.05),见表1、图3。
a:假手术组;b:造模4周;c:造模6周;d:造模8周

组别 0分1分2分3分4分假手术组82000造模4周26200造模6周01720造模8周00361

*:与造模4周相比,P<0.05;#:与造模6周相比,P<0.05;△:与造模8周相比,P<0.05
图3各组关节软骨损伤评分
2.2 MMP-13在各组软骨组织中的表达结果
Western blot结果显示,MMP-13在假手术组大鼠膝关节软骨组织中呈低水平表达;在造模4周组大鼠膝关节软骨组织中的表达增加;在造模6周组大鼠膝关节软骨组织中的表达水平持续增加;在造模8周组大鼠膝关节软骨组织中的表达水平较造模6周组有所下降,但高于假手术组及造模4周组水平,见图4。各组蛋白表达水平两两之间比较差异均有统计学意义(P<0.05),见图5。免疫组化结果显示假手术组关节软骨细胞中可见少量MMP-13蛋白的表达,模型组的关节软骨细胞中可见MMP-13蛋白的表达,软骨细胞的胞质可见棕黄色着色,且造模6周组较造模4周组阳性细胞百分比增加,造模8周组阳性细胞百分比较造模6周组减少,但高于假手术组及造模4周组水平,见图6。各组蛋白表达水平两两之间比较差异均有统计学意义(P<0.05),见图7。

图4 各组蛋白印记图

*:与造模4周相比,P<0.05;#:与造模6周相比,P<0.05;△:与造模8周相比,P<0.05
图5Westernblot检测各组标本MMP-13表达水平

a:假手术组;b:造模4周;c:造模6周;d:造模8周

*:与造模4周相比,P<0.05;#:与造模6周相比,P<0.05;△:与造模8周相比,P<0.05
图7各组MMP-13阳性细胞率
2.3 ADAMTS-5在各组软骨组织中的表达结果
Western blot结果显示,ADAMTS-5在假手术组及造模4周组大鼠膝关节软骨组织中呈低水平表达;在造模6周组大鼠膝关节软骨组织中的表达水平增加;在造模8周组大鼠膝关节软骨组织中的表达水平基本维持在造模6周组的水平,但高于假手术组及造模4周组水平,差异有统计学意义(P<0.05),见图8。免疫组化结果显示,假手术组及造模4周组关节软骨细胞中ADAMTS-5几乎不表达,造模6周组及造模8周组关节软骨细胞中可见少量ADAMTS-5蛋白的表达,软骨细胞的胞质可见棕黄色着色,见图9。造模6周组与造模8周组阳性细胞百分比差异无统计学意义(P>0.05),但均高于假手术组及造模4周组水平(P<0.05),见图10。

*:与造模6周相比,P<0.05;#:与造模8周相比,P<0.05
3 讨论
OA现已成为21世纪社会的主要负担之一,疾病的进展将导致关节的疼痛、无力甚至功能丧失。OA的病理变化包括关节软骨、软骨下骨、滑膜及相邻的支撑结缔组织不同程度的退变及炎症性改变[4]。临床上获取的OA标本主要是来源于OA晚期关节置换患者,即使同为OA晚期的标本,不同患者具体标本病变程度也存在差别。因此构建动物模型有利于对OA不同病变时期的研究。

a:假手术组;b:造模4周;c:造模6周;d:造模8周
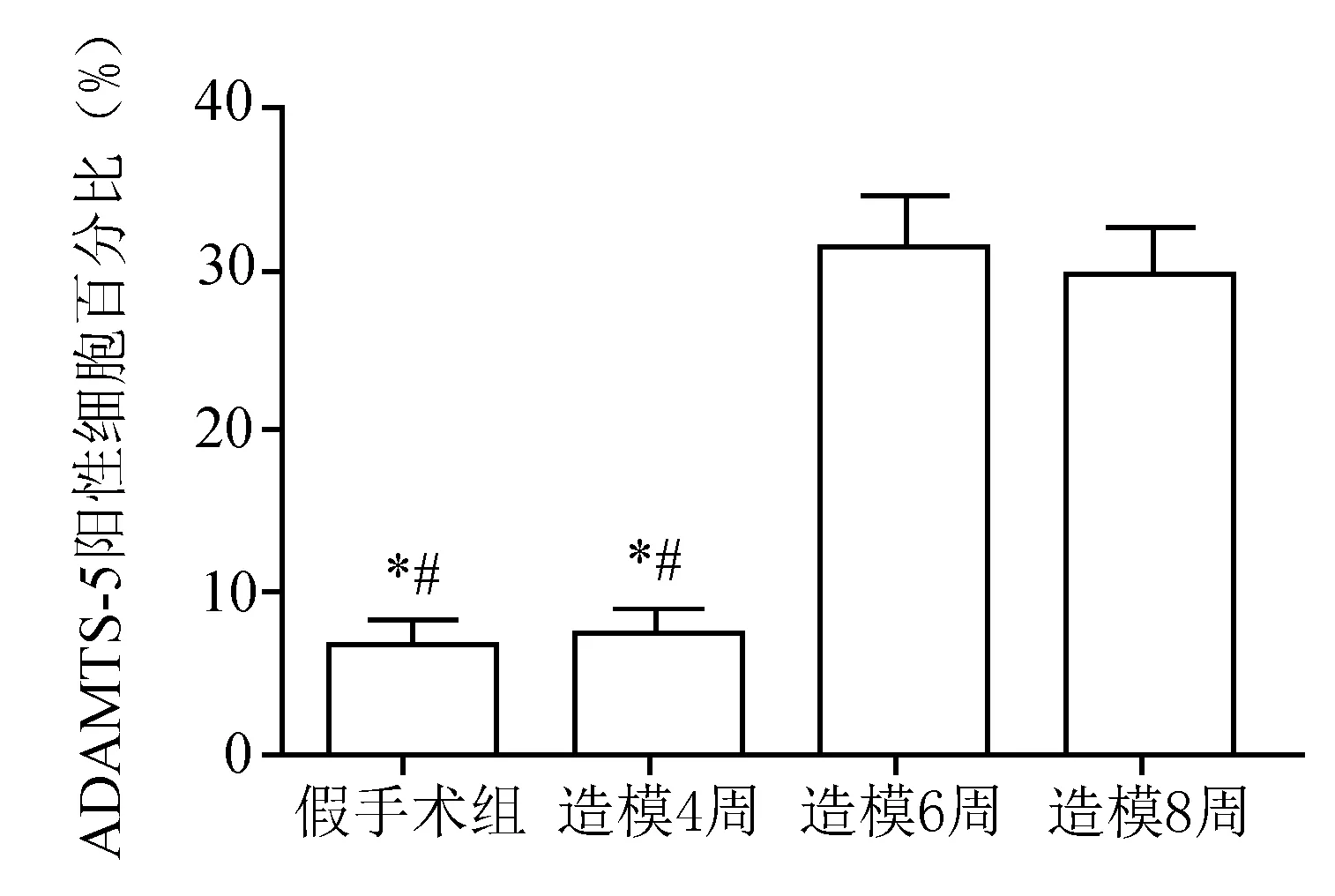
*:与造模6周相比,P<0.05;#:与造模8周相比,P<0.05
OA模型的建立方法较多,主要包括关节制动、关节腔内注射药物、关节手术等方法[6]。关节制动造模周期较长,关节腔内注射药物会影响局部代谢微环境,相较于这两者关节手术的方法具有造模可靠、造模周期短等优点。经典的手术方式有Hulth法,该造模方法是比较常用的,通过切断膝关节的内侧副韧带+切断前后交叉韧带+切除内侧半月板来构建OA模型[7]。但该方法由于关节结构破坏多,导致关节极度不稳,模型窗口期短,且不同研究人员造模效果差异较大。国内外学者纷纷在此基础上进行改良,改良法中研究者们采用较多的是单纯切断前交叉韧带方法,但该方法造模周期相对较长。我们通过离断膝关节内侧副韧带,破坏了膝关节正常的正常力学轴线造成膝关节不稳,进一步切除内侧半月板可以去除其缓冲作用,增加了股骨内髁及内侧胫骨平台关节软骨面之间的摩擦,使内侧关节软骨局部承受的压力变大,从而加速其发生退变,很好地模拟了人类OA的发生和发展的病变过程。我们观察到假手术组胫骨平台关节软骨面光滑,色泽红润。在造模术后4周组胫骨内侧平台软骨面变得粗糙、失去光泽,造模术后6 周组胫骨内侧平台形成糜烂并伴有骨赘生成,而在造模术后8周组则以关节面溃疡剥脱并伴有大量骨赘形成为主要特征。我们认为造模术后4周、6周、8周成功地复刻了OA病变的早、中、晚期病理特征,本实验采用内侧副韧带离断+内侧半月板切除的手术方式成功构建了大鼠膝OA模型。
OA是一种复杂的疾病,其发病机制目前尚不完全清楚。主要包括生物力学及代谢因素的改变,这些改变可造成关节软骨组织的代谢失衡,进而导致关节软骨的进行性丢失,骨赘形成以及继发的软骨下骨的改变[4-5]。OA的发病机制是近几年的研究热点,与关节炎的发生和发展有关的细胞因子及相关蛋白有很多,涉及的主流学说主要包括细胞因子学说、金属蛋白酶学说、自由基学说、骨内压增高学说等[8]。软骨组织由软骨细胞和细胞外基质(extracllular matrix,ECM)组成。ECM既是软骨细胞赖以生存的微环境,又在力学的传导中起到一定的缓冲作用。ECM的生成和降解失衡是导致软骨退变的重要原因之一。ECM由软骨细胞合成和分泌,主要由Ⅱ型胶原、聚蛋白多糖、透明质酸、硫酸软骨素和水分组成。正常生理条件下ECM的合成和降解处于一种动态平衡状态 ,在OA的发生发展过程中,这种平衡被打破,软骨细胞的生存环境遭到破坏[9-10]。单从金属蛋白酶学说观点来看,MMPs家族和ADAMTS家族在ECM的降解过程中发挥着重要作用。MMPs不同亚型对ECM各种成分的降解能力存在效率的差异,家族成员中MMP-13可以强有力的降解软骨基质中的Ⅱ型胶原及聚蛋白多糖。ADAMTS-5是降解聚蛋白多糖最重要的酶之一,在降解软骨聚蛋白多糖的过程中起重要作用。Hoshi等[11]进行了一项研究,他们先是采用外科手术方式诱导大鼠的OA模型,然后再往关节腔内注射MMP-13和ADAMTS-5的小干扰RNA,观察OA模型关节软骨退变的情况。通过组间比较,他们认为MMP-13和ADAMTS-5在关节软骨退变中最起着至关重要的作用。
MMP-13又称胶原酶3,已有研究表明,OA患者体内MMP-13高表达,提示增高的MMP-13与软骨降解有关[12-13]。吴宏斌等[14]采用兔膝关节前交叉韧带切断构建OA模型,通过对标本软骨中MMP-13的表达检测,发现对照组表达量很低,造模4周组表达率明显增高,但造模8周组表达率却明显下降。马文明等[15]研究了MMP-13在大鼠前交叉韧带切断加内侧半月板切除的OA模型中的表达情况,他们认为MMP-13在OA早期表达增高,中重度期后出现明显下降趋势。唐浚洲等[16]分析了手术诱导的内侧不稳定半月板小鼠OA模型中关节软骨组织中MMP-13表达水平的变化,5周小鼠软骨组织中MMP-13的表达高于对照组,术后10周软骨组织中MMP-13进一步增高。本研究证明了MMP-13在OA早期软骨组织中表达升高,中期持续升高,晚期下降,与相关研究基本一致[14-16],分析其原因可能是晚期软骨细胞凋亡过多,数量减少,MMP-13分泌不足所致。
ADAMTS-5又称聚集蛋白聚糖酶2,与ADAMTS-4的作用一样,在聚蛋白多糖的降解过程中起着重要作用[17],ADAMTS主要在聚集蛋白多糖核心蛋白球间区Glu373和Ala374位点进行水解[18]。ADAMTS-4和ADAMTS-5哪种酶对ECM中聚蛋白多糖降解起主要作用目前尚不明确[19-20]。关于ADAMTS-4的研究较多,而关于ADAMTS-5的研究相对较少,且研究者们关于ADAMTS-5不同时期表达变化的意见不能统一。张恩水等[21]依据MRI及关节镜下分级标准对OA不同时期关节液中ADAMTS-5的表达进行研究,发现ADAMTS-5在OA早、晚期组关节液中表达量高于中期OA组,呈现先下降后上升的趋势,认为ADAMTS-5在骨关节炎早期和晚期软骨破坏中均起作用。冀全博[22]采用关节镜对人软骨标本进行OA分级,对OA软骨中ADAMTS-5的表达进行研究,发现ADAMTS-5的表达在早期受到抑制,在OA进展期持续升髙,证明了其在关节软骨ECM降解中的重要作用。本研究表明ADAMTS-5在假手术组关节组骨组织中表达量甚少,在OA早期含量与假手术组比较差异无统计学意义,到中晚期表达时增加,且水平基本维持不变,说明ADAMTS-5的表达与OA的病变过程及程度密切相关。相关研究[21-22]得到不同的结果,我们分析原因可能是OA早期ADAMTS-5主要在滑膜中表达,而中晚期ADAMTS-5主要在关节软骨组织中表达,具体机制有待进一步研究证实。
随着我国人口老龄化的加快,OA的患病率会逐年增高。由于目前的治疗方案并不能够逆转疾病的病程进展,因此OA晚期患者只能行手术治疗,耗费着大量的人力、物力和财力。本研究成功建立了不同时期的大鼠OA模型,发现了不同时期软骨组织中基质降解酶表达的差异,可为基础研究和临床治疗OA提供一定的参考。阐明OA发病机制是国内外学者们的一项艰巨任务,近年来随着细胞生物学和分子生物学的迅速发展,OA的研究已取得了巨大进展。进一步探究OA的发病机制,以期未来能够在病变早期进行可逆性治疗,给众多OA患者带去福音。
[参考文献]
[1] Shen J,Chen D.Recent progress in osteoarthritis research[J].J Am Acad Orthop Surg,2014,22(7):467-468.doi:10.5435/JAAOS-22-07-467.
[2] 周凯,罗雪梅,朱明双.鼠类膝骨关节炎模型评价方法现状分析[J].风湿病与关节炎,2015,4(7):66-69.doi:10.3969/j.issn.2095-4174.2015.07.018.
[3] Pelletier JP,Jovanovic D,Fernandes JC,et al.Reduced progression of experimental osteoarthritis in vivo by selective inhibition of inducible nitric oxide synthase[J].Arthritis Rheum,2000,43(6):1275-1286.doi:10.1002/1529-0131(199807)41:7<1275::AID-ART19>3.0.CO;2-T.
[4] 祁雷,姚运峰,荆珏华.基质金属蛋白酶抑制剂在骨关节炎治疗中应用的研究进展[J].齐鲁医学杂志,2017,32(1):111-113.doi:10.13362/j.qlyx.201701038.
[5] 申晓坤,李发祥,王维山,等.关节镜治疗膝骨关节炎疗效影响因素的回归分析[J].局解手术学杂志,2016,25(8):585-588.doi:10.11659/jjssx.10E015112.
[6] 周炎,邓明,贺斌,等.大鼠诱发性骨关节炎模型构建研究进展[J].国际骨科学杂志,2016,37(5):304-310.doi:10.3969/j.issn.1673-7083.2016.05.009.
[7] Rogart J,Barrach H,Chichester C.Articular collagen degradation in the Hulth-Telhag model of osteoarthritis[J].Osteoarthr Cartilage,1999,7(6):539.doi:10.1053/joca.1999.0258.
[8] 袁普卫,杨威,康武林,等.骨性关节炎发病机制研究进展[J].中国骨质疏松杂志,2016,22(7):902-906.doi:10.3969/j.issn.1006-7108.2016.07.023.
[9] Rahmati M,Nalesso G,Mobasheri A,et al.Aging and osteoarthritis:central role of the extracellular matrix[J].Ageing Res Rev,2017,40:20-30.doi:10.1016/j.arr.2017.07.004.
[10] Gao Y,Liu S,Huang J,et al.The ECM-cell interaction of cartilage extracellular matrix on chondrocytes[J].Biomed Res Int,2014,2014(2):1-8.doi:10.1155/2014/648459.
[11] Hoshi H,Akagi R,Yamaguchi S,et al.Effect of inhibiting MMP13 and ADAMTS5 by intra-articular injection of small interfering RNA in a surgically induced osteoarthritis model of mice[J].Cell Tissue Res,2017,368(2):379-387.doi:10.1007/s00441-016-2563-y.
[12] Wang M,Sampson ER,Jin H,et al.MMP13 is a critical target gene during the progression of osteoarthritis[J].Arthritis Res Ther,2013,15(1):R5.doi:10.1186/ar4133.
[13] Liang Y,Duan L,Xiong J,et al.E2 regulates MMP-13 via targeting miR-140 in IL-1β-induced extracellular matrix degradation in human chondrocytes[J].Arthritis Res Ther,2016,18(1):105.doi:10.1186/s13075-016-0997-y.
[14] 吴宏斌,杜靖远,胡勇,等.兔前交叉韧带切断骨关节炎模型中MMP-1、MMP-13及TIMP-1的mRNA表达研究[J].中华风湿病学杂志,2002,6(3):169-173.doi:10.3760/j:issn:1007-7480.2002.03.006.
[15] 马文明,董启榕,谢宗刚,等.MMP-1、MMP-13在大鼠骨关节炎软骨中的表达[J].中国现代医药杂志,2011,13(3):5-7.doi:10.3969/j.issn.1672-9463.2011.03.002.
[16] 唐浚洲,苏楠,周思儒,等.手术诱导的小鼠骨关节炎模型中关节软骨MMP-13表达上调[J].第三军医大学学报,2014,36(9):919-922.doi:10.16016/j.1000-5404.2014.09.019.
[17] Verma P,Dalal K.ADAMTS-4 and ADAMTS-5:key enzymes in osteoarthritis[J].J Cell Biochem,2011,112(12):3507-3514.doi:10.1002/jcb.23298.
[18] Hills R,Mazzarella R,Fok K,et al.Identification of an ADAMTS-4 cleavage motif using phage display leads to the development of fluorogenic peptide substrates and reveals matrilin-3 as a novel substrate[J].J Biol Chem,2007,282(15):11101-11109.doi:10.1074/jbc.m611588200.
[19] Yatabe T,Mochizuki S,Takizawa M,et al.Hyaluronan inhibits expression of ADAMTS4(aggrecanase-1) in human osteoarthritic chondrocytes[J].Ann Rheum Dis,2009,68(6):1051.doi:10.1136/ard.2007.086884.
[20] Stanton H,Rogerson FM,East CJ,et al.ADAMTS5 is the major aggrecanase in mouse cartilage[J].Nature,2005,434(7033):648.
[21] 张恩水,闫新峰,张明,等.聚蛋白多糖酶和基质金属蛋白酶在骨关节炎不同时期关节液中的表达[J].山东大学学报(医学版),2012,50(7):87-91.doi:10.6040/j.issn.1671-7554.2012.07.019.
[22] 冀全博.ADAMTS调控骨关节炎软骨退变基质降解的机制研究[D].北京:中国人民解放军医学院,2015.
