人卵巢组织冷冻及异种移植对始基卵泡凋亡的影响❋
2018-04-03贾新转
张 娜 李 薇 张 聪 张 辉 贾新转 张 轶
(河北医科大学第四医院生殖医学科, 妇产科, 石家庄 050011)
医疗水平的进步使越来越多的年轻肿瘤患者得以长期生存,但与此同时,放化疗会严重损伤女性患者的生育力[1-2]。故对此类患者生育力的保存受到越来越多的关注。生育力保存常用3种方式:卵子冷冻、胚胎冷冻、卵巢组织冷冻。与卵子冷冻和胚胎冷冻相比,卵巢组织冷冻不仅可以解决患者将来的生育问题,还能延续女性内分泌功能。目前卵巢组织冷冻常用程序化冷冻和玻璃化冷冻2种方法,本研究分别采用这2种方法对人的卵巢组织进行冻存,然后解冻并移植到裸鼠体内,通过比较移植后始基卵泡的完整率及凋亡情况来比较2种冷冻方法的优缺点,以期寻找更适合冻存卵巢组织的方法。
1 材料和方法
1.1 人卵巢组织
实验用人卵巢组织来自于河北医科大学第四医院妇科2016年4月至2017年3月子宫内膜癌手术患者16例,患者无生育力保存要求,年龄34~40岁,平素月经规律,术前3个月无性激素服用史,无化疗史及放疗史。本研究经本院医学伦理委员会批准,患者均知情同意。
1.2 实验动物及分组
移植宿主为8周龄健康SCID裸鼠,购自北京维通利华实验动物技术有限公司。选取雌性裸鼠32只,随机分为2组:程序化冷冻组16只,移植以慢速程序化方法冻融的人卵巢组织;玻璃化冷冻组16只,移植以玻璃化方法冻融的人卵巢组织。
1.3 主要试剂及材料
乙二醇(ethylene glycol, EG)、二甲基亚砜(dimethyl sulphoxide, DMSO)、蔗糖购自美国Sigma公司;磷酸盐缓冲液(phosphate buffered saline, PBS)购自美国SAGE公司;细胞凋亡试剂盒购自南京建成生物工程研究所。
1.4 实验过程
将术中切下的卵巢组织置于预冷的PBS溶液中迅速转移至实验室,将卵巢皮质切成2 mm×2 mm×2 mm 大小的组织块,随机分为2份,每份6~8块,其中1份应用慢速程序化冷冻方法冻存卵巢组织备用,1份应用玻璃化冷冻方法冻存卵巢组织备用。解冻后的卵巢组织一半直接用4%多聚甲醛固定并做成石蜡包块备用,一半用于移植。32只裸鼠经腹部手术摘取两侧卵巢,观察3周后按分组将解冻后的人卵巢组织移植于裸鼠颈后皮下部位,6周后取下移植的人卵巢组织,用4%多聚甲醛固定并做成石蜡包块备用。
1.5 人卵巢组织的冷冻与复苏
1.5.1 慢速程序化冷冻方法 冷冻过程参考Mikkel等[3]的方法,冷冻液和解冻液均采用含10%白蛋白的PBS为基础液。放入预先加入1 ml冷冻保护液(含1.5 mol/L乙二醇、0.1 mol/L蔗糖)的1.8 ml的冷冻瓶中,4℃平衡25 min后放入慢速冷冻仪中,从4℃开始以2℃/min降至-9℃,植冰,保持10 min,然后以0.3℃/min降至-40℃,再以10℃/min降至-140℃,最后直接投入液氮保存。复苏时迅速将冷冻管放入37℃水浴锅中60~90 s,之后将卵巢组织放入解冻液中(含0.75 mol/L乙二醇、0.25 mol/L蔗糖)10 min,稀释液中(0.5 mol/L蔗糖)10 min,基础液中10 min。
1.5.2 玻璃化冷冻及解冻 冷冻过程参考汪翔等[4]的方法,基础液同慢速程序化冷冻。室温条件下,放入冷冻液(含7.5%乙二醇,7.5%二甲基亚砜)25 min,然后放入玻璃化液(含15%乙二醇、15%的二甲基亚砜、0.5 mol/L蔗糖)15 min(包括装入载杆),后直接投入液氮保存。解冻时将载杆取出后迅速放入37℃解冻液(含 1 mol/L蔗糖)中3 min,后放入稀释液(含0.5 mol/L蔗糖)中5 min,基础液中5 min。
1.6 卵巢组织病理学观察
石蜡切片后行常规H-E染色,于光镜(400倍)下观察卵巢组织,根据Gougeon[5]标准判定始基卵泡:单层扁平或扁平与立方混合的前颗粒细胞包绕初级卵母细胞。正常卵泡形态判定:颗粒细胞分布均匀,基底膜完整。异常卵泡形态判定:结构不完整或消失,颗粒细胞排列不规则、部分脱落,部分可见卵母细胞核固缩或皱缩[4]。结果判定标准:400倍高倍视野下随机取5个视野,计数各视野内正常始基卵泡数和全部始基卵泡数,正常始基卵泡率=正常始基卵泡数/全部始基卵泡数×100%。
1.7 卵巢组织凋亡检测及结果判定
应用TUNEL法检测,具体操作按试剂盒说明书进行。细胞呈棕黄色为阳性细胞,卵母细胞阳性或50%以上的颗粒细胞阳性定义为卵泡凋亡。始基卵泡凋亡率=凋亡始基细胞数/整张切片始基细胞总数×100%[6]。
1.8 统计学处理
应用SPSS 22.0统计分析软件,组间比较采用t检验和χ2检验。以P<0.05为差异有统计学意义。
2 结果
2.1 始基卵泡情况
无论是解冻后还是移植后,始基卵泡正常率2组间相比差别均无统计学意义(P>0.05)。程序化冷冻组始基卵泡正常率解冻后和移植后相比差别无统计学意义(P>0.05),玻璃化冷冻组始基卵泡正常率移植后明显低于解冻后(P<0.05)(表1)。
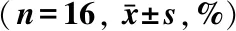
表1 2组卵巢组织中始基卵泡正常率的比较Tab 1 Comparison of the survival rate of primordial follicles in the two groups of ovarian tissues (n=16, %)
*P<0.05vsafter thawing in vitrification
2.2 卵巢组织中始基卵泡凋亡情况
2组相比,解冻后程序化冷冻组的始基卵泡凋亡率明显低于玻璃化冷冻组(P<0.05),而在移植后2组的始基卵泡凋亡率无差别(P>0.05)。无论是程序化冷冻组还是玻璃化冷冻组,解冻后和移植后相比,始基卵泡凋亡率亦无差别(P>0.05)(表2,图1)。

表2 2组卵巢组织始基卵泡凋亡率的比较[个(%)]Tab 2 The apoptosis rate of primordial follicles in the two groups of ovarian tissues [n(%)]
*P<0.05vsprogrammed freezing after thawing
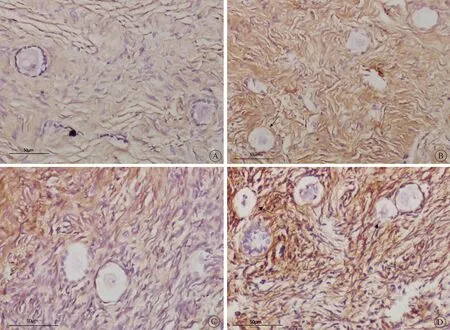
图1 卵巢组织经冷冻、移植后始基卵泡凋亡情况Fig 1 The apoptosis of primordial follicles after thawing and graft
3 讨论
卵巢组织冷冻是一种生育力保存技术,能否成功主要取决于2点:一是冷冻保存,二是冻融后移植。卵巢组织细胞不仅数量多,而且种类多,所以不同于胚胎冷冻,卵巢组织冷冻时冷冻保护剂的渗透较弱,对于不同种类的细胞渗透性和渗透时间也不同,所以卵巢组织冷冻尚没有一个标准方案。而卵巢组织复苏移植后的存活情况是决定生殖能力能否恢复的另一个关键。影响移植成功的因素有很多,包括移植后的组织所处环境的温度、压力、血供等。
目前卵巢组织冷冻的方法主要有程序化冷冻与玻璃化冷冻2种,这2种冷冻方法各有优缺点。程序化冷冻所需冷冻保护剂的浓度较低,对组织和细胞的直接毒性小,但需昂贵的冷冻设备且耗时较长,冷冻时易产生细胞内冰晶致细胞损伤。玻璃化冷冻不需使用冷冻设备,耗时短,但需使用高浓度冷冻保护剂。卵泡的发育过程为始基卵泡—初级卵泡—次级卵泡—窦前卵泡—窦卵泡,故始基卵泡是各级卵泡的起源,标志着卵巢的储备功能。因此,卵巢组织冷冻过程中始基卵泡保存完整是成功冷冻的保证。因为本研究人卵巢组织中生长期卵泡极少,所以只统计始基卵泡。
本研究结果显示,无论是程序化冷冻还是玻璃化冷冻,对卵巢组织中始基卵泡保持形态正常方面没有明显差别。但经过玻璃化冷冻后的卵巢组织移植后始基卵泡的再次损伤明显比经过程序化冷冻的要大,而卵巢组织复苏移植后的存活情况是决定生殖能力能否恢复的关键。因此可以认为,与程序化冷冻相比,玻璃化冷冻后对卵巢组织的潜在损伤更大。
自卵巢组织冷冻技术开展以来,对于始基卵泡的凋亡是否受到冷冻影响这一问题研究结果就无达成一致[4, 6-8]。本研究结果显示,程序化冷冻的卵巢组织,其始基卵泡的凋亡率明显低于玻璃化冷冻,说明程序化冷冻对卵巢组织的影响更小。但这与姬萌霞等[6]的研究结果有所不同,该学者认为两种冷冻方法对始基卵泡凋亡的影响没有差别。分析原因可能是因为卵巢组织冷冻复苏移植过程中的多个不同环节造成,如冷冻时卵巢组织块的大小、移植部位、操作人员的技术水平、实验室设备条件等。虽然始基卵泡凋亡在女性胎儿时期便开始出现,并自出生后一直贯穿整个生育期,但冻融移植后的卵巢组织始基卵泡的凋亡会不会影响将来的卵巢内分泌功能尚需更长时间的观察。
除冷冻本身对卵巢组织产生损伤外,复苏后再移植的恢复过程中亦可使卵巢组织受到不同的损伤[9-11]。影响移植成功的因素有很多,而移植后的组织由于周围的温度、压力、血供等方面的影响导致组织坏死是最主要的因素。本研究采用了颈部皮下这样一个组织结构疏松的移植部位,目的是为了减少对移植物的压力,从而进一步减少对移植卵巢组织的损伤。结果显示,经过两种冷冻方法冷冻复苏后的卵巢组织,在移植后无论是始基卵泡的正常率还是凋亡率,与解冻后相比均未出现差异,说明移植对卵巢组织存活的影响并不大。因此,将人的卵巢组织移植到裸鼠颈部皮下相对来说是成功的。
综上所述,人卵巢组织的冷冻对始基卵泡的形态及凋亡均会产生影响,相比之下,程序化冷冻对卵巢组织的影响更小。将解冻后的人卵巢组织移植到裸鼠颈部皮下相对来说是可行的。
