环氧二十碳三烯酸抑制剂通过AKT/FoxO1信号通路抑制棕榈酸诱导的心肌细胞凋亡
2018-04-03张洁张涛廖宇峰王扬淦万静
张洁,张涛,廖宇峰,王扬淦,万静*
(1武汉大学中南医院心内科,武汉430000;2武汉科技大学信息科学与工程学院,武汉 430065;3湖北医药学院附属国药东风总医院心内科,十堰 442000)
花生四烯酸(arachidonic acid,AA)是一种生物体内含量非常丰富的多不饱和脂肪酸,广泛分布于多个组织器官中[1]。花生四烯酸主要通过环氧化酶(COX)、脂氧化酶(LOX)和细胞色素P450表氧化酶(cytochrome P450)代谢,其中经细胞色素P450表氧化酶途径可代谢生成包括5, 6-EET、 8,9-EET、11,12-EET和14, 15-EET在内的4种不同类型的环氧二十碳三烯酸[2]。EETs可通过细胞膜分泌到细胞外发挥生物学作用,或由可溶性表氧化物水解酶(soluble epoxide hydrolase, sEH)代谢为生物活性明显减弱的二羟基-二十碳三烯酸(dihydrox-yeicosatrienoic acids,DHETs)[3]。研究表明,在心血管系统中,EETs可舒张冠状动脉,促进内皮细胞增殖,抑制炎性反应。14, 15-环氧二十碳-5(Z)-烯酸(14, 15-epoxyeicosa-5(Z)-enoic acid,14, 15-EEZE)是14, 15-EET的结构类似物,也是EETs的选择性拮抗剂,可抑制EETs在心血管系统中的多种保护作用[4]。14, 15-EET已被证实有抗心肌细胞凋亡作用,但是加用其抑制剂14, 15-EEZE后对心肌细胞的作用仍有待研究。细胞磷脂酰肌醇3-激酶/蛋白激酶B(phosphatidylinositol-3–kinase/AKT)信号通路参与调节对心肌细胞凋亡的保护作用,已有研究表明该通路在14, 15-EET对心肌细胞的保护作用的机制中扮演重要角色。FoxO1是FoxO家族中的亚族,同样在调节细胞周期及凋亡中发挥重要作用。因此,本实验选用14, 15-EET及其抑制剂14, 15-EEZE,观察两者对棕榈酸(palmitate acid,PA)诱导的H9c2心肌细胞凋亡的作用,同时对细胞AKT和Fox01磷酸化表达进行检测,为进一步研究 14, 15-EET及其抑制剂14, 15-EEZE在心肌细胞凋亡中的作用及机制提供线索。
材料与方法
1 细胞培养与实验分组
H9c2细胞株由武汉大学细胞典藏中心提供,用含15%胎牛血清的高糖DMEM静置孵育在37℃、5%CO2的细胞培养箱中。待细胞生长至80%~90%融合度时,0.25%胰酶消化传代,取对数生长期的细胞分为以下5组:
①阴性对照组(Vehicle):用溶媒处理;②PA对照组(Control):仅用0.25mmol/L PA(上海阿拉丁生化科技股份公司)处理;③EET组:用200 nmol/L的14, 15-EET(Cayman,美国)处理;④EEZE组:以5.0μmol/L的 14, 15-EEZE(Cayman,美国)处理;⑤EET+EEZE组:200 nmol/L的14, 15-EET与5.0μmol/L的14, 15-EEZE联合处理细胞。
2 MTT细胞抑制率检测
5组不同干预因素处理的H9c2心肌细胞持续培养24h,并于结束前4h在96孔培养板每孔中加入20µl 浓度为5mg/ml的MTT(AMRESCO,美国)固定液,除去上清液,再在每孔中加入150µl二甲基亚砜混合均匀,酶标仪检测各个孔中细胞在570nm的光吸收值。
各组细胞的增殖抑制率(%)=(1-单一或联合给药组OD值/空白对照组OD值)×100%。
3 流式细胞仪细胞凋亡率检测
5组不同干预因素处理的H9c2心肌细胞持续培养24h,0.25%胰酶消化细胞,收集细胞消化液,离心机1500r/min离心5min,除去上清液,预冷PBS重悬细胞,重悬液离心机1500r/min离心5min,除去上清液,300µl的Binding Buffer重悬细胞,再加入5µl Annexin V-FITC和5µl propidium iodide(PI)混和均匀,常温避光共同作用15min,流式细胞仪检测各组细胞的凋亡率。
4 免疫印迹法检测p-AKT和p-FoxO1表达水平
5组不同干预因素处理的H9c2心肌细胞持续培养24h,吸出培养基,预冷PBS冲洗后加入细胞裂解液,充分作用后用细胞刮刮下细胞,放入离心管中冰浴30min,离心机12000r/min离心5min,收集上清,移入新的离心管,-20℃冰箱中保存蛋白。实验时选择BCA法检测蛋白浓度。提取蛋白,采用SDS-PAGE凝胶电泳、转膜,室温下用含5%脱脂牛奶的TBST封闭1h,分别加入1:500稀释的一抗(兔抗人p-AKT、AKT、p-FoxO1、FoxO1,Santa Cruze,美国),4℃孵育过夜,TBST室温下洗膜3次,每次5min,后加入1:3000稀释的二抗(Santa Cruz),室温下孵育30min,TBST洗膜三次,每次5min,暗室中ECL液显色曝光。
5 统计学处理
结 果
1 14, 15-EET和14, 15-EEZE分别抑制和促进对棕榈酸诱导的H9c2细胞增殖抑制
14, 15-EET和14, 15-EEZE单独或共同作用于PA预处理的H9c2细胞24h后,收集细胞MTT法检测增殖,各组细胞的增殖抑制率(%)=(1-单一或联合给药组OD值/空白对照组OD值)×100%。结果提示,相对于阴性对照组,对照组H9c2细胞增殖抑制率明显上升,表明PA可明显抑制H9c2细胞增殖能力;相对于单纯PA处理组,EET组H9c2细胞的增殖抑制率明显下降,表明14, 15-EET可削弱PA对H9c2细胞增殖的抑制作用;EEZE组H9c2细胞的增殖抑制率明显上升,表明14, 15-EEZE可增强PA对H9c2细胞增殖的抑制作用;相对于EET组,EET+EEZE组H9c2细胞增殖抑制率明显上升,表明14, 15-EEZE可削弱14, 15-EET削弱PA对H9c2细胞增殖抑制的能力(表1)。

表1 14, 15-EET和14, 15-EEZE对PA预处理H9c2细胞抑制率的影响Tab.1 The inhibitory effects of 14, 15-EET and 14, 15-EEZE on the proliferation rate of PA pretreated H9c2 cells
2 14, 15-EET和14, 15-EEZE分别抑制和促进棕榈酸诱导的H9c2细胞凋亡
14, 15-EET和14, 15-EEZE单独或共同作用于PA预处理H9c2细胞后24h,收集细胞流式细胞仪检测凋亡率。结果显示,阴性对照组心肌细胞凋亡的比例为(7.23±0.46)%,对照组心肌细胞凋亡的比例为(41.03±1.57)%、EET组为(18.02±1.18)%,EEZE组为(49.32±1.63)%,EET+EEZE组为(39.79±1.11)%(图1)。与阴性对照组比较,对照组凋亡心肌细胞比例明显升高,提示PA有明确的致H9c2细胞凋亡作用;相对于对照组,EET组心肌细胞的凋亡比例显著下降,提示14, 15-EET可以抑制PA的致H9c2心肌细胞凋亡作用;而EEZE组心肌细胞的凋亡比例显著上升,提示14, 15-EEZE可以强化PA的致H9c2心肌细胞凋亡作用;相对于EET组,EET+EEZE组心肌细胞凋亡比例明显上升,提示14, 15-EEZE可以削弱14, 15-EET对PA致H9c2心肌细胞凋亡的抑制作用。
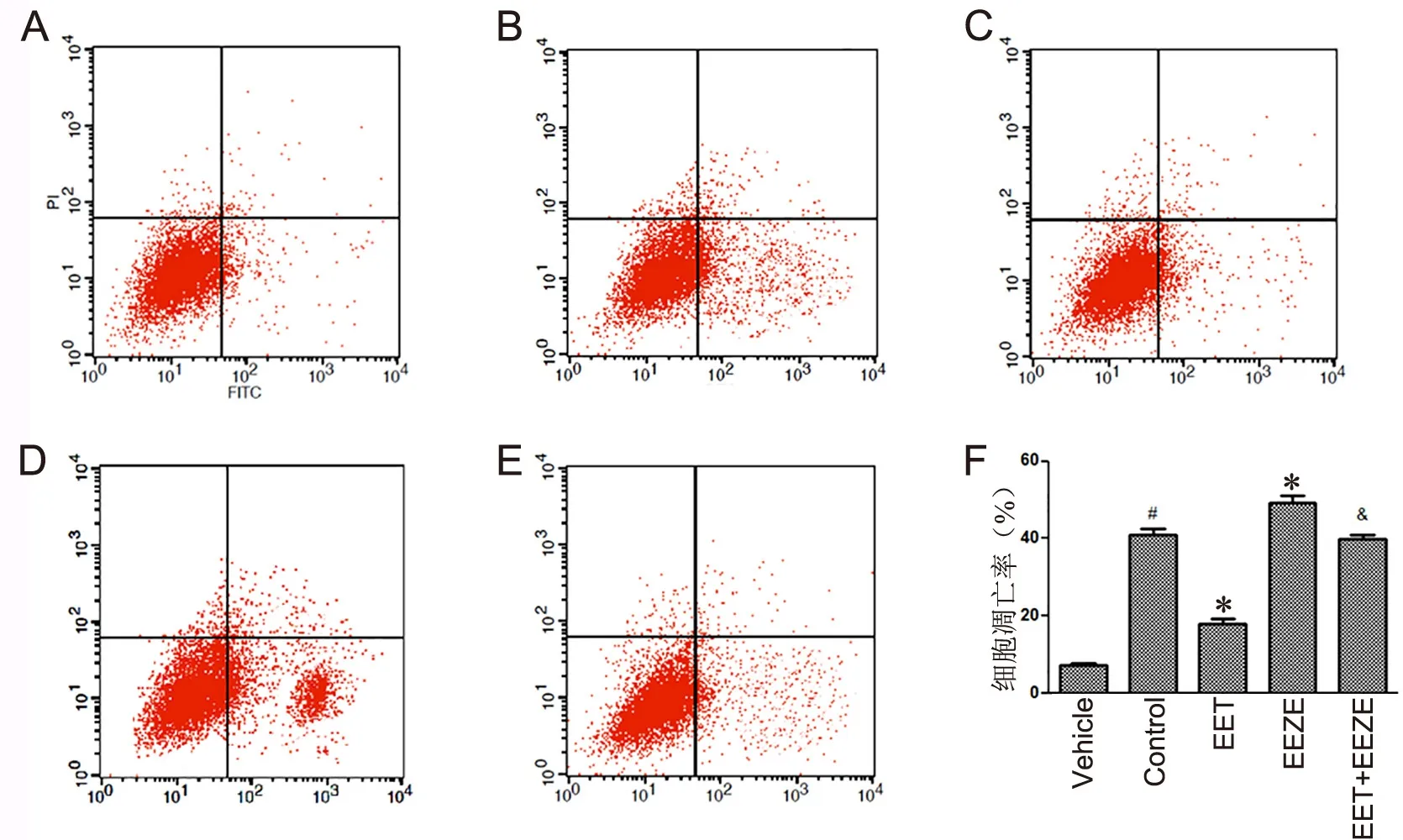
图1 14, 15-EET和14, 15-EEZE对PA预处理H9c2细胞凋亡影响的流式细胞术检测分析。A,Vehicle组;B,Control组;C,EET组;D,EEZE组;E,EET+EEZE组;F,细胞凋亡率的统计学分析 #,与阴性对照组比较,P<0.01;*,与对照组比较,P<0.01;&,与EET组比较,P<0.01;n=4Fig. 1 The effects of 14, 15-EET and 14, 15-EEZE on the apoptosis rate of PA pretreated H9c2 cells evaluated by flow cytometry. A, vehicle group; B,control group; C, EET group; D, EEZE group; E, EET+EEZE group; F, statistical analysis of apoptotic rates; #, P<0.01, compared with vehicle group;*, P<0.01, compared with control group; &, P<0.01, compared with EET group; n=4
3 14, 15-EET和14, 15-EEZE分别抑制和促进棕榈酸对H9c2细胞p-AKT和p-FoxO1水平的降低
14, 15-EET和14, 15-EEZE单独或共同作用于PA预处理H9c2细胞后24h后收集细胞提取蛋白质,Western blot检测p-AKT和p-FoxO1水平的变化。结果显示(图2),与阴性对照组相比,对照组心肌细胞p-AKT和p-FoxO1水平明显下降,提示PA的作用可明显降低H9c2细胞p-AKT和p-FoxO1水平。相对于对照组,EET组p-AKT和p-FoxO1水平显著增加,而EEZE组p-AKT和p-FoxO1水平显著减少,提示14, 15-EET可通过增加p-AKT和p-FoxO1水平的方式发挥抗PA诱导凋亡的作用,14, 15-EEZE则可通过减少p-AKT和p-FoxO1表达水平的方式发挥促PA诱导凋亡的作用。相对于EET组,EET+EEZE组心肌细胞中p-AKT和p-FoxO1表达水平的作用明显减弱,提示14, 15-EEZE削弱14, 15-EET的抗PA诱导H9c2心肌细胞凋亡作用与减弱14, 15-EET增强心肌细胞p-AKT和p-FoxO1表达水平的作用密切相关。
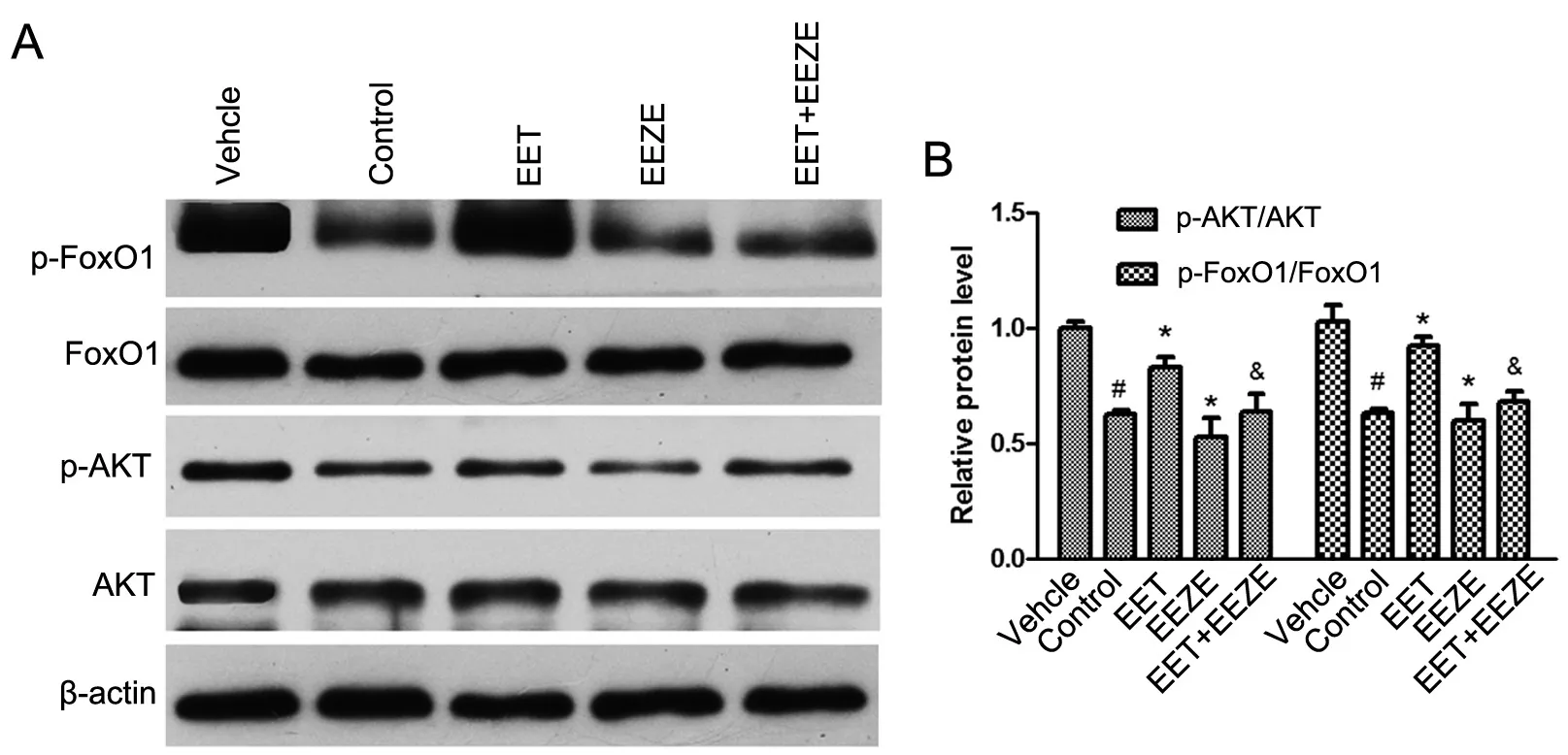
图2 Western blot检测14, 15-EET和14, 15-EEZE对PA预处理H9c2细胞p-AKT和p-FoxO水平的影响。A,代表性Western blot检测结果;B,p-AKT和p-FoxO1水平的统计学分析;#,与阴性对照组比较,P<0.01;*,与对照组比较,P<0.01;&,与EET组比较,P<0.01;n=4 Fig. 2 The effects of 14, 15-EET and 14, 15-EEZE on p-AKT and p-FoxO1 levels in PA pretreated H9c2 cells detected by Western blot. A, representative Western blot; B, statistical analysis for p-AKT and p-FoxO1 levels; #, P<0.01, compared with vehicle group; *, P<0.01, compared with control group;&, P<0.01, compared with EET group; n=4
讨 论
心血管系统疾病是全球范围内死亡率第一的疾病,其发生发展与心肌细胞的坏死和凋亡密切相关。研究发现,心肌细胞凋亡存在于心脏疾病发生发展的一系列病理生理过程中,是诸多心脏疾病发生的重要细胞学基础[5]。饱和脂肪酸正常情况下是成人心脏能量的主要来源,糖尿病、肥胖和高脂血症患者脂肪酸水平长期紊乱,造成心肌细胞内脂质异常蓄积,最终导致心肌细胞凋亡[6]。有研究显示,棕榈酸作为人体内含量最丰富的饱和脂肪酸,可诱导包括心肌细胞在内的多种细胞凋亡[7]。
EETs在心血管系统中发挥着重要的作用,研究证实EETs可通过活化PI3K/ AKT信号通路,增加抗凋亡蛋白BCL-2的表达,抑制TNF-α诱导的内皮细胞凋亡;EETs还可通过降低ICAM-1和VCAM-1的表达,增强PPARγ活性,抑制NF-κB的活化和转位,减少IκB的磷酸化等一系列机制发挥抗炎作用[8]。EETs在糖脂代谢的调节中也发挥着重要作用,可增强2型糖尿病大鼠肾脏组织对胰岛素的敏感性,延缓糖尿病肾病的发展[9];CYP2J2基因过表达EETs产量增加,可以通过抑制脂毒性相关的炎性反应和氧化应激,减轻高脂饮食诱导的小鼠肝脏脂肪变性[10]。本实验选择14, 15-EET单独或加用EETs化学合成拮抗剂14, 15-EEZE作用于PA诱导的H9c2心肌细胞,观察到14, 15-EEZE可明显削弱14, 15-EET的抗心肌细胞凋亡作用。除此之外,还有研究证实14, 15-EEZE可抑制EETs的血管舒张和缩小梗死心肌面积的作用,说明14, 15-EEZE可针对EETs在心血管系统中的保护作用发挥一系列阻断效应[4]。14, 15-EEZE无法通过减少EETs的合成发挥作用,其作用机制很可能与EETs竞争细胞膜内外特定结合位点或受体有关[11],针对EETs和14,15-EEZE相互作用的具体结合位点的研究目前仍在进行之中。
为了进一步探讨14, 15-EET抗心肌细胞凋亡的作用机制,本实验选用14, 15-EET作用于PA诱导凋亡的H9c2细胞,结果提示PA作用后H9c2细胞p-AKT蛋白表达明显减少,加入14, 15-EET后p-AKT蛋白表达明显上升,而之后14, 15-EEZE抑制剂的作用可明显减少p-AKT蛋白表达;14, 15-EEZE直接作用于PA预处理的细胞可在PA作用的基础上进一步减少p-AKT蛋白的表达。以上研究提示14, 15-EET对PA诱导的心肌细胞凋亡的保护作用与AKT信号通路的活化密切相关。FoxO转录因子家族在细胞凋亡的调节中扮演重要角色,其亚家族FoxO1在心肌细胞的存活和代谢中发挥重要作用[12,13]。AKT信号通路与FoxO蛋白活化密切相关,在AKT信号通路
[1] Pareja-Galeano H, Sanchis-Gomar F, Santos-Lozano A, et al. Serum eicosapentaenoic acid to arachidonic acid ratio is associated with cardio-healthy exceptional longevity. Int J Cardiol, 2015, 184(9): 655-656.
[2] Romashko M, Schragenheim J, Abraham NG, et al. Epoxyeicosatrienoic Acid as Therapy for Diabetic and Ischemic Cardiomyopathy. Trends Pharmacol Sci, 2016, 37(11): 945-962.
[3] Hanif A, Edin ML, Zeldin DC, et al. Nayeem MA. Deletion of soluble epoxide hydrolase enhances coronary reactive hyperemia in isolated mouse heart: role of oxylipins and PPARgamma. Am J Physiol Regul Integr Comp Physiol,2016, 311(4): R676-R688.
[4] Gross GJ, Gauthier KM, Moore J, et al. Effects of the selective EET antagonist, 14,15-EEZE, on cardioprotection produced by exogenous or endogenous EETs in the canine heart. Am J Physiol Heart Circ Physiol, 2008, 294(6): 2838-2844.
[5] Singh SS, Kang PM. Mechanisms and inhibitors of apoptosis in cardiovascular diseases. Curr Pharm Des, 2011, 17(18):1783-1793.
[6] Park M, Sabetski A, Kwan Chan Y, et al. Palmitate induces ER stress and autophagy in H9c2 cells: implications for apoptosis and adiponectin resistance. J Cell Physiol, 2015,230(3): 630-639.
[7] Zhong X, Feng Y, Su L, et al.Palmitate induced apoptosis未被激活时,FoxO蛋白通常位于细胞核内,通过诱导细胞周期抑制蛋白的表达,抑制细胞增殖。AKT通路激活后,可磷酸化转录因子FoxO,实现Fox0蛋白胞核至胞质的转运,灭活蛋白转录活性,抑制FoxO调控的下游基因表达[14]。本实验中PA的干预减少了H9c2细胞p-FoxO1蛋白的表达,加入14,15-EET后p-FoxO1蛋白表达明显上升,而之后14,15-EEZE抑制剂的作用可明显减少p-FoxO1蛋白表达。14, 15-EEZE直接作用于PA预处理的细胞可在PA作用的基础上进一步减少p-FoxO1蛋白的表达。
综上所述,14, 15-EET可通过AKT/FoxO1信号通路发挥抑制PA诱导的H9c2心肌细胞凋亡作用,14, 15-EEZE也可通过此通路发挥对14, 15-EET对PA诱导心肌细胞损伤的保护作用的抑制作用,其具体机制还有待进一步研究和阐明。in MC3T3-E1 cell by activation of nuclear factor-kappa B.Zhonghua Yi Xue Za Zhi, 2014, 94(14): 1101-1104.
[8] Oni-Orisan A, Edin ML, Lee JA, et al. Cytochrome P450-derived epoxyeicosatrienoic acids and coronary artery disease in humans: a targeted metabolomics study. J Lipid Res,2016, 57(1): 109-119.
[9] Eid S, Abou-Kheir W, Sabra R, et al. Involvement of renal cytochromes P450 and arachidonic acid metabolites in diabetic nephropathy. J Biol Regul Homeost Agents, 2013,27(3): 693-703.
[10] Zhang S, Chen G, Li N, et al. CYP2J2 overexpression ameliorates hyperlipidemia via increased fatty acid oxidation mediated by the AMPK pathway. Obesity, 2015, 23(7):1401-1413.
[11] Yang W, Holmes BB, Gopal VR, et al. Characterization of 14,15-epoxyeicosatrienoyl-sulfonamides as 14,15-epoxyeicosatrienoic acid agonists: use for studies of metabolism and ligand binding. J Pharmacol Exp Ther, 2007, 321(3):1023-1031.
[12] Xia P, Liu Y, Cheng Z. Signaling Pathways in Cardiac Myocyte Apoptosis. Biomed Res Int, 2016, 2016(5): 3261-3268.
[13] Ning Y, Li Z, Qiu Z. FOXO1 silence aggravates oxidative stress-promoted apoptosis in cardiomyocytes by reducing autophagy. J Toxicol Sci, 2015, 40(5): 637-645.
[14] Pan CW, Jin X, Zhao Y, et al. AKT-phosphorylated FOXO1 suppresses ERK activation and chemoresistance by disrupting IQGAP1-MAPK interaction. EMBO J, 2017, 36(8):995-1010.
